TMAO 对脾虚高脂血症大鼠脂代谢的影响及香砂六君子汤的干预作用
冷雪,李阳
(1. 辽宁中医药大学中西医结合学院,沈阳 110847;2. 辽宁中医药大学实验动物医学与科学学院,沈阳 110847)
血脂代谢异常是动脉粥样硬化等心血管疾病发生的潜在独立因素之一,随着人们日常饮食变化,血脂异常的发生率呈现逐年升高的趋势[1]。 中医多认为血脂代谢异常与脾失健运膏脂转输障碍密切相关[2],脾气失运,膏脂滞留体内,聚化痰浊,痰浊又加剧脾运失司,往复循环,致使膏脂内摄而难化。 脾虚引起的血脂代谢异常通常引起肝脂质沉积现象[3],可见脾、血脂代谢、肝脂代谢之间存在一定关联,研究脂代谢紊乱引起血脂代谢异常类疾病的作用机制具有重要意义。
氧化三甲胺(trimetlylamine oxide,TMAO)[4-5]为肠道菌群产生的代谢物。 研究发现TMAO 水平与血脂代谢存在明显相关性[6],同时TMAO 可以作为多种心血管疾病发生的潜在关键生物标志物[7],关键受体-蛋白激酶R 样内质网激酶(protein kinase Rlike ER kinase,PERK)为内质网跨膜蛋白,其可通过启动未折叠蛋白反应达到保护细胞损伤的作用[8];叉头框蛋白O1(forkhead box O1,FoxO1)是FOX 家族FOXO 亚科中成员之一[9],控制介导代谢调节的下游基因转录[10];FOXO1 可调控下游固醇调节元件结合蛋白-2 ( sterol-regulatory element-binding protein-2,SREBP-2)[11],SREBP-2 进而可调控下游miR-33a[12],同时miR-33a 参与下游三磷酸腺苷结合盒转运体A(ATP-binding cassette transporter A1,ABCA1) 的调控,进而FOXO1 可通过SREBP-2/miR-33a/ABCA1 信号轴影响肝脂代谢调控过程[13];Chen 等[14]发现TMAO/PERK/FOXO1 信号轴可能与脂代谢调控密切相关,前期研究也发现TMAO 与肝甘油三酯形成有一定的关联性[15]。 因此,通过预防和/或恢复TMAO 水平可能是预防肝和血脂代谢异常发生发展的有效策略。 健脾益气降浊之名方香砂六君子汤可干预脾虚高脂血症大鼠血脂代谢异常及肝代谢紊乱的作用[16]。 但是肠道菌群TMAO 如何影响血脂及肝脂代谢异常及香砂六君子汤是否通过调控肠道菌群代谢物TMAO进行的干预机制还需要深层次探究。 本研究以TMAO 为主要切入点,探讨其通过PERK/FOXO1轴调控SREBP-2/miR-33/ABCA1 信号通路影响肝脂代谢紊乱的作用机制,以及探讨香砂六君子汤对干预脂代谢异常的机制是否与TMAO 有关,以期为中医药防治血脂代谢异常类疾病提供一定的基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
50 只7 周龄SPF 级SD 雄性大鼠,体重180 ~220 g,购于辽宁长生生物技术股份有限公司【SCXK(辽)2020-0001】。 辽宁中医药大学动物实验室【SYXK(辽)2019-0004】进行常规饲养(恒温22 ~25℃,恒湿40% ~60%,昼夜各半照明),饲料由小黍有泰(北京)生物科技有限公司提供。 实验通过辽宁中医药大学实验动物伦理委员会审批(21000042022008)。
1.1.2 主要试剂与仪器
Anti-SREBP-2(Proteintech,28212-1-AP),Anti-ABCA1(Abcam,ab66217),DMB(3,3-二甲基-1-丁醇,上海麦克林,D832026),4%多聚甲醛、苏木素染液、油红O 染液(上海碧云天P0099、C0105S、C0158S),胆固醇试剂盒、甘油三酯试剂盒,(南京建成20210806、20210809);大鼠游离脂肪酸(FFA)ELISA 试剂盒(上海源桔,YJ566656)。
全自动生化分析仪(日立,7180 型,日本)、多功能全波长酶标仪(SpectraMaxi3,MD,美国);高性能组织脱水机(ASP 6025,Leica,日本)、数字扫描显微成像系统(M8,Precipoint,德国);实时荧光定量PCR 仪(7500,ABI,美国)。
1.2 方法
1.2.1 动物分组及实验干预
50 只大鼠适应1 周后,随机分为5 组,分别为:①空白对照组(C 组):普通饲料饲喂,正常饮水;②空白对照+DMB 组(C +D 组):普通饲料饲喂,饲养12 周后饮水中加入1% DMB(TMAO 抑制剂),饮用4 周;③脾虚高脂血症组(PG 组):采用高脂饲料+脾虚复合造模方法[17],造模12 周;④脾虚高脂血症+DMB 组(PG +DMB 组):采用高脂饲料+脾虚复合造模方法[17],造模12 周,之后给予DMB(饮水中加入1% DMB),4 周;⑤脾虚高脂血症+香砂六君子汤组(PG +XS 组):采用高脂饲料+脾虚复合造模方法[17],造模12 周,灌胃香砂六君子汤4周,据前期结果[15]取最高剂量每天11.34 g 生药/kg,为本实验给药剂量,每组10 只。
1.2.2 取材
模型构建及给药干预完成后,腹主动脉采血,全血一部分静置2 h 后离心20 min(3000 r/min)取上清为血清备用,一部分全血用抗凝管采血(3000r/min 离心20 min)取上清血浆,肝组织分别分装固定于4%多聚甲醛中及冻存在-80℃冰箱中。
1.2.3 全自动生化仪检测大鼠血清血脂变化
应用全自动生物化学分析仪进行大鼠血清TG、TC、LDL-C、HDL-C 含量的检测。
1.2.4 形态学染色法(HE 染色、油红O 染色)观察肝变化
取固定好的组织进行石蜡切片,操作按照HE染色试剂盒进行,光学显微镜10 × 40 倍镜下拍照;固定好的肝组织用OCT 包埋上机进行冰冻切片(6 μm),根据油红O 染色试剂盒进行操作,甘油明胶封片后,10 × 40 倍镜下拍照。
1.2.5 ELISA 法及酶标仪试剂盒法检测肝TG、TC、FFA 含量
按照ELISA 试剂盒和酶标仪试剂盒的操作要求,取离心后的肝组织上清液进行操作,之后绘制标准曲线并计算肝中FFA、TG、TC 水平。
1.2.6 LC-MS 法检测血浆TMAO 水平
将样本溶液、内标溶液、80%乙腈水溶液进行混合沉淀;再取25 μL 空白血浆,作为空白基质样本,加入25 μL 内标溶液和50 μL 80%乙腈水溶液进行沉淀;将上述样本分别涡旋混匀后,4℃离心30 min(3500 r/min),提取50 μL 上清液操作上机。
1.2.7 qRT-PCR 法检测肝PERK、FOXO1、SREBP-2、ABCA1、miR-33 mRNA 表达水平
RNA 后提取后反转录成mRNA 之后进行扩增。内参为GAPDH、U6,2-ΔΔCt法进行最后统计分析,引物序列(表1)。

表1 引物序列Table 1 Primers sequence
1.2.8 Western Blot 检测肝SREBP-2、ABCA1 蛋白含量
提取肝蛋白,蛋白定量(BCA 法)后依次进行上样、电泳、转膜、4℃过夜一抗孵育、TBST 洗涤、二抗1 h、TBST 洗涤、曝光操作等步骤,最后应用Image Studio 软件分析。
1.3 统计学分析
SPSS 19.0 统计结果数据,以平均值± 标准差(±s)表示,多组间比较应用单因素方差分析,P<0.05 表示具有统计学意义。
2 结果
2.1 血脂变化
与C 组相比,PG 大鼠血清TC、TG、LDL-C 水平升高明显,HDL-C 水平降低(P< 0.05 或P<0.01),C +D 组无显著变化;与PG 组相比,分别给予TMAO 抑制剂DMB 及灌胃香砂六君子汤后,PG+D 组和PG +XS 组大鼠血清中的TG、LDL-C 水平明显降低,HDL-C 水平升高(P<0.01),各组TC 含量有降低趋势无显著性差异;与PG +D 组相比,PG+XS 组除LDL-C 含量减少程度较低(P<0.01),其余无变化(表2)。
表2 各组大鼠血脂水平(±s,mmol/L,n =6)Table 2 Serum lipid levels of rats in each group(±s,mmol/L,n =6)

表2 各组大鼠血脂水平(±s,mmol/L,n =6)Table 2 Serum lipid levels of rats in each group(±s,mmol/L,n =6)
注:与C 组相比,*P <0.05,**P <0.01;与PG 组相比,##P <0.01;与PG +D 组相比,ΔΔP <0.01。 (下表同)Note. Compared with C group,*P <0.05,**P <0.01. Compared with PG group,##P <0.01. Compared with PG +D group,ΔΔP <0.01. (The same in the following tables)
分组GroupsTCTGLDL-CHDL-C C 组C group1.62 ± 0.231.47 ± 0.140.34 ± 0.050.59 ± 0.07 C +D 组C +D group1.63 ± 0.351.35 ± 0.330.32 ± 0.060.54 ± 0.08 PG 组PG group2.00 ± 0.35*2.16 ± 0.17**0.51 ± 0.05**0.30 ± 0.05**PG +D 组PG +D group1.72 ± 0.280.58 ± 0.08##0.35 ± 0.05##0.45 ± 0.10##PG +XS 组PG +XS group1.73 ± 0.300.67 ± 0.40##0.44 ± 0.05##ΔΔ0.52 ± 0.06##
2.2 肝HE 染色
HE 染色可见,C 组及C +D 组肝细胞质地均匀,无脂质空泡出现;与C 组相比,PG 组出现肝空泡现象;与PG 组相比,PG +D 组及PG +XS 组大鼠肝组织内细胞脂质空泡数量显著减少,细胞空隙有所恢复(图1)。

图1 各组大鼠肝HE 染色Figure 1 HE staining of liver of rats in each group
2.3 肝脂质沉积情况
通过油红O 染色进行观察发现C 组、C +D 组大鼠肝无脂质沉积;与C 组相比,PG 组大鼠肝红色油滴出现,具有明显的脂质沉积现象;与PG 组相比,PG +D 组及PG +XS 组大鼠肝内脂质沉积现象有一定程度的减弱(图2)。
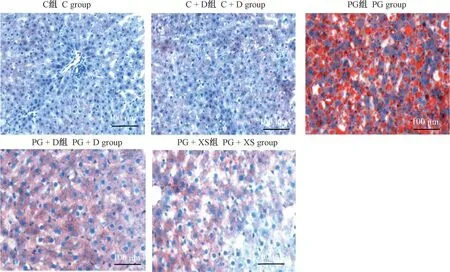
图2 各组大鼠肝脂质沉积情况Figure 2 Liver lipid deposition of rats in each group
2.4 肝FFA、TG、TC 含量
与C 组相比,PG 组大鼠肝FFA、TG、TC 水平升高明显(P<0.01),C +D 组无显著性差异;与PG组相比,给予TMAO 抑制剂DMB、香砂六君子汤分别干预后,PG +D 组及PG +XS 组大鼠FFA、TG、TC 水平降低明显(P<0.05,P<0.01);与PG +D组相比,PG +XS 组无显著性差异(表3)。
表3 各组大鼠肝FFA、TG、TC 含量(±s,n =5)Table 3 Liver FFA,TG and TC contents of rats in each group(±s,n =5)
注:与PG 组相比,#P <0.05。 (下表同)Note. Compared with PG group,#P <0.05. (The same in the following tables)
分组GroupsFFA(μmol/L)TC(mmol/L)TG(mmol/L)C 组C group1442.11 ± 129.641.31 ± 0.0518.23 ± 3.12 C +D 组C +D group1466.08 ± 80.521.41 ± 0.1615.68 ± 1.18 PG 组PG group1754.82 ± 218.48**2.90 ± 1.18**24.80 ± 2.87**PG +D 组PG +D group1374.35 ± 64.19##1.73 ± 0.17##21.48 ± 3.25#PG +XS 组PG +XS group1383.73 ± 115.19##1.62 ± 0.22##19.61 ± 2.27##
2.5 血浆TMAO 含量及肝PERK、FOXO1 mRNA变化
如表4 所示,与C 组相比,PG 组大鼠血浆TMAO 水平、肝PERK、FOXO1 mRNA 表达水平升高显著(P<0.01),C +D 组并无显著性差异;与PG组相比,PG +D 组和PG +XS 组大鼠肝血浆TMAO水平、肝PERK、FOXO1 mRNA 表达水平均降低明显(P<0.01);与PG +D 组相比,PG +XS 组PERK mRNA 表达降低明显(P<0.01)。
表4 各组大鼠血浆中TMAO 及肝PERK、FOXO1 mRNA 变化(±s,n =3)Table 4 Plasma TMAO content and liver PERK and FOXO1 mRNA expression levels of rats in each group(±s,n =3)

表4 各组大鼠血浆中TMAO 及肝PERK、FOXO1 mRNA 变化(±s,n =3)Table 4 Plasma TMAO content and liver PERK and FOXO1 mRNA expression levels of rats in each group(±s,n =3)
分组GroupsTMAO(ng/L)PERKFOXO1 C 组C group344.86 ± 17.401.00 ± 0.021.00 ± 0.08 C +D 组C +D group328.38 ± 46.931.11 ± 0.161.06 ± 0.06 PG 组PG group721.52 ± 3.26**9.11 ± 0.50**2.22 ± 0.10**PG +D 组PG +D group194.78 ± 10.54##3.17 ± 0.06##1.49 ± 0.18##PG +XS 组PG +XS group193.86 ± 3.33##1.54 ± 0.02##ΔΔ1.37 ± 0.25##
2.6 肝中SREBP-2、miR-33a、ABCA1mRNA 变化
与C 组相比,PG 组大鼠肝SREBP-2、ABCA1 mRNA 表达降低(P<0.01),miR-33a mRNA 表达升高(P<0.01),C +D 对照组无显著性差异;与PG 组比,PG +D 组大鼠肝SREBP-2 mRNA 表达升高(P< 0.05),miR-33a mRNA 表达降低(P<0.01),ABCA1 mRNA 表达也升高但是无显著性差异,PG +XS 组大鼠肝SREBP-2、ABCA1 mRNA 表达升高(P<0.01),miR-33a mRNA 表达降低(P<0.01);与PG +D 组比,PG +XS 组SREBP-2、ABCA1mRNA 表达进一步升高(P<0.01),miR-33a mRNA表达有进一步降低趋势,但无显著性差异(表5)。
表5 各组肝SREBP-2、miR-33a、ABCA1 mRNA 的表达水平(±s,n =3)Table 5 mRNA expression levels of SREBP-2,miR-33a and ABCA1 in liver of each group(±s,n =3)

表5 各组肝SREBP-2、miR-33a、ABCA1 mRNA 的表达水平(±s,n =3)Table 5 mRNA expression levels of SREBP-2,miR-33a and ABCA1 in liver of each group(±s,n =3)
分组GroupsSREBP-2miR-33aABCA1 C 组C group1.00 ± 0.021.08 ± 0.541.00 ± 0.07 C +D 组C +D group0.96 ± 0.071.11 ± 0.311.07 ± 0.11 PG 组PG group0.15 ± 0.02**7.23 ± 0.41**0.25 ± 0.02**PG +D 组PG +D group0.21 ± 0.02#2.70 ± 0.39##0.26 ± 0.01 PG +XS 组PG +XS group0.38 ± 0.02##ΔΔ2.51 ± 0.14##0.53 ± 0.03##ΔΔ
2.7 肝SREBP-2、ABCA1 蛋白表达变化
如表6、图3 所示,与C 组相比,PG 组大鼠肝SREBP-2、ABCA1 蛋白表达降低明显(P<0.01),C +D 对照组并无显著性差异;与PG 组比,PG +D组SREBP-2、 ABCA1 蛋白表达升高明显(P<0.05),PG +XS 组SREBP-2、ABCA1 蛋白表达升高(P<0.01);与PG +D 组比,PG +XS 组SREBP-2、ABCA1 蛋白表达升高(P<0.01)。

图3 大鼠肝SREBP-2、ABCA1 蛋白表达变化Figure 3 Relative contents of SREBP-2 and ABCA1 protein expression in liver of rats in each group
表6 各组大鼠肝SREBP-2、ABCA1 蛋白表达相对含量(±s,n =3)Table 6 Relative contents of SREBP-2 and ABCA1 protein expression in liver of rats in each group(±s,n =3)

表6 各组大鼠肝SREBP-2、ABCA1 蛋白表达相对含量(±s,n =3)Table 6 Relative contents of SREBP-2 and ABCA1 protein expression in liver of rats in each group(±s,n =3)
注:与PG +D 组相比,ΔP <0.05。Note. Compared with PG +D group,ΔP <0.05.
分组GroupsSREBP-2ABCA1 C 组C group1.17 ± 0.131.09 ± 0.16 C +D 组C +D group1.29 ± 0.041.16 ± 0.11 PG 组PG group0.74 ± 0.11**0.57 ± 0.01**PG +D 组PG +D group0.92 ± 0.01#0.84 ± 0.04##PG +XS 组PG +XS group1.01 ± 0.21##1.07 ± 0.07##Δ
3 讨论
脂代谢紊乱极易引起脂肪肝、动脉粥样硬化、高脂血症等疾病,也给患者带来了巨大的经济负担[18],因此调控血脂代谢是迫切之需。 《素问·经脉别论篇》说:“饮入于胃,游溢精气,上输于脾。 脾气散精,上归于肺,通调水道,下输膀胱,水津四布……”,可见脾运化的重要性[19]。 “血脂”类似于中医的“膏脂”[20],脾的运化功能也与血脂代谢、脂代谢等密切关联,“脾失运化,浊滞血脉”[21-22]。《杂病源流犀烛·痰饮源流》云:“好食油面猪脂,以至脾气不利,壅滞为痰。”可见常油腻饮食,引起脾虚导致运化功能减弱,进一步引起痰浊内生,而大量的痰浊凝滞于肝脉,造成肝脂代谢紊乱。 近期研究发现肠道菌群可产生代谢物TMAO[23-24]。 目前研究显示TMAO 与脂代谢紊乱引起ASCVD 的发生发展具有一定相关性,其参与了动脉粥样硬化[25]、冠心病[26]、糖尿病[27]等多种疾病的发生、发展及相关并发症的产生过程。 汤景辉等[28]发现植物乳杆菌ZDY04 可减轻TMAO 诱导的ApoE-/-小鼠体内的动脉粥样硬化,其机制可能是通过促进RCT 过程;此外发现TMAO 含量与斑块的形成有相关性,并能抑制胆固醇的逆向转运,进而导致脂代谢异常[29];靳步等[30]发现TMAO 可通过影响微管蛋白聚合、T 小管重构等促进心力衰竭的发生。 提示TMAO 水平变化与ASCVD 疾病的发展至关重要,TMAO 的调控是治疗ASCVD 疾病的有效策略之一。 香砂六君子汤出自《古今名医方论》,可对脾失健运引起的膏脂代谢异常起到一定的干预作用[31-32]。 课题组前期发现香砂六君子汤对肝脂代谢异常具有一定的干预作用,具体机制还未明晰[16]。
本实验造模方法遵循以往团队方法,在脾虚高脂血症模型基础上分别给予TMAO 抑制剂(DMB)、香砂六君子汤进行干预,观察TMAO 对脾失健运引起膏脂转输障碍引起的肝脂质沉积的影响及香砂六君子汤的干预机制研究。 本次发现PG 组大鼠血脂变化、形态学变化及血浆中TMAO 变化与团队前期结果一致[15],同时大鼠肝TG、TC、FFA 水平明显增加;给予DMB 对TMAO 进行干预,发现DMB 可以显著抑制TMAO 的生成,此外TMAO 被抑制后,可缓解血脂代谢水平,同时改善了肝脂代谢紊乱现象。 研究发现给予香砂六君子汤可通过降低血浆TMAO 含量,进而改善血脂代谢紊乱、肝脂代谢紊乱的现象,其效果类似于TMAO 抑制剂DMB。 体外实验发现TMAO 对内质网应激过程具有一定的干扰[33];Saaoud 等[34]同样发现抑制内质网(ER)应激介质PERK(TMAO 受体),会抑制TMAO 诱导的HAECs 激活。 叉头框(forkhead box FOX)家族参与代谢的关键蛋白转录因子[35],研究显示FOXO1 参与小鼠肝细胞脂质沉积的调节[36],同时也是调控心脑血管疾病的关键作用靶点[37],FOXO1 通路功能障碍易导致非酒精性脂肪肝、动脉粥样硬化等疾病[9]。 Chen 等[14]发现PERK 与TMAO 结合,通过激活PERK 分支,可进一步诱导转录因子FOXO1,进而影响血脂异常类疾病的发生发展,提示TMAO/PERK/FOXO1 信号轴可能与脂代谢调控密切相关。
本研究显示,PG 组大鼠血浆TMAO 含量升高,通路轴上PERK、FOXO1 mRNA 及蛋白表达明显增加,提示TMAO 可以启动PERK/FOXO1 轴参与FOXO1 对下游脂代谢的调节;给予DMB 后可以显著降低TMAO 的含量从而抑制下游PERK、FOXO1的表达;同样给予香砂六君子汤后,可以通过抑制TMAO 来抑制TMAO/PERK/FOXO1 轴的表达。
FOXO1 可参与下游多种因子代谢调节,研究显示固醇调节元件结合蛋白-2(SREBP-2)可以在转录水平上被FOXO1 调控[11],SREBP-2 参与胆固醇代谢调控过程,通常特异性结合LDLR、HMGCR 等基因[38],研究显示电针可通过调控SCAP/SREBP-2 通路干预高脂血症大鼠胆固醇代谢紊乱的现象[39];此外小鼠巨噬细胞脂质蓄积也与SREBP2 表达相关[40];课题组前期发现脾虚高脂血症大鼠肝脂质沉积、血脂紊乱可能与miR122a/SREBP-2 通路有关[41]。 miRNAs 是一类非编码RNA,参与机体内多种代谢调控过程[42]。 miR-33a 由SREBP 基因内含子编码,参与肝脂代谢调控过程[12]。 研究发现miR-33a 可与SREBP-2 联合提高细胞内胆固醇水平,并加剧肝脂代谢紊乱[42],可见miR-33a 与SREBPs 协同作用是促进肝脂质合成的关键步骤。三磷酸腺苷结合盒转运体A(ABCA1)参与HDL 生成过程[43],其可受到miR-33 的调控,miR-33a 水平降低可增加ABCA1 表达和细胞内胆固醇流出[44];小鼠体内注射miR-33 腺病毒抑制ABCA1 表达,相反注射反义寡核苷酸miR-33 腺病毒的小鼠体内ABCA1 表达增高,可见ABCA1 是miR-33 真正的靶标基因[45]。
SREBP-2/miR-33a/ABCA1 三个关键基因,形成调控脂代谢的代谢通路,这对肝脂质沉积的形成至关重要。 本实验研究发现,在PG 组大鼠肝中SREBP-2、ABCA1 mRNA 及蛋白表达均不同程度降低,miR-33a mRNA 表达显著上升;给予DMB 后可以进一步促进SREBP-2、ABCA1mRNA 及蛋白表达,抑制miR-33a mRNA 表达,同样香砂六君子汤对SREBP-2/miR-33a/ABCA1 轴的调控作用与DMB 一致。 可见DMB 可以通过抑制TMAO 的表达从而影响TMAO/PERK/FOXO1 轴介导的下游SREBP-2/miR-33a/ABCA1 通路从而抑制肝脂代谢紊乱导致的脂质沉积现象;香砂六君子汤也可通过抑制TMAO 的表达起到影响TMAO/PERK/FOXO1 轴介导的下游SREBP-2/miR-33a/ABCA1 通路作用,进而干预脂代谢紊乱的作用,起到抑制大鼠肝脂质沉积发生和发展。
综上所述,TMAO 可能通过参与调控PERK/FOXO1 代谢轴,靶向下游的SREBP-2/miR-33a/ABCA1 信号通路,影响ABCA1 表达,进而引起肝脂质沉积;香砂六君子汤可通过抑制TMAO 的表达,调控PERK/FOXO1 代谢轴,影响下游SREBP-2/miR-33a/ABCA1 通路,进而改善肝脂代谢紊乱现象。 但本研究也存在一定的局限性,香砂六君子汤是否通过干预肠道菌群来干预TMAO 的作用机制达到调控脂代谢紊乱的作用,仍需深入研究。

