强直性脊柱炎食蟹猴膝关节及肠道组织病理变化分析
黄玉叶,蔡艳贞,蔡春梅,祝合朋,丁煌冠,贾欢欢,肖文德,陈珺,李文德*,卢丽*
(1. 广东药科大学,广州 511400;2. 广东省实验动物监测所(广东省实验动物重点实验室),广州 510663;3. 广州市第一人民医院,广州 510180)
强直性脊柱炎(ankylosing spondylitis,AS)以中轴关节的疼痛、僵直为主要临床特征,包括骶髂关节和脊柱,也会累及外周关节,尤其是伴随出现的膝关节肿胀、疼痛。 目前AS 的病因病机尚未明确,除与已知的HLA-B27 的相关性外,近年来基质金属酶(matrix metalloproteinase,MMP)参与AS 发病的作用机理也逐渐引起关注[1]。 有报道称,部分AS 患者最先发病于外周关节,例如膝关节,逐渐累及髋关节,甚至几年后才出现脊柱的病变,年龄越小首发外周关节的概率越高。 由于对AS 外周关节病理变化及诊断方法的认识不足,临床上容易误诊为类风湿性关节炎和骨关节炎等,严重影响AS 早期的诊断和治疗[2]。 通过研究AS 膝关节的病理变化及进程,有助于更好地认识AS 在外周关节的发生发展,减少误诊漏诊的发生,并尽早治疗疾病,具有重要的临床实用价值及社会效益。
在AS 患者中,炎症性肠病是常见的关节外表现,约70% AS 患者存在肠道黏膜炎症,其中5%进展为临床炎症性肠病[3],与之对应的是10% ~20%炎症性肠病患者同时患有AS。 这提示AS 和炎症性肠病具有相似的遗传风险因素和病因,在临床遗传和免疫学方面都有重叠,AS 患者肠道炎症是否与脊柱发病相关也引起了关注。 近年来对肠道微生物的多项研究表明肠道菌群失调与AS 的发生、发展有着密切关联,然而,尚不清楚这种微生物失调是炎症的起因还是结果,而微生物失调是如何调节AS的免疫反应也有待研究,因此使肠道-脊柱关节炎成为研究的新兴领域[4]。 目前许多学者认为,微生物感染是脊柱关节病或AS 疾病活动的诱发因素,也就是说,肠道可能是抗原暴露的第一个位置,随后是关节内致病机制的激活[5]。
构建疾病动物模型是研究疾病发生机理以及防治策略的基础,但对于病因不明的病种而言,缺乏病因相似的动物模型,是阻碍该病种基础研究发展的瓶颈。 近年来对强直性脊柱炎病因病机的研究主要是在啮齿类动物模型上进行的,但与AS 患者临床表现具有较大差异,在啮齿类动物模型获得的实验结果,很难真正“落地”到临床。 本实验是在课题组已建立的自发性强直性脊柱炎食蟹猴模型上开展的,前期研究已明确了AS 食蟹猴脊柱病程进展以及血液学、影像学及分子生物学方面的相关改变[6],对该自发性疾病模型有夯实的研究背景数据。 本文将探讨AS 食蟹猴膝关节及肠道病因及病程中主要病理变化,有助于更好地认识AS 在外周关节及肠道炎症的病程发展,为进一步阐明AS 病程中复杂的网络调控机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
13 只普通级雌性食蟹猴,年龄(15.22 ± 3.00)岁,体重4.46 ± 1.93 kg 均购自广东春盛生物科技发展有限公司【SCXK(粤)2019-0027】。 饲养条件:群居饲养于广东春盛生物研究院有限公司【SYXK(粤)2019-0152】,环境温度18 ~26℃,相对湿度40% ~70%,定时定量饲养,自然采光。 课题组前期对20 000 只食蟹猴的筛查过程中发现并确立一个自发性AS 食蟹猴疾病模型种群,进一步对这些出现关节异常的食蟹猴进行了长达3 年的追踪性检查,通过比对血液学指标检查、影像学(X 线、MRI及CT)检查、家族复发性分析、基因检测及病理学分析,最终建立了非人灵长类自发性AS 实验动物种群的病理资料库,筛选并鉴定了57 只自发性强直性脊柱炎食蟹猴模型(雄性19 只,雌性38 只),其发病率为0.275%,与人相似[6]。 在57 只强直性脊柱炎食蟹猴中,外周关节炎发病率约为45.61%,发病率与强直性脊柱炎患者外周关节发病率接近。 基于实验动物研究的“3R”原则,本研究中各组实验动物的数量分别为:正常对照组3 只、AS 早期组3 只、AS 晚期组7 只。 所有操作均已通过广东省实验动物监测所IACUC 的审查(IACUC2018002)。
1.1.2 主要试剂与仪器
MMP-3 一抗(武汉三鹰,中国)、H-41 一抗(Santa Cruz,美国)、兔/鼠通用型链霉亲和素-HRP(江苏康为世纪,中国)、透明质酸酶(源叶,中国);Mikasa HF400VA X 光机(Mikasa,日本)、石蜡包埋机(Leica,德国)、石蜡切片机(Leica,德国);病理组织漂烘仪(Histoline laboratory,米兰);倒置显微镜(Olympus,日本)。
1.2 方法
1.2.1 动物分组
对食蟹猴进行体格检查,使用测角仪初步筛查自发性AS 食蟹猴,评估动物脊柱曲率和膝关节和髋关节活动度(ROM),随后进行X 线检查,判断标准与临床相同,本研究参照1984 年美国纽约修订X线诊断分级标准进行分级(mNY):0 级:影像学检查无病变,骨骼结构正常;Ⅰ级:疑似骨关节硬化、糜烂;Ⅱ级:可见明显的硬化和侵蚀,有轻微异常,但关节间隙不是很明显;Ⅲ级:骨硬化和浸润明显,骨异常严重,关节间隙明显改变,部分强直改变;Ⅳ级:大部分脊柱出现强直性改变或完全强直,表现为严重的骨关节结构异常[7-8]。 结合细胞因子检查和排除其他疾病影响,根据mNY 分级系统进行双盲评分,按不同等级将食蟹猴分为两组,评分0 级为正常组(n=3),评分Ⅱ级为AS 早期组(n=3)、评分Ⅲ级及以上为AS 晚期组(n=7),且本实验所用AS 食蟹猴均伴发外周关节及肠道病变。
1.2.2 食蟹猴膝关节样本的取材固定、脱钙与包埋
安乐死后,取食蟹猴膝关节放入4%多聚甲醛中常温固定48 h 以上,固定完毕后流水冲洗9 h 以上去除多余固定液后用EDTA-2Na 脱钙直至组织变得柔软说明达到脱钙终点,进行常规脱水包埋,4℃保存备用。
1.2.3 食蟹猴肠道样本的取材固定与包埋
动物经安乐死后取出不同的肠段,包括小肠和大肠,将肠腔清洗干净后放入4%多聚甲醛中常温固定48 h 以上,固定完毕后流水冲洗9 h 以上去除多余固定液后分装于包埋盒中,进行常规脱水包埋,4℃保存备用。
1.2.4 番红-固绿染色法(safranine O-fast green stain,SO)
切片常规脱蜡至水后,苏木素染色1 min,流水清洗后1%盐酸乙醇分化15 s。 0.05%固绿染色5 min,1%乙酸酸化。 蒸馏水清洗后,0.5%番红O染色液2 min。 脱水透明,封片。 通风橱过夜后拿至显微镜下观察,根据需求,使用Olympus 倒置显微镜在不同倍镜下进行拍摄,每张切片均观察了5 个视野,并对软骨厚度和关节直径进行定量。
1.2.5 苏木精-伊红染色(HE 染色)
切片常规脱蜡至水后,苏木素染色8 min,流水浸洗1 min 后浸入1%盐酸乙醇分化3 ~8 s,肉眼观察组织为淡紫色即可,流水冲洗返蓝10 min,再浸入水性伊红染色液染色3 min。 脱水透明,封片。 通风橱过夜后拿至显微镜下观察,根据需求,使用Olympus 倒置显微镜在不同倍镜下进行拍摄,每张切片均观察了5 个视野。
1.2.6 食蟹猴小肠绒毛长度和隐窝深度的测量
使用Olympus 倒置显微镜拍摄并测量从绒毛顶端至隐窝开口处的垂直距离为小肠绒毛长度,隐窝开口至隐窝基部的垂直距离为隐窝深度,每张切片均选取了5 个视野。
1.2.7 免疫组织化学染色
经常规烤片、脱蜡获水流程后,采用酶修复法进行抗原修复,5%BSA 封闭,滴加MMP-3(1 ∶100)一抗,4℃湿盒孵育过夜后回收,PBS 清洗后滴加二抗,置于湿盒避光孵育10 min,经DAB 显色、苏木素复染后脱水、透明及封片,置于通风橱过夜后显微镜下观察。
1.3 统计学分析
运用GraphPad Prism 6 软件对实验数据进行统计学比较分析。 两组独立样本比较采用t检验,P<0.05 认为是有统计学意义。
2 结果
2.1 外周膝关节X 线及大体标本观察
X 线检查发现,正常组食蟹猴关节表面完整,未见明显破损,AS 早期食蟹猴病变位置关节表面为锯齿状,软骨损伤(蓝色箭头指示),AS 晚期关节间隙变窄,软骨边缘骨赘生成明显(红色箭头指示)。 由膝关节的大体外观可见,正常组食蟹猴股骨下段和胫骨上段关节软骨透明,关节面光滑有光泽,呈蓝白色,关节边缘整齐。 AS 早期组食蟹猴股骨下段和胫骨上段软骨层变薄,表面粗糙,色泽暗淡,偶见软骨缺损溃疡面,暴露软骨下骨,弹性差。 AS 晚期组食蟹猴股骨下段和胫骨上段周围骨赘明显,关节间隙狭窄,关节软骨层结构基本完全丢失(见图1)。

注:蓝色箭头:软骨破损位置;红色箭头:骨赘形成位置。图1 AS 食蟹猴膝关节X 线及标本外观Note. Blue arrow. Location of cartilage breakage. Red arrow. Location of bone fragment formation.Figure 1 AS cynomolgus monkey knee joint X-ray and specimen appearance
2.2 外周膝关节的病理变化
关节软骨主要由软骨细胞、软骨基质及纤维构成的透明软骨。 膝关节软骨主要分为透明软骨层、钙化软骨层及软骨下骨层。
2.2.1 股骨下端病理变化
食蟹猴股骨下段HE 染色发现,正常组股骨软骨表面光滑平整,软骨下骨未见增生血管(图2A,2B)。 AS 食蟹猴软骨基质随病情加重逐渐剥落,软骨层变薄变性,表面纤维增生,可明显观察到成骨(图2C,2D,2E),随着病情加重可观察到异位肥大软骨细胞向软骨下骨层方向进展(图2G,2H),大面积的纤维成骨导致松质骨增多,并在钙化软骨层附近发现密集分布的血管(图2F,2I)。

注:HB:异位骨;红色虚线:透明软骨边界;蓝色虚线:软骨侵蚀空洞;绿色虚线:异位肥大软骨团;红色箭头:血管;蓝色箭头:炎症细胞和骨髓样细胞;黄色箭头:纤维成骨。图2 AS 食蟹猴股骨下段病理进展(HE 染色)(n =3)Note. HB. Heterotopic bone. Red dashed line. Hyaline cartilage border. Blue dashed line. Cartilage erosion cavity. Green dashed line. Ectopic hypertrophic cartilage mass. Red arrow. Blood vessel. Blue arrow. Inflammatory cells and bone marrow-like cells. Yellow arrow. Fibro-osteogenesis.Figure 2 Pathological progression of the lower femur in AS cynomolgus monkeys (HE staining)(n =3)
2.2.2 胫骨上段病理变化
食蟹猴胫骨上段HE 染色发现,正常组胫骨上段软骨表面完整,AS 食蟹猴组透明软骨层纤维紊乱甚至中断,异常增生,软骨内部可观察到纤维成骨(图3A,3B),钙化软骨层厚度明显增加,随着病情发展,可观察到异位肥大软骨细胞向成骨方向发展以及向纤维化方向分化(图3C,3D),以及分布密集的血管(图3E,3F)。
2.3 股骨下段表面软骨厚度及直径的变化
为了更好地观察与评估关节表面软骨层的变化,对食蟹猴股骨下段进行SO 染色。 结果如图4所示,正常对照组软骨细胞排列有序,软骨基质层呈明显桔红色;AS 组软骨基质丢失,蛋白多糖含量减少,软骨内成骨明显,纤维增生明显,以炎性肉芽组织为主要特征(图4A),在软骨下骨区域可见纵向发展的大面积肥大软骨细胞,往成骨方向进展活跃(图4B)。 随着病程发展,AS 晚期动物股骨下段软骨层完全被破坏,取而代之的是表面增生的纤维组织。 图4C 为表面软骨厚度及直径的测量结果,AS 组股骨下段表面软骨层的厚度显著下降;关节直径有逐渐上升趋势,但无显著性差异,提示AS 食蟹猴膝关节软骨面被破坏的主要原因是软骨内骨化及纤维增生。

注:FH:纤维增生;黄色箭头:纤维成骨;红色线段:股骨表面软骨的厚度;软骨厚度在× 40 视野下进行测量,关节直径采用游标卡尺测量;与正常组相比,*P <0.05。 (下图同)图4 AS 食蟹猴股骨下段表面软骨厚度及直径的变化(SO 染色)(n =3)Note. FH. Fibrous hyperplasia. Yellow arrow. Fibrous osteogenesis. Red line segment. Thickness of cartilage on the surface of the femur.Cartilage thickness was measured in × 40 field of view and joint diameter was measured using vernier calipers. Compared with normal group,*P <0.05. (The same in the following figures)Figure 4 Variation in cartilage thickness and diameter on the surface of the lower femur in AS cynomolgus monkeys (SO staining)(n =3)
2.4 股骨下段MMP-3 的表达变化
食蟹猴股骨下段MMP-3 的IHC 染色如图5 所示,正常组表面软骨细胞染色呈现弱阳性;生长板也观察到阳性染色,血管平滑肌细胞染色为阴性。与正常组相比,AS 组软骨表面和生长板中MMP-3的表达明显增强,软骨表面可见排列紊乱的阳性软骨细胞和异位肥大软骨细胞团;软骨表面纤维增生处血管中也检测到较高的MMP-3。

注:HB:Heterotopic bone 异位骨;红色虚线:生长板边界;红色箭头:血管。图5 AS 食蟹猴股骨下段MMP-3 的表达(IHC 染色)(n =3)Note. HB. Heterotopic bone ectopic bone. Red dashed line. Growth plate boundary. Red arrow. Blood vessels.Figure 5 Expression of MMP-3 in the lower femur of AS cynomolgus monkeys (IHC staining)(n =3)
2.5 外周肠道的组织学特征
食蟹猴外周小肠样本的HE 染色发现,小肠绒毛出现严重绒毛萎缩、增粗,同时隐窝增生明显。与正常组相比,AS 组十二指肠、空肠、回肠的绒毛长度显著变短,隐窝深度显著增大(见图6),与目前临床上AS 患者的病理特征一致[9]。
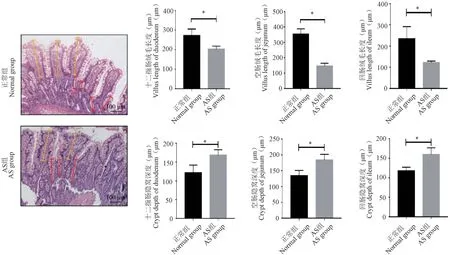
注:橘色:绒毛长度;红色:隐窝深度。图6 AS 食蟹猴小肠绒毛和隐窝的测量(HE 染色)(n =3)Note. Orange. Villi length. Red. Crypt depth.Figure 6 Measurement of small intestinal villi and crypt foci in AS cynomolgus monkeys (HE staining)(n =3)
2.6 肠道γδT 细胞数量的变化
γδT 细胞的免疫组织化学染色发现,与对照组相比,AS 组肠道粘膜肠腺处可观察到大量的γδT 细胞。 γδT 细胞可参与IL-17 介导的免疫反应。 实验结果表明,AS 组只有空肠和回肠可见γδT 细胞阳性染色,结肠和盲肠中并未见(见图7)。 这提示浸润在空肠和回肠处的γδT 细胞可能透过受损的肠黏膜屏障和肠血管屏障,通过血液运输或直接转移到脊柱,引起脊柱局部的炎症[10]。
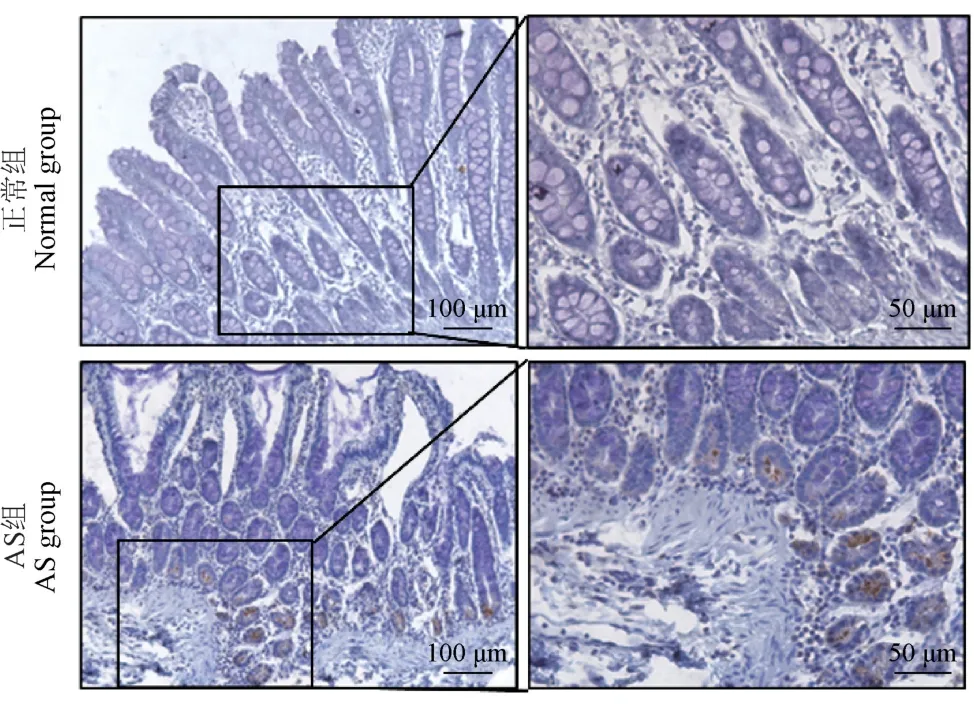
图7 AS 食蟹猴肠道γδT 细胞的IHC 染色(n =3)Figure 7 IHC staining of intestinal γδT cells in AS cynomolgus monkeys(n =3)
3 讨论
AS 发病隐匿,部分首发于外周关节,而在目前的啮齿类AS 模型中对外周关节的研究还较少,并且肠道免疫细胞浸润与AS 的发生、发展有着密切的关联。 本研究以AS 食蟹猴膝关节和肠道样本为对象,探讨了外周膝关节病理进展及肠道炎症可能的发生机制。
本研究基于影像学和膝关节大体外观的检查结果,可以初步确定早期膝关节的病变主要以软骨表面破损为主,晚期病变主要以软骨表面的骨形成为主。 通过对膝关节股骨下段和胫骨上段形态学的分析发现,随着AS 病程进展,膝关节从软骨表面轻微纤维化、软骨破损及成骨进一步发展为软骨退化,表面纤维成骨,异位肥大软骨成骨,炎症细胞侵袭以及血管增生。 经组织学测量结果表明,AS 组食蟹猴股骨下段肿大,表面软骨厚度显著下降。 IHC结果显示,AS 组股骨下段MMP-3 表达上调,这提示滑膜增生以及软骨侵蚀和破坏是由于AS 食蟹猴中MMP-3 的表达上调导致的。 这与AS 患者脊柱中MMP3 表达增强的结果一致[11]。 MMPs 则是一组具有许多共同生化性质的可降解细胞外基质酶,能降解细胞外基质的多种成分,包括蛋白多糖和糖蛋白。 据报道,AS 关节滑液中MMP-3 水平升高,其血清水平与AS 疾病活动指数BASDAI 及AS 疾病功能指数BASFI 呈正相关;而血清MMP-3 水平无论在临床患者治疗前后MMP-3 的表达水平与ESR 和CRP 有很好的相关性,体现了MMP-3 与AS 患者疾病的活动性密切相关。 因此,MMP-3 可能是AS 的潜在诊断生物标志物,甚至可以作为AS 患者结构损伤进展的独立预测因子[7,12-16]。 本研究从成骨相关研究AS 外周膝关节,增强了炎症和骨进展之间的潜在联系,为日后治疗外周关节疾病提供新的参考方向。
T 细胞抗原受体(TCR)有α、β、γ、δ 四种肽链。根据TCR 异二聚体的不同组成,可将其分为TCR αβ 和TCR γδ 两种类型,特性和功能各不相同。 其中TCR γδ 细胞主要分布在黏膜和上皮组织中,而在人外周血中仅占T 细胞总数的1% ~5%,具有抗感染、识别和杀伤靶细胞的功能,又可被其识别的抗原激活,产生分泌IL-2、3、4、5,IFN-γ 和TNF-α 等多种细胞因子参与免疫调节,介导炎症反应,增强机体早期非特异性免疫防御功能,在研究一些慢性疾病的机制中受到关注。 本研究中,主要关注γδT细胞在患病动物中肠道组织的作用。 研究表明,IL-23 受体基因(IL-23R)与AS 的遗传多态性有关[17]。AS 患者外周血中表达IL-23R 的γδT 细胞数量比正常人高出3 ~5 倍,AS 患者通过IL-23R 刺激γδT细胞产生IL-17,表现出Th17 样免疫反应。 γδT 细胞数量在患有回肠炎的SpA 患者的上皮和黏膜,以及在SpA 患者的炎症关节中升高,这表明γδT 细胞可能在AS 的发病机制中有着重要的作用[10,18-19]。因此,本研究通过检测肠道中γδT 细胞的数量,显示AS 食蟹猴空肠和回肠与炎症相关的γδT 细胞数量增多,基于肠道组织学检查表明AS 小肠均有一定程度的绒毛萎缩和隐窝增生。 本研究结果增加了AS“肠漏发病假说”的佐证证据[20],即引发AS的抗原或炎症细胞可能由于“肠漏”机制由肠道迁移至脊柱等患病部位,AS 患者中肠道来源的抗原呈递细胞可能在驱动AS 患者的全身炎症中起核心作用。 而γδT 在肠道组织中所扮演的角色是作为抗原呈递细胞介导了炎症反应,还是在肠道组织中作为效应细胞,直接识别和杀伤靶细胞则有待进一步实验探讨。
肠道炎症的发生是由于肠道免疫系统失去对正常菌群某些抗原的耐受而引起的,可以通过淋巴系统扩散到骶髂关节和进入体循环而引起系统性症状,如周围关节、肌腱等的强直性改变。 已有研究表明,约有70%的强直性脊柱炎患者患有肠道炎症疾病,其中有57% ~ 70%会发展为外周关节炎[21],并且,肠道病变与AS 的病情及预后相关,肠道炎症症状重的患者其关节炎症状也较重,治疗肠道疾病也可以间接缓解关节病变[22]。 这说明在强直性脊柱炎病程发展中,外周关节的病变与肠道炎症的发展密不可分。 据文献报道,20% ~45%的AS患者首先有外周关节病变,数年后才出现腰背痛。外周关节肿、痛常较明显,以膝关节及踝关节受累居多,肩、肘及手、足小关节偶有受累。
将外周膝关节发病及肠道炎症与AS 关联起来的历史由来已久,三者在遗传背景、发病机制及治疗药物上均有较大的重叠部分,然而,在外周膝关节及肠道炎症的发病机制研究上仍存在局限性,因此,本研究通过对AS 食蟹猴的外周组织进行病理组织研究,发现AS 食蟹猴膝关节病变主要是MMP-3 上调所致,肠道病变特征以γδT 细胞上调为主,而在其他啮齿类动物AS 模型上仍以肠道菌群研究为主[23],对肠道γδT 细胞的研究甚少,综合对AS 食蟹猴肠道菌群变化的研究,发现本研究所用的自发性食蟹猴AS 模型与临床上患者具有更高的相似性[9],对日后研究AS 治疗能提供新的实验基础和研究方向。

