美洲大蠊提取液对兔角膜上皮损伤修复影响的实验研究
周春阳 袁正 李依静 祝丽婷 梅波
角膜是一种透明的无血管组织,可以起到结构屏障的作用,保护眼睛免受感染[1]。同时与泪膜一起,为眼睛提供了光滑的屈光界面,角膜屈光力约占眼球总屈光力的70%。上皮层是角膜的最外层,在眼睛的免疫、保护和结构稳定性方面具有重要功能。角膜上皮损伤是指由于各种因素导致的角膜上皮屏障功能与完整性被破坏,引起角膜上皮细胞层部分或全层缺失的病理状态[2]。临床上可表现为角膜上皮弥漫性点状脱失或糜烂,严重者可导致角膜基质病变,影响视功能,甚至失明。目前,全球盲人估计为3600万,另有2.17亿人患有中度至重度视力障碍。在2.53亿盲人或视力受损者中,约617万人的病例可归因于角膜原因[3]。局部药物使用是目前公认的治疗角膜上皮损伤最直接有效的手段,但临床常使用的人工泪液、生长因子类和蛋白提取类滴眼液的治疗效果不尽如人意,寻找更加有效的药物治疗角膜上皮损伤具有重要意义。美洲大蠊属昆虫纲,蜚蠊目,蜚蠊科,俗称蟑螂。蜚蠊的药用在中国现存最早的药学专著《神农本草经》就有记载:“主血瘀,瘕坚,寒热,破积聚,咽喉痹,内寒无子”。现代医学研究发现美洲大蠊提取液(periplaneta americana extract,PAE)在治疗许多涉及组织修复的疾病中起着至关重要的作用。本研究通过建立兔角膜上皮损伤模型,观察PAE对兔角膜上皮损伤修复的潜在影响,进一步明确治疗效果,为角膜上皮损伤的治疗提供新的方案。
1 材料与方法
1.1 材料
1.1.1实验动物 32只标准实验用普通级健康雄性新西兰大白兔,体重约2~2.5 kg,4~6月龄。动物饲养员使用专用饲料每日定时定量投食喂养,饮水自由,适应性饲养1周。本实验经成都中医药大学动物实验伦理委员会审查通过(编号:2022-34)。
1.1.2主要试剂和仪器 美洲大蠊提取液(四川好医生攀西药业有限责任公司),人表皮生长因子滴眼液(桂林华诺威基因药业有限公司),生理盐水(四川科伦药业股份有限公司),眼科裂隙灯显微镜检查仪(重庆上邦医疗设备有限公司),手术显微镜(苏州六六视觉科技股份有限公司)。
1.2 方法
1.2.1兔角膜上皮损伤模型建立 采用乙醇法建立兔角膜上皮损伤模型[4]。大白兔称重后,3%戊巴比妥钠(1 mL/kg)经兔耳缘静脉注射行全身麻醉。兔右眼结膜囊内滴用盐酸奥布卡因滴眼液行局部表面麻醉,放置开睑器,充分暴露兔眼角膜。在角膜中央放置直径7 mm的角膜环钻,于角膜环钻内滴入提前配制好的体积分数20%乙醇溶液,作用60 s后移除环钻,使用生理盐水进行冲洗。使用角膜上皮刮刀逐步刮除角膜上皮。术毕进行荧光素钠染色,并拍照记录染色范围,确认角膜上皮缺损呈圆形,符合后续实验标准。所有麻醉均由同一人完成,所有角膜上皮损伤模型均由同一人完成。
1.2.2实验分组及干预 造模完成后,随机选择其中2只实验兔即刻行角膜荧光钠素染色和裂隙灯显微镜检查,为即时(0 h)组。该组实验兔在完成眼前节照相后通过空气栓塞法处死并取出角膜,置于甲醛溶液中固定。剩余30只实验兔随机分为PAE组、人表皮生长因子(human epidermal growth factor,hEGF)滴眼液组和生理盐水(normal saline,NS)组,每组10只。各组滴用对应滴眼液进行干预,滴眼频率为每天4次,每次间隔4小时,每次1~2滴。同时白天使用左氧氟沙星滴眼液、夜间使用妥布霉素眼膏预防感染。
1.2.3一般情况观察 在造模后12、24、36、48、72 h使用裂隙灯显微镜对各组实验兔眼部情况进行观察评估,主要观察内容包括结膜充血、眼睑肿胀程度、有无分泌物等情况,评估是否出现眼部感染、角膜上皮反复剥脱等异常情况。
1.2.4角膜上皮损伤图像的摄取及分析 造模后0、12、24、36、48、72 h,使用装配照相机的裂隙灯显微镜进行图像的摄取。随后,在兔眼结膜囊内滴入荧光素钠进行染色,在钴蓝光下行眼前节拍照记录角膜荧光染色情况。使用Image-J软件打开角膜荧光染色图像,沿角膜上皮缺损区边缘进行测量,获取各组不同时间点的角膜染色面积,并计算角膜上皮修复速率和角膜上皮愈合率。角膜上皮修复速率=上皮修复面积(mm2)/修复时间(h);角膜上皮愈合率=(0 h染色面积-观察时染色面积)/0 h染色面积×100%。采用SPSS 26.0统计软件对数据进行统计学分析。
1.2.5角膜组织病理学观察 各组分别于造模后24、48、72 h采取抽签法选取3、3、4只实验兔,使用空气栓塞法处死后取下角膜组织,置于甲醛溶液固定。所有固定好的角膜组织(含0 h组)进行脱水、石蜡包埋、切片后,采用苏木精-伊红染色法进行处理,观察比较各组不同时间点角膜上皮缺损区的大小、细胞形态结构和排列情况。

2 结果
2.1 一般情况
用药后12、24、36、48、72 h,三组兔眼均未观察到明显的结膜充血、眼睑肿胀、分泌物等情况,均未出现角膜感染、角膜上皮反复剥脱等异常情况,见图1。

图1 各组兔眼前节图像(12.5×)
2.2 角膜上皮修复结果
所有兔眼角膜上皮均在72h内完全修复,其中PAE组所有兔眼角膜上皮均在48h内完全修复,见图2。进一步对比发现,PAE组中有2只实验兔角膜上皮在36h内完全修复;同样的情况也出现在hEGF滴眼液组,为1只。而这种个别角膜上皮修复较快的情况并没有出现在NS组。

图2 三组不同时间点角膜荧光染色后眼前节图像(12.5×)
2.2.1三组角膜上皮修复速率比较 通过计算单位时间内角膜上皮修复面积,分析对比各组兔眼角膜上皮修复速率。发现PAE组角膜上皮修复速率最快,为1.37±0.19 mm2/h;hEGF滴眼液组次之,为1.22±0.15 mm2/h;NS组最慢,为1.00±0.18 mm2/h。单因素方差分析结果显示,组间差异有统计学意义(F=7.487,P=0.005)。进一步组间两两比较结果显示,PAE组与hEGF滴眼液组的角膜上皮修复速率差异无统计学意义(t=1.621,P=0.123);PAE组与NS组的角膜上皮修复速率差异有统计学意义(t=3.860,P=0.001);hEGF滴眼液组与NS组的角膜上皮修复速率差异有统计学意义(t=2.303,P=0.034),见图3。

图3 三组角膜上皮修复速率比较注:ns:差异无统计学意义;*:P<0.05;**:P<0.01。
2.2.2三组角膜上皮愈合率比较 对角膜上皮愈合率进行统计分析发现,在造模后12、24、36、48 h,PAE组的角膜上皮愈合率均最高,hEGF滴眼液组次之,NS组最低。所有兔眼角膜上皮愈合率在造模后72 h均为100%。单因素方差分析结果显示造模后12、24 h,组间差异均无统计学意义(F=1.668、1.656,P=0.218、0.220),见图4、表1。造模后36、48 h,组间差异均有统计学意义(F=4.305、5.938,P=0.037、0.015);进一步两两比较结果显示,PAE组与hEGF滴眼液组的角膜上皮愈合率差异均无统计学意义(t=0.229、0.802,P=0.823、0.437);PAE组与NS组的角膜上皮愈合率差异均有统计学意义(t=2.783、3.340,P=0.016、0.005);hEGF滴眼液组与NS组的角膜上皮愈合率差异均有统计学意义(t=2.254、2.477,P=0.032、0.028),见图5、表1。

表1 三组不同时间点角膜上皮愈合率比较
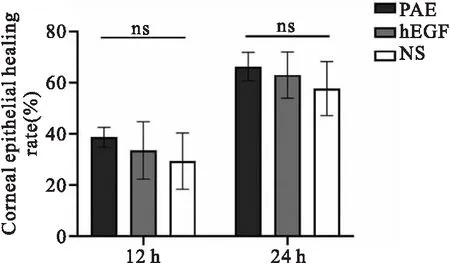
图4 三组12、24 h角膜上皮愈合率比较注:ns:差异无统计学意义。

图5 三组36、48h角膜上皮愈合率比较注:ns:差异无统计学意义;*:P<0.05;**:P<0.01。
2.3 组织病理学检查结果
角膜组织病理学检查结果显示,正常角膜组织上皮细胞排列有序,上皮细胞之间、上皮细胞与基底膜之间连接紧密。在角膜上皮损伤模型中,可以看到上皮细胞层的缺失,基底膜与基质层完整,基质层胶原纤维均匀规则且排列有序,见图6。角膜上皮损伤后24 h,可见三组角膜上皮层均未完全修复,上皮细胞逐渐移行填补缺损区域。角膜上皮损伤后48h,PAE组上皮细胞已经完全覆盖缺损区域,但此时的上皮细胞层较薄,上皮细胞之间连接较为疏松;hEGF滴眼液组和NS组上皮细胞均未完全覆盖缺损区域,且相比而言NS组的角膜上皮缺损区域更大。角膜上皮损伤后72h,hEGF滴眼液组和NS组上皮细胞均已经完全覆盖缺损区域。对三组角膜上皮层厚度进行比较发现,PAE组上皮细胞层最厚,与正常角膜上皮细胞层厚度接近,且上皮细胞之间排列更加紧密;hEGF滴眼液组次之;NS组最薄,见图7。

图6 角膜组织病理切片(100×)(正常角膜(左)、角膜上皮损伤模型(右))

图7 三组24、48、72 h角膜组织病理切片(100×)
3 讨论
角膜是暴露在外部环境中眼睛的一部分,最有可能因各种因素而受损。角膜上皮是一种可再生的组织,位于角巩膜交界处的角膜干细胞为上皮再生提供终生的增殖细胞供应[5-6]。角膜上皮创面愈合的过程包括两个不同的阶段:初始潜伏期和闭合期[7-8]。整个过程中,严密调控的交互信号级联反应涉及愈合的角膜上皮、泪液、泪腺、角膜神经、角膜基质细胞和骨髓来源的细胞,以及它们产生的细胞因子、生长因子和其他调节因子[9-10]。有助于重建上皮完整性和恢复角膜动态平衡,进而保持角膜的透明度和良好的视力。中医称角膜为黑睛,角膜属肝,为风轮。角膜上皮损伤属于黑睛生翳的范畴,中医认为黑睛生翳应多从肝论治,同时辅以退翳明目治疗。治疗黑睛生翳主要通过以下途径:一是祛风热泄肝火以祛除病因;二是补其不足以恢复正气驱邪外出;三是收敛固涩以缩小病灶;四是活血以消散局部瘀滞[11]。
美洲大蠊性寒味咸,作为一味中药材,无论是中药散剂还是美洲大蠊的提取物,其在疾病治疗中均发挥着重要作用,如抗菌、抗病毒、抗肿瘤、增强免疫功能、促进组织修复和伤口愈合等[12]。现代医学研究发现PAE能够激活免疫细胞,促进坏死组织脱落,肉芽组织生长。可以通过调节与细胞增殖、纤维化形成、再上皮化和重塑相关基因的表达来促进伤口愈合[13]。对皮肤组织、肠道粘膜的损伤修复具有良好的促进作用,被广泛用于外伤、溃疡、烫伤创面,并取得了显著疗效。而角膜和皮肤都是提供身体外部屏障的器官,这两个组织都发展了保护机体免受广泛外部威胁的内在机制,同时也使组织完整性和器官特异性功能得以快速恢复。皮肤创伤修复的研究揭示了再生生物学中的基本原理,皮肤屏障被破坏后,炎症细胞的涌入、肌成纤维细胞的分化、细胞外基质的合成和瘢痕的形成在角膜和皮肤伤口愈合中呈现平行的修复机制。皮肤和角膜创伤修复反应的细胞和分子网络存在相似性[14]。
本次动物实验的研究方向,是通过乙醇法建立新西兰大白兔角膜上皮损伤模型,探索PAE对兔角膜上皮损伤修复的影响,寻找更加安全有效的药物来解决目前角膜创面愈合所面临的问题。本研究中,在使用PAE干预后的多个时间点内,所有兔眼均未观察到明显的结膜充血、眼睑肿胀、分泌物等情况,没有角膜感染、角膜上皮反复剥脱等异常情况发生。表明该药物作用于角膜创面温和无刺激,这与PAE应用于皮肤组织、肠道粘膜的损伤修复效果相似,均没有出现明显的不良反应[15-16]。与NS组相比,PAE组的角膜上皮修复速率更快;在干预后36、48 h,PAE组的角膜上皮愈合率均显著高于NS组。表明PAE能够促进角膜上皮损伤的修复,缩短角膜创面完全愈合的时间。组织病理学检查结果显示,干预后72 h, PAE组角膜上皮层厚度相较于hEGF滴眼液组和NS组更厚,上皮细胞之间排列更加紧密,表明PAE能促进角膜上皮损伤后角膜上皮的重塑。
综上所述,PAE可以通过减轻创面炎症反应、提高免疫和抗氧化活性、调节细胞生长因子的表达、调节与伤口愈合相关的信号通路等途径促进皮肤组织修复[17],而皮肤和角膜创伤修复反应的细胞和分子网络存在相似性,因此PAE可能通过相似的作用机制来促进角膜上皮损伤的修复。目前的基础研究和临床实验主要针对PAE促进皮肤组织、胃肠道黏膜创面修复开展研究,尚无PAE应用于角膜创伤修复的报道。本研究结果表明,PAE对角膜组织的创伤修复同样具有促进作用,为角膜损伤的治疗提供了新的思路。
本研究结果虽表明PAE对角膜组织的损伤修复具有促进作用,但是本研究的样本量相对较少,PAE促进角膜上皮损伤修复的效果与hEGF滴眼液组相比差异无统计学意义。本研究中所使用的美洲大蠊提取液成分复杂,具体的有效成分和作用机制还需要进一步研究明确。此外,研究中所使用的美洲大蠊提取液浓度单一,药物的最佳有效浓度也需要扩大样本量,进一步探索。

