黄河上游区斑块化退化高寒草甸土壤线虫群落分布特征
陈国榕, 李希来, 李成一, 杨鹏年, 佘延娣, 吴 勇
(1. 青海大学农牧学院, 青海 西宁 810016; 2. 重庆文理学院化学与环境工程学院, 重庆 永川 402160)
黄河上游区高寒草甸是青藏高原的主要草地类型之一,在高原农牧业、生物多样性保护以及涵养水源等众多方面发挥着重要的作用[1-2]。近几十年来,全球气候变化及过度放牧等自然和人为因素造成的青藏高原高寒草甸严重退化。在高原鼠兔暴发干扰下,高寒草甸呈现局部死亡和剥蚀现象,草甸土壤自然沉降形成塌陷坑,形成了斑块状植被群落分布格局[3]。退化斑块随着高原鼠兔的频繁活动扩大连通,最终形成裸露斑块[4]。为了防止黄河上游区域高寒草甸斑块化退化的进一步发生,一般采取控制高原鼠兔数量进行生态恢复,使草地植物群落由裸露斑块逐步演替形成为短期恢复斑块(1—3年)、长期恢复斑块(10年以上),最终恢复至健康高寒草甸[3,5]。目前,众多研究主要关注高寒草甸修复过程中植物群落组成、地上及地下生物量、土壤理化性质、微生物群落等变化,对地下土壤动物类群研究较少[5]。
土壤线虫隶属线虫动物门,是一种分布广泛、数量巨大的无脊椎动物[6],其群落特征和个体形态对环境扰动的响应敏感,已被认为是理想的环境指示生物,常用于评估土壤食物网结构和功能,有效地提升了地下生物多样性和功能的精确化和可视化水平[7-8]。科研工作者前期针对草地退化及植被恢复等状态下线虫变化开展了一系列研究,发现线虫群落组成与结构随着土壤环境和质量发生显著变化[9-10]。但是对黄河上游区不同类型退化斑块的植被类型、土壤理化性质变化研究较少,土壤线虫群落组成和多样性对不同类型退化斑块的响应更是尚未得到进一步研究。
土壤线虫形态学鉴定方法由于其鉴定结果稳定、准确等特点被广泛应用于土壤线虫群落的组成、结构及多样性调查中[11]。该方法基于线虫的形态学特征,在光学显微镜下对土壤中分离提取出的线虫进行计数和鉴定。然而,形态学鉴定方法的使用仍具有局限性,例如需要专业分析鉴定人员,鉴定耗时过长等问题[12]。随着生物信息学及分子生物学的快速发展,近年来,高通量测序技术为快速开展线虫群落研究提供了可能[13-14],已被广泛应用于森林、草地及农田等生态系统中[15-16]。例如,Kerfahi等[17]通过高通量测序技术对热带雨林和北极冻土带土壤线虫进行了调查,发现前者线虫群落多样性更高;Darby等[18]发现经过焚烧处理后的农田土壤线虫丰富度高于焚烧前;Gao等[19]通过高通量测序法分析了荒漠草原露天矿废弃地土壤性质和线虫群落结构与功能,得到该生态系统中的关键土壤线虫属。高通量测序技术克服了传统的形态学鉴定方法的局限,具有较高的灵敏度,测序样品量大且能够提供更高的线虫分辨率[20],但同时存在鉴定结果不稳定,对营养类群分析有偏差,只能以相对多度表征物种数量等弊端[21]。目前,关于形态学鉴定和高通量测序分析结果的一致性研究仍在继续。Treonis等[22-23]对比了两种分析方法,发现二者的丰度结果不一致;而Du等[12]则提出二者在土壤线虫营养类群多度和生物量结果上呈现正相关关系。因此,关于高通量测序技术的应用及与形态学鉴定的差异性研究,仍需要进行进一步的讨论。
本研究选择黄河上游区门源县不同类型高寒草甸恢复斑块的土壤线虫群落作为研究对象,采用形态学鉴定对线虫群落组成、结构及多样性进行分析,并辅以高通量测序技术在分子生物学水平上对线虫群落多样性进行调查,目的在于比较土壤线虫群落在两种分析方法下的差异,为后续土壤线虫的鉴定方法与研究提供科学思路。同时探讨高寒草甸土壤理化性质和其退化对土壤线虫群落组成的影响,为深入理解土壤线虫群落组成在不同类型斑块化退化高寒草甸下的变化规律提供数据支持,也为高寒草甸生态系统的草地管理提供借鉴。
1 材料与方法
1.1 研究区概况
本研究地点位于青海省海北藏族自治州门源县东部黄河二级支流大通河境内(37°46′57″N,101°19′57″E),选取海拔介于3 115~3 128 m的高寒草甸进行取样。门源县年平均气温0.8℃,年降水量350~600 mm,该区域内草地类型为高寒草甸,主要优势植物有矮生嵩草(Kobresiahumilis)、针茅(Stipacapillata)、和黑褐苔草(Carexsupina)等。
1.2 样地选择
2022年8月,在门源县研究区,采用随机区组设计,随机选取裸露斑块及其他不同类型恢复斑块。斑块的分类以植被类型和植被总盖度为依据,一般分为裸露斑块、短期恢复斑块、长期恢复斑块等3类斑块。裸露斑块为高原鼠兔频繁活动区,土壤裸露疏松,植被盖度几乎为0;短期恢复斑块为禁止高原鼠兔活动后形成的斑块,具有少量如密花香薷(Elsholtziadensa)和细叶亚菊(Ajaniatenuifolia)等杂类草植物,植被盖度在20%~40%;长期恢复斑块为短期恢复斑块进一步演替所形成,主要以矮生嵩草为优势物种,植被盖度大于40%,详见宋梓涵和孙华芳[5,24]的研究。植被调查在不同斑块类型高寒草甸内,采用50 cm × 50 cm的样方重复测量3次。调查样地裸露斑块植被总盖度基本为0,短期恢复斑块植被总盖度约为39%,长期恢复斑块约为62%,高寒草甸约为86%。
1.3 样品采集与分析方法
在3种退化斑块及高寒草甸内各随机选取3个50 cm×50 cm的样方,用直径5 cm的土钻,通过五点取样法分别挖取0~15 cm土壤混合装入自封袋中,同种斑块类型均可以得到 3个土壤样品。采集的土壤样品过5 mm筛后分为3份,1份置于冰箱于4℃冷藏,用于形态鉴定法下分离和提取土壤线虫;1份在-80℃冷冻保存,用于土壤线虫的高通量测序分析;1份带回实验室阴干备用,用于测定土壤理化性质。采用重量分析法测定土壤含水量,利用AA3连续流动分析仪测定土壤全氮(Total nitrogen,TN)、全磷(Total phosphorus,TP),利用火焰光度法测定土壤全钾(Total potassium,TK),利用电位法测定土壤pH值。
1.4 土壤线虫形态学分离鉴定方法
利用改良的贝尔曼漏斗法在30 g湿润的土壤样品中分离线虫48 h,用无水甘油和酒精溶液固定并制片,在显微镜下根据每条线虫的形态特征,参照尹文英[25]和Bongers[26]对线虫进行形态学分类并计数。从每个样品中随机抽取100条线虫(不足100条的全部鉴定)进行科属鉴定,本文根据线虫的头部形态学特征和取食生境将土壤线虫鉴定到属水平。每个样品中线虫的总数量可以转换为每100 g干土中线虫的条数。依据线虫形态特征进行营养类群分类,将土壤线虫划分为5个营养类群:植食线虫(Plant feeders)、食细菌线虫(Bacterivores)、食真菌线虫(Fungivores)、捕食线虫(Predators)和杂食线虫(Omnivores),并依据线虫的生活史确定其c-p值,取值范围为1~5之间[27]。
1.5 土壤线虫DNA提取、PCR扩增和高通量测序
使用Power Soil DNA Isolation Kit(MoBio Laboratories,Carlsbad,CA)试剂盒提取各样地不同类型退化斑块总DNA,并使用1%琼脂糖凝胶电泳检测抽提的基因组DNA。采用18S通用引物(5′-GGTGGTGCATGGCCGTTCTTAGTT-3′)和(5′-AGCGACGGGCGGTGTGTACAAA-3′)扩增18S rDNA的V4可变区,扩增区域为(NF1-18Sr2b),PCR扩增总体系为25 μL。PCR产物采用1%琼脂糖凝胶电泳检测扩增目的条带大小(170 V,30 min),并用Agencourt AMPure XP核酸纯化试剂盒(Beckman Coulter,Kraemer Boulevard Brea,CA,USA)纯化。基于PCR产物建立线虫群落测序文库,在Illumina MiSeq平台上机测序。以上过程均委托北京奥维森基因科技有限公司完成。
获得原始测序数据后,根据条形码序列在QIIME(v1.8.0)软件中对样本进行分割,并通过Trimmomatic(v0.36)和Pear(v0.9.6)软件对数据进行过滤,以去除得分低于 20、含有模糊碱基和引物错配的序列[28]。然后,用Flash(v1.20)和Pear(v0.9.6)软件对过滤后的数据进行拼接,拼接时最小overlap设置为10 bp,错配率为 0.1[29]。使用Vsearch(v2.7.1)软件中的的denovo方法去除短序列和嵌合体序列。在Vsearch(v2.7.1)软件中,根据uparse算法,以 97% 的相似性阈值(Edgar,2013 年)对优质序列进行OTU(Operational taxonomic units)聚类。在NCBI的SRA数据库中,设置1e-5的阈值,通过Blast算法获得了与物种相对应的每个OTU的分类信息[30]。
1.6 数据分析
土壤线虫群落结构分析采用以下指标:
物种数(S):
S= the total number of taxa in each plot
均匀度指数(J′)[31]:
J′=H′/lnS
(1)
香农-威纳多样性指数(H′)[32]:
H′=-∑Pi(lnPi)
(2)
辛普森(Simpson)[33]:
(3)
式中Pi为第i类群中的个体数占线虫群落所有类群的个体总数的比例,式中S为类群数。
成熟度指数(MI)[27]:
MI=∑ci×fi
(4)
该指数用于描述土壤生态系统的稳定性和受干扰影响的程度。式中,ci为自由生活线虫的生活史c-p值,fi为土壤线虫群落中自由生活线虫所占的比例。
线虫通路比(NCR)[8]:
NCR=Ba/(Ba+Fu)
(5)
该指数用于描述分解通道中食细菌线虫和食真菌线虫的重要性,反映土壤有机质分解途径。式中,Ba为食细菌线虫的数量,Fu为食真菌线虫的数量。
富集指数(EI)[34]:
EI=100×(e/(e+b)
(6)
该指数用于描述外界营养物质输入的水平。式中,e=3.2Ba1+0.8Fu2,b=0.8(Ba2+Fu2)。
结构指数(SI)[35]:
SI=100×(s/(s+b)
(7)
该指数用于描述示土壤食物网的连通性和食物链的长度。式中,
s=(Ban×Wn)+(Fun×Wn)+(Opn×Wn),n=3,4,5;W3=1.8,W4=3.2,W5=5.0。
本研究采用SPSS 19.0(SPSS Inc.,Chicago,IL,USA)软件对数据进行统计分析。单因素方差分析(One-Way ANOVA)用于比较不同斑块化退化高寒草甸下土壤线虫群落特征的差异(P<0.05),平均值多重比较采用LSD法。采用Origin 2019软件对线虫群落进行主成分分析,解释不同恢复斑块类型下土壤线虫群落组成的差异。
2 结果与分析
2.1 不同类型斑块土壤理化性质特征
门源县不同类型斑块化草甸及高寒草甸理化性质如表1所示。pH值随植被恢复程度的增加而降低,在裸露斑块中达到最大值7.74,显著高于其他三类草甸(P<0.05)。土壤含水量、全氮的结果与pH值相反,在高寒草甸中显著高于其他裸露斑块和其他两类恢复斑块(P<0.05)。全磷含量随着斑块的恢复增高,但低于高寒草甸含量(1.45 g·kg-1)。全钾在短期恢复斑块中含量最高,为2.72%,显著高于裸露斑块和其他两类草甸(P<0.05)。

表1 不同斑块化退化高寒草甸土壤理化性质Table 1 Physical and chemical properties of different patches of degraded alpine meadow soil
2.2 土壤线虫群落结构特征
2.2.1土壤线虫群落多度 在形态学鉴定方法下,从门源县不同斑块类型及高寒草甸土壤中分离提取线虫平均密度为1 074条·100 g-1干土。调查结果表明,门源县不同类型斑块化土壤线虫数量变化趋势为:裸露斑块<短期恢复斑块<长期恢复斑块<高寒草甸(图1)。其中,短期恢复斑块和长期恢复斑块土壤线虫数量之间无显著差异,但显著高于裸露斑块(P<0.05),而高寒草甸土壤线虫数量与长期恢复斑块之间无显著差异,但显著高于裸露斑块和短期恢复斑块(P<0.05)。
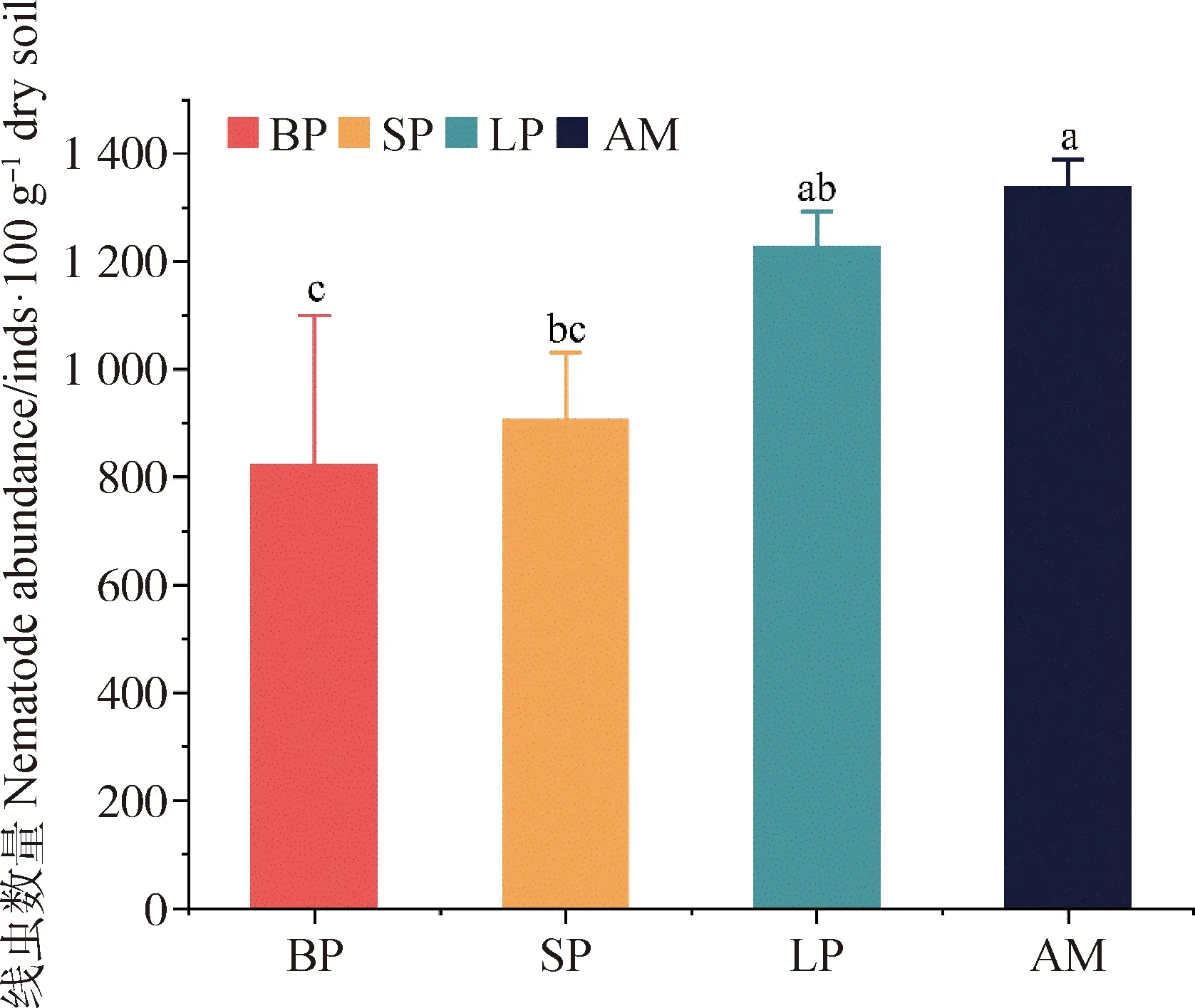
图1 形态学鉴定下不同斑块类型线虫群落数量(平均值+标准误)BP,裸露斑块;SP,短期恢复斑块;LP,长期恢复斑块;AM,高寒草甸Fig.1 Total abundance of soil nematode communities in different degraded patches with morphological identification method (mean+SE). BP,Bare patches;SP,Short-term recovery patches;LP,Long-term recovery patches;AM,Alpine meadows
通过高通量测序法只能比较不同采样地的线虫序列数量,获得土壤线虫的相对多度,无法获得土壤线虫的绝对多度。裸露斑块、短期恢复斑块、长期恢复斑块及高寒草甸通过高通量测序获得隶属于线虫动物门的优质序列数分别为6 419,7 480,1 286及2 199条。土壤样品序列数由高到低依次为短期恢复斑块、裸露斑块、高寒草甸、长期恢复斑块,这与形态学鉴定结果变化趋势不一致。
2.2.2属组成 通过形态学分离鉴定,共得到土壤线虫42属,其中有29个属在高通量测序法中也被鉴定到(表2),在裸露斑块、短期恢复斑块、长期恢复斑块和高寒草甸上分别鉴定27,24,28和33属。三类恢复斑块及高寒草甸上优势属(相对多度>10%)和常见属(相对多度>1%)数量占线虫总数的比例达到93%以上,稀有线虫属(相对多度<1%)为别为15,9,9和15个。不同斑块化退化草甸下土壤线虫群落的组成存在明显差异(图2)。裸露斑块的优势属为Cylindrolaimus,Diploseapter,Eucephalobus和Teratocephalus,其个体数量分别占总体的21.23%,15.14%,12.42%和11.11%;短期恢复斑块的优势属为Chiloplacus,Mesorhabditis和Rhabdolaimus,分别占总体的16.76%,11.64%和19.56%;长期恢复斑块的优势属为Acrobeloides,Cervidellus和Plectus,其数量分别占总体的11.31%,10.32%和11.51%;高寒草甸的优势属为Caenorhabditis和Cervidellus,占比分别为11.09%和11.42%。对不同恢复斑块及高寒草甸土壤线虫群落组成进行主成分分析,前两轴分别解释了29.8%和21.2%的变异信息(累计达51.0%)(图3a),结果表明土壤线虫群落在属水平上的组成格局具有差异。与短期恢复斑块相比,长期恢复斑块、高寒草甸土壤线虫群落组成与裸露斑块差异更显著(图3a)。
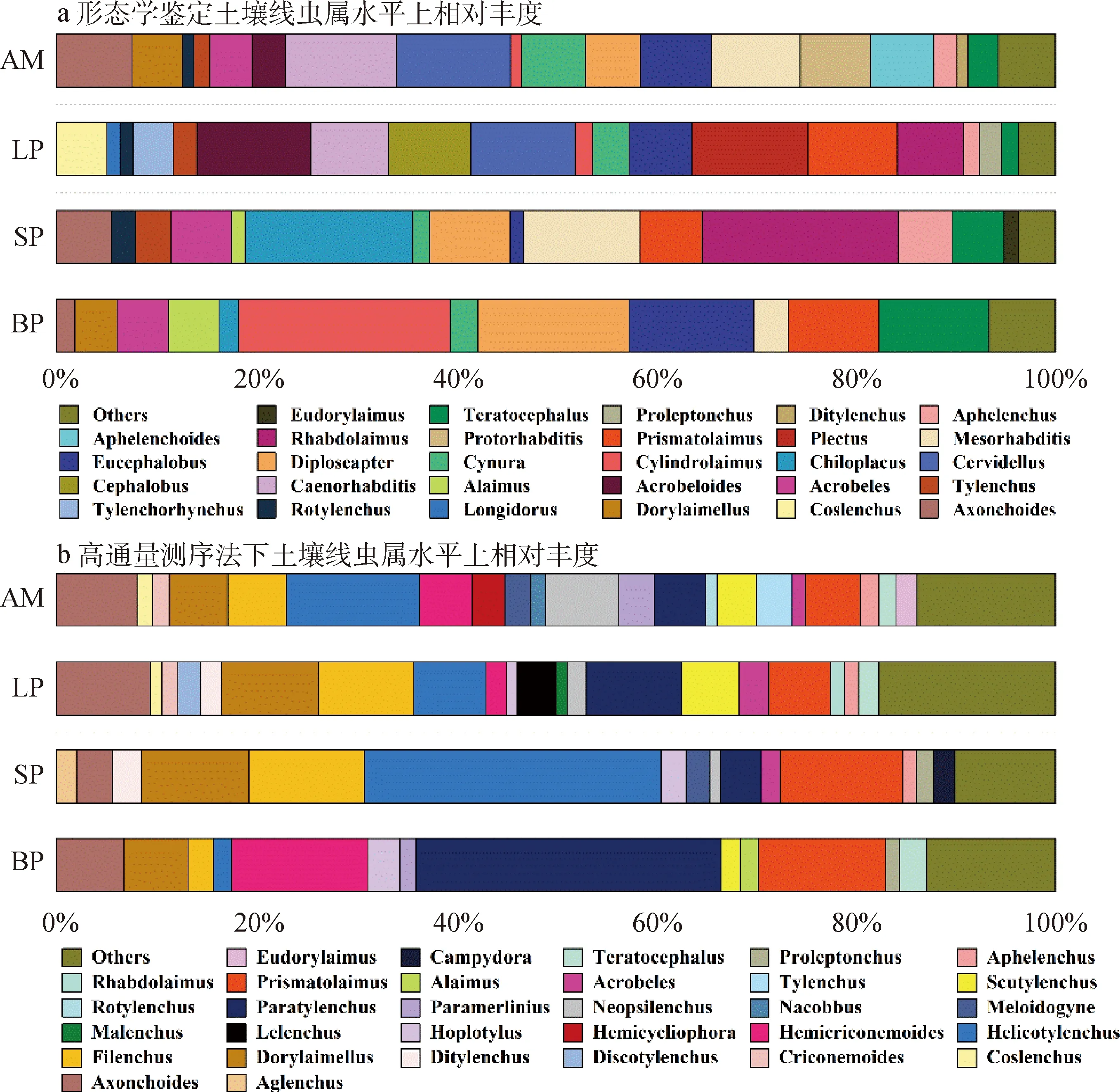
图2 黄河上游区不同恢复斑块土壤线虫属水平相对丰度。a:形态学鉴定法;b:高通量测序法;BP,裸露斑块;SP,短期恢复斑块;LP,长期恢复斑块;AM,高寒草甸Fig.2 Relative abundance of Nematode at genus level under different recovery patches of Alpine Meadow in the upper Yellow River under morphological identification a and HTS b. BP,SP,LP and AM represent bare patches,short-term recovery patches,long-term recovery patches and alpine meadows,respectively
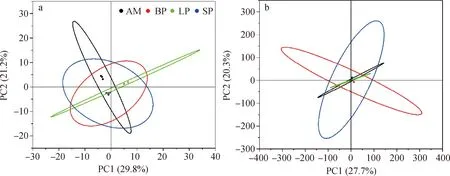
图3 黄河上游区不同恢复斑块下土壤线虫群落的主成分分析。a,形态学鉴定法;b,高通量测序法Fig.3 Principal component analysis of soil nematode communities under different recovery patches of Alpine Meadow in the upper Yellow River. a,Morphological identification method;b,High-throughput sequencing method
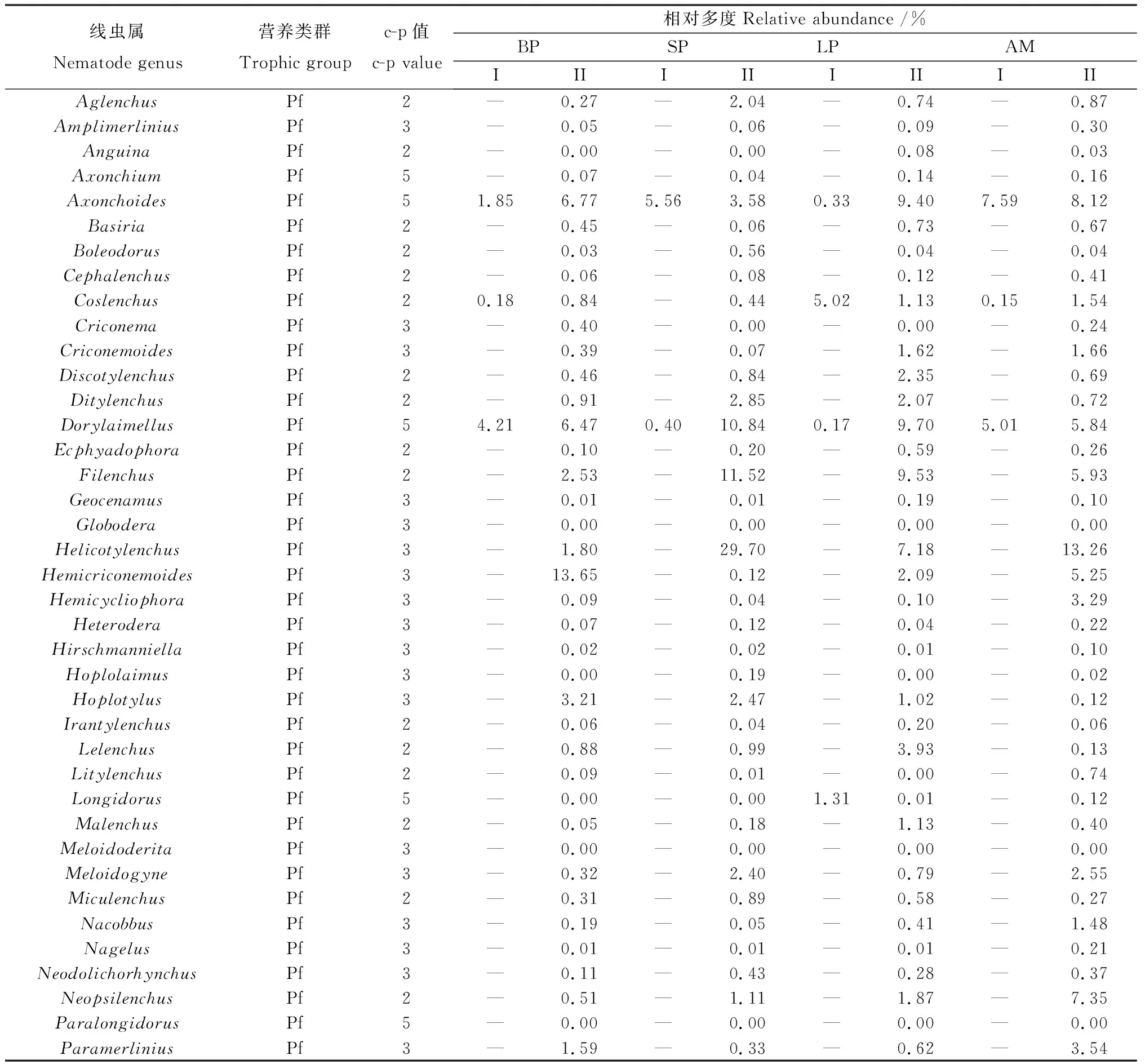
表2 基于形态学鉴定法和高通量测序法测定的黄河上游区斑块化退化斑块土壤线虫群落属相对多度Table 2 Relative abundance of soil nematode genera under different recovery patches of Alpine Meadow in the upper Yellow River based on morphological identification and high-throughput sequencing.
利用高通量测序鉴定到100属,裸露斑块、短期恢复斑块、长期恢复斑块和高寒草甸上分别鉴定87,83,85和90属(表2),显著高于形态学鉴定结果。在高通量测序中,优势属(相对多度> 10%)和常见属(相对多度> 1%)的数量占线虫总数的比例达到81%以上。相较于形态学鉴定方法,高通量测序技术在检测稀有属(相对多度< 1%)方面有更大的优势,裸露斑块、恢复斑块及高寒草甸中有65~74个稀有线虫属,其中部分属的相对多度甚至小于0.1%。不同斑块化退化草甸下土壤线虫群落的组成也存在明显差异(图2)。其中,裸露斑块的优势属为Hemicriconemoides,Paratylenchus和Prismatolaimus,相对多度占比依次为13.65%,30.53%和12.69%;短期恢复斑块的优势属为Dorylaimellus,Filenchus,Helicotylenchus和Prismatolaimus,相对多度占比分别为10.84%,11.52%,29.70%和12.30%;高寒草甸的优势属Helicotylenchus,相对多度为13.26%。基于高通量测序法,对不同恢复斑块及高寒草甸土壤线虫群落组成进行主成分分析,前两轴分别解释了27.7%和20.3%的变异信息(累计达48.0%)(图3b),结果表明高通量测序技术下土壤线虫群落在属水平上的组成格局相似度较高(图3b)。
2.2.3营养类群组成 通过形态学鉴定方法共得到植食线虫8属,食细菌线虫17属,食真菌线虫7属,捕食线虫4属,杂食线虫6属(表2),不同斑块高寒草甸下线虫群落营养类群结构不同,但无显著性差异(图4a)。植食线虫在裸露斑块、恢复斑块和高寒草甸上的变化趋势为高寒草甸>长期恢复斑块>短期恢复斑块>裸露斑块;食细菌线虫则为长期恢复斑块>裸露斑块>短期恢复斑块>高寒草甸;食真菌线虫在高寒草甸中最多,裸露斑块次之,长期恢复斑块最少;捕食线虫在三类斑块类型和高寒草甸上的变化趋势为裸露斑块>长期恢复斑块>高寒草甸>短期恢复斑块;杂食线虫多度由高到低依次为短期恢复斑块、裸露斑块、长期恢复斑块及高寒草甸。总体来看,形态学鉴定中土壤线虫营养类群数量排序为食细菌线虫>植食线虫>食真菌线虫>杂食线虫>捕食线虫(图4a)。

图4 黄河上游区不同恢复斑块下土壤线虫各营养类群的相对多度(平均值+标准误)Fig.4 Relative abundance (mean + SE) of soil nematode communities under different recovery patches of Alpine Meadow in the upper Yellow River注:a,形态学鉴定法;b,高通量测序法。BP,裸露斑块;SP,短期恢复斑块;LP,长期恢复斑块;AM,高寒草甸。Pf,植食线虫;Ba,食细菌线虫;Fu,食真菌线虫;Pr,捕食线虫;Om,杂食线虫Note:a,Morphological identification method;b,High-throughput sequencing method. BP,Bare patches;SP,Short-term recovery patches;LP,Long-term recovery patches;AM,Alpine meadows. Pf,Plant-feeding nematodes;Ba,bacterivores;Fu,fungivores;Pr,predators;Om,omnivores
在高通量测序技术中共得到植食线虫50属,食细菌线虫19属,食真菌线虫12属,捕食线虫10属,杂食线虫9属(表2),同形态学鉴定法,不同斑块高寒草甸下线虫群落营养类群结构不同,但无显著性差异(图4b)。植食线虫在三类斑块类型和高寒草甸上的变化趋势为高寒草甸>短期恢复斑块>裸露斑块>长期恢复斑块;食细菌线虫则为裸露斑块>短期恢复斑块>长期恢复斑块>高寒草甸;食真菌线虫在长期恢复斑块中最多,裸露斑块次之,短期恢复斑块最少;捕食线虫在三类斑块类型和高寒草甸上的变化趋势为长期恢复斑块>高寒草甸>短期恢复斑块>裸露斑块;杂食线虫多度由高到低依次为长期恢复斑块、高寒草甸、裸露斑块及短期恢复斑块。总体来看,高通量测序技术中土壤线虫营养类群数量排序为植食线虫>食细菌线虫>食真菌线虫>杂食线虫>捕食线虫(图4b)。
2.3 斑块类型对线虫生态功能的影响
在形态学鉴定下,土壤线虫群落结构及生态功能指数受到不同斑块类型的影响(表3)。在线虫群落结构方面,不同斑块类型下物种数和香农-威纳指数呈现极显著差异(P<0.001),均匀度指数和辛普森指数出现显著性差异(P<0.05)。具体来看,物种数和香农-威纳指数在不同斑块类型和高寒草甸的变化趋势一致,为高寒草甸>长期恢复斑块>短期恢复斑块>裸露斑块;均匀度指数和辛普森指数在长期恢复斑块中最高,高寒草甸次之,裸露斑块最低(图5),这表明长期恢复斑块和高寒草甸显著提高了土壤线虫群落多样性。在不同斑块类型下,生态功能指数除了线虫通路比无显著性差异,成熟度指数、富集指数和结构指数均为及显著差异(P<0.001)。形态学鉴定中,成熟度指数的变化趋势为裸露斑块>短期恢复斑块>长期恢复斑块>高寒草甸,富集指数则在高寒草甸中最高,短期恢复斑块、长期恢复斑块次之,裸露斑块中最低;线虫通路比均大于0.5,这说明所有样地中土壤食细菌线虫数量高于食真菌线虫(图5)。

图5 形态学鉴定和高通量测序技术下不同恢复斑块类型对线虫物种数(a)、均匀度指数(b)、香农-威纳指数(c)、辛普森指数(d)、成熟度指数(e)、线虫通路比(f)、富集指数(g)和结构指数(h)的影响(平均值+标准误)Fig.5 Effect of different recovery patches on Spices (a),Pielou(b),Shannon-wiener(c),Simpson(d),Maturity Index(e),Nematode Channel Ratio(f),Enrichment Index(g),and Structure Index(h) (mean + SE) of total nematodes under Morphological identification method and High-throughput sequencing method注:BP,裸露斑块;SP,短期恢复斑块;LP,长期恢复斑块;AM,高寒草甸。不同小写字母表示样地间差异显著(P<0.05)Note:BP,Bare patches;SP,Short-term recovery patches;LP,Long-term recovery patches;AM,Alpine meadows. Different lowercase letters indicate significant difference at the 0.05 level

表3 形态学鉴定和高通量测序技术下斑块类型对线虫群落结构和生态功能的影响Table 3 Effects of different recovery patches on nematode communities structure and Nematode community ecological function under morphological identification and high-throughput sequencing methods
在高通量测序技术下,仅有均匀度指数、香农-威纳指数和辛普森指数在不同斑块类型下出现显著性差异(P<0.001),变化趋势为长期恢复斑块>高寒草甸>短期恢复斑块>裸露斑块,与形态学鉴定结果基本一致,表明斑块化退化高寒草甸的恢复显著提高了土壤线虫群落丰富度(图5)。不同恢复斑块及高寒草甸中的物种数均高于形态学鉴定结果,在裸露斑块、短期恢复斑块和高寒草甸中变化趋势同均匀度指数、香农-威纳指数、辛普森指数一致,但物种数在长期恢复斑块中最低。成熟度指数和结构指数在裸露斑块、短期恢复斑块和长期恢复斑块中趋势一致,具体表现为裸露斑块>长期恢复斑块>短期恢复斑块,高寒草甸的成熟度指数最低,但结构指数仅次于长期恢复斑块。同样在所有斑块类型下的线虫通路比均大于0.5,这说明所有样地中土壤食细菌线虫数量高于食真菌线虫,这与形态学鉴定结果一致。富集指数随着斑块的恢复逐渐增大,在高寒草甸中最高。
3 讨论
3.1 基于形态学鉴定与高通量测序法的土壤线虫多度比较
形态学鉴定方法可以准确获得土壤线虫群落的绝对多度,而高通量测序技术只能通过线虫序列数量获得线虫群落的相对多度[36]。分析结果表明,两种分析方法测得的土壤线虫多度在退化斑块恢复演替过程(裸露斑块—短期恢复斑块—长期恢复斑块—高寒草甸)中发生了明显的变化,且变化趋势基本不一致,具体表现为:形态学鉴定方法中,裸露斑块中的线虫数量最低,短期恢复斑块和长期恢复斑块逐渐增加,在高寒草甸中达到最高,该结论与Wang等[37-38]的结论一致;在高通量测序中不同斑块类型高寒草甸的土壤线虫多度变化趋势为短期恢复斑块>裸露斑块>高寒草甸>长期恢复斑块。导致两种方法下线虫多度趋势不同的原因可能是由于高通量测序技术下线虫基因数据库不够完善。在本研究中,基于形态学鉴定,发现土壤线虫多度与pH值、土壤含水量、全氮和全钾含量的变化趋势有关(表1)。其中,土壤线虫多度随着土壤含水量、全氮和全钾的升高而增加,pH值的变化趋势则相反,该结果与Wang等人的研究一致[39-40]。这可能是由于随着斑块化退化高寒草甸的恢复,植物地上、地下物种多样性增加,土壤营养元素含量升高,显著改善了输入土壤的资源与数量[41],为线虫提供了更为多样化的食物资源[42]。
3.2 基于形态学鉴定与高通量测序法的土壤线虫群落组成和结构比较
形态学鉴定方法与高通量测序技术相比,二者的区别还在于高通量测序技术具有更高的分类学分辨率[23]。形态学鉴定法一般将线虫鉴定到属水平,且需要花费大量时间,而高通量测序技术可以短时间内提供线虫在物种水平上的信息。此外,高通量测序技术较形态学鉴定方法来说,可以注释到更多的线虫类群数[22]。通过形态学分离鉴定,共得到土壤线虫43属,在裸露斑块、短期恢复斑块、长期恢复斑块和高寒草甸上分别鉴定21,18,19和25属。利用高通量测序鉴定到101属,在裸露斑块、短期恢复斑块、长期恢复斑块和高寒草甸上分别鉴定90,92,85和91属。通过两种分析方法鉴定出的线虫属数量差异较大的原因可能是由于在形态学鉴定中,采用贝尔曼漏斗法,通常利用线虫自身的重量和趋水性分离提取线虫,故受外部环境温度以及线虫的活性影响比较大,导致部分线虫损失[43]。而高通量测序技术则是通过引物扩增DNA,可以获得更多的线虫类群,尤其是稀有线虫类群(相对多度<1%)的获得[12]。通过高通量测序技术,测得地中有65~76个稀有线虫属,其中部分属的相对多度甚至小于0.1%。
尽管高通量测序技术可以获得更多的线虫类群,但在本研究中通过形态学鉴定方法任有13个线虫属无法通过高通量测序技术鉴定到。例如食细菌线虫的广杆属(Caenorhabditis)、头叶属(Cephalobus)、鹿角唇属(Cervidellus)、板唇属(Chiloplacus)、钩唇属(Diploseapter)、中杆属(Mesorhabditis)和原杆属(Protorhabditis),食真菌线虫的茎属(Ditylenchus),捕食线虫的狭咽属(Discolaimium)、真矛线属(Eudorylaimus)、厚唇属(Labronema)及杂食线虫的异矛线属(Allodorylaimus)、库氏线属(Coomansinema),导致通过高通量测序技术获得的食细菌线虫、捕食线虫的相对多度有所下降。此外,高通量测序技术获得植食线虫50属,显著高于形态学鉴定方法得到的8属。这些结果表明,两种方法获得的营养类群有差异,高通量测序在植食线虫的获得方面具有优势,而形态学鉴定易于获得更多的食细菌线虫,这与Gao等[14,44]的研究结果一致。造成两种方法在线虫营养类群鉴定方面产生差异的主要原因可能是:(1)在形态学鉴定中处于不同发育阶段的线虫鉴定起来存在困难[45-46];(2)在高通量测序技术中,目前使用到的数据库中收集的线虫序列多集中在植食线虫,且部分线虫在数据库中没有已知的匹配项,导致无法识别[12]。因此在未来的研究中有必要补充和改进参考数据库,同时结合形态学鉴定和高通量测序技术可以加速不同规模和生态系统中线虫群落的研究。
两种分析方法的PCA分析结果表明:形态学鉴定下,裸露斑块、短期恢复斑块与长期恢复斑块及高寒草甸间土壤线虫群落的组成存在显著差异(图3a),表现在不同种类斑块的优势属不同(图2a);高通量测序技术中,不同斑块类型及高寒草甸中土壤线虫群落的组成差异性不大(图3b)。总体来看,在形态学鉴定和高通量测序技术中,土壤线虫群落的优势属由食细菌线虫转化为植食线虫。具体看来,在形态学鉴定中,植食线虫多度随斑块的恢复逐渐增加(图5a),这可能是由于植被的恢复为植食线虫提供了更多食物资源[47]。捕食线虫和杂食线虫分别在裸露斑块和短期恢复斑块中相对多度最高(图5a),可能是由于补偿机制的出现,导致耐受性捕-杂食线虫种群在该类斑块类型下增加[48]。高通量测序技术中,植食线虫在高寒草甸中最大(图5b),结果与形态学一致。捕食线虫、杂食线虫和食真菌线虫在长期恢复斑块中相对多度最高(图5b),表明在长期恢复斑块下,生态系统最为稳定。
3.3 基于形态学鉴定与高通量测序法的土壤线虫生态指数比较
线虫群落生态指数反映了线虫群落的组成结构、多样性及食物网的结构与功能特征,对土壤生态环境具有指示作用[27,49]。本研究表明在两种分析方法下,土壤线虫群落结构及相关生态功能指数会受到斑块类型的影响(表3)。在形态学鉴定中,斑块类型的不同,极显著的影响了门源县的物种数、香农-威纳指数、成熟度指数富集指数和结构指数,均匀度指数、辛普森指数也在三类退化斑块和高寒草甸中有显著性差异。而在高通量测序技术中,仅有均匀度指数、香农-威纳指数及辛普森指数受到斑块类型的影响,其他生态指数未出现显著性差异。
已有研究表明,退化高寒草甸的恢复能够显著提高土壤线虫多样性[50-52]。在本研究中也得到了一致的结论,即长期恢复斑块和高寒草甸的物种数、均匀度指数、香农-威纳指数及辛普森指数均显著高于裸露斑块和短期恢复斑块,这也再次证实了随着黄河上游区斑块化高寒草甸的恢复改善了线虫生活环境[53],提升了进入土壤的资源数量和土壤质量,导致土壤线虫多样性得到显著提高[42]。在高通量测序中,物种数、均匀度指数、香农-威纳指数和辛普森指数的结果与形态学相似,即在长期恢复斑块和高寒草甸中均大于裸露斑块和短期恢复斑块,这也再次证实了长期恢复斑块显著改善了土壤食物资源,表明两种群落分析方法在土壤线虫群落多样性对退化斑块的响应上结果一致。
在两种分析方法中,成熟度指数基本随着斑块化高寒草甸的恢复逐渐降低,并在高寒草甸中达到最低值。裸露斑块和短期恢复斑块成熟度指数较大的原因可能是由于随着高寒草甸退化程度的增大,土壤孔隙度增大,捕食线虫和杂食线虫的比例增加,导致在裸露斑块、短期恢复斑块中出现通过捕食线虫、杂食线虫驱动的下行效应调控[11]。线虫通路比(NCR)反映了土壤有机质分解途径,用于评估土壤有机质分解中细菌通道和真菌通道的相对重要性[8]。两种分析方法结果表明不同退化斑块高寒草甸的土壤线虫NCR指数均大于0.5,说明黄河上游区退化斑块土壤食物网有机质的分解以细菌通道为主。线虫富集指数和结构指数分别用于指示土壤食物网的复杂性和评估食细菌线虫和食真菌线虫对环境的敏感程度。在形态学鉴定中,短期恢复斑块、长期恢复斑块及高寒草甸富集指数大于50,这表明上述两种斑块及高寒草甸土壤养分富集状况较好,而其裸露斑块土壤富集状况相对较差[8]。然而,在高通量测序技术中,仅有高寒草甸线虫富集指数高于50。两种分析方法所获得的结构指数均高于50,表明退化斑块土壤生态系统稳定性较好,土壤食物网的连通性和复杂性较高[27]。
4 结论
土壤线虫形态学鉴定结果表明随着退化斑块的自然恢复,土壤线虫数量逐渐增加,与高通量测序技术结果不一致。两种分析方法的生态指数测定结果均表明随着退化斑块的恢复,土壤线虫生物多样性增加。综合比较,形态学鉴定和高通量测序技术在线虫群落特征调查各有利弊,形态学鉴定方法可以准确获得土壤线虫群落的绝对多度,而高通量测序技术只能通过线虫序列数量获得线虫群落的相对多度,但高通量测序技术具有更高的分类学分辨率,可以短时间内提供线虫在物种水平上的信息。此外,高通量测序技术可以注释到更多的线虫类群数。相较于形态学鉴定结果以食细菌线虫为主,高通量测序技术则以植食线虫为主,这有助于探索退化草甸恢复过程中植食线虫随植被恢复的变化,同时也会过度放大植食线虫对土壤生态系统的影响。尽管高通量测序技术为快速洞察线虫多样性提供了有效的技术手段,但仍存在一些局限性导致其测定结果准确性、与形态学鉴定结果的一致性较差。因此,高通量测序在线虫多样性研究中的应用在未来需要不断验证和更新,以期为线虫群落快速鉴定和评价斑块化退化高寒草甸提供有力支持。

