川芎嗪对H22肝癌小鼠血管生成及KLF4/VEGF/ADAMTS1通路的影响❋
张占栋,马 瑞,李瑞芳,李三强,都婉红
(1.河南推拿职业学院,河南洛阳 471023;2.河南科技大学基础医学与法医学院,河南洛阳 471023)
原发性肝癌是临床常见的恶性肿瘤,其死亡率较高,其中75%~85%为肝细胞癌(hepatocellular carcinoma,HCC)[1]。由于症状不明显,绝大多数HCC患者初次就诊时已处于中晚期,患者预后较差[2-3]。HCC的高发病率、高复发率、高死亡率和目前治疗方案的局限性[2,4],使其成为人类面临的重大公共卫生问题之一。深入研究HCC发生发展的分子机制对寻找更有效的治疗方法具有重要意义。
HCC是一种富含血管的肿瘤[5],血管生成在其进展和转移中起关键作用。在肝癌细胞株和肝细胞癌患者的组织中,普遍检测到血管内皮生长因子(vascular endothelial growth factor,VEGF)及其受体(vascular endothelial growth factor receptor,VEGFR)的高度表达[6]。VEGF是促血管生成作用最强的细胞因子[7],抑制VEGF的生成间接地抑制了肿瘤的生长和转移。已有报道表明,抑癌基因Kruppel样因子(Kruppel-like factor,KLF)4和人金属肽酶含血小板反应蛋白(human A disintegrin and metalloprotease,ADAMTS) 1在多种消化道肿瘤中呈低表达状态,并与血管生成密切相关[8-11],然而它们在HCC中的表达变化尚未得到阐明。
川芎嗪(tetramethylpyrazine,TMP)是中药川芎的有效单体,具有抗氧化、改善微循环、活血化瘀、抗血小板凝集、抗血栓形成以及抗纤维化等作用,临床上广泛用于预防和治疗血管性疾病。研究发现川芎嗪还具有抗肿瘤活性,能够抑制肿瘤细胞的增殖并促进其凋亡,对消化道肿瘤、骨肉瘤、肺癌、卵巢癌等均表现出一定的治疗潜力[12-15]。然而,其对HCC的研究尚未见报告。因此,本实验旨在研究川芎嗪对H22肝癌小鼠的抑瘤作用及对肿瘤血管生成的影响,进一步探究其是否通过调控KLF4/VEGF/ADAMTS1信号通路来抑制肿瘤血管生成的机制,为临床HCC的治疗提供新的思路。本研究由河科大一附院伦理委员会审核,编号:2020-04-B036。
1 材料
1.1 动物与细胞
40只健康雄性BALB/c小鼠,体质量20~22 g,河南科技大学实验动物中心提供,动物许可证号:SCXK(苏)2017-0 001。H22肝癌瘤种由河南省医学科学研究院惠赠,以腹腔代传形式在小鼠体内传代,瘤种每7 d代传1次。
1.2 主要药品与试剂
注射用盐酸川芎嗪,规格:40 mg,批号:201605051,国药准字:H20031302,平光制药股份有限公司生产;盐酸多柔比星(doxorubicin hydrochloride,DOX),规格:10 mg,批号:1704E2,国药准字:H44024359,浙江海正辉瑞制药有限公司生产;二喹啉甲酸(biquinolinecarboxylic acid,BCA)蛋白测定试剂盒(上海碧云天公司,货号:P0010);兔多抗GAPDH(杭州贤至生物有限公司,货号:AB-P-R 001);兔多抗KLF4(武汉三鹰生物技术有限公司,货号:11880-1-AP);兔多抗VEGF、兔多抗ADAMTS1(武汉博士德生物工程有限公司,货号:BA0407、BA3575-2);CD34(Abcam公司,货号:Ab81289);谷丙转氨酶(glutamic-pyruvic transaminase,ALT)、门冬氨酸转氨酶(glutamic oxalacetic transaminase,AST)ELISA测试盒(南京建成公司,货号:C009-2-1、C010-2-1)。
1.3 主要仪器
石蜡切片机(德国莱卡公司,型号:RM2016);Thermo酶标仪(美国Thermo公司,型号:mμlISKANMK3);普通光学显微镜及照相系统(日本OLYMPUS,型号:BX43);垂直电泳槽、电转仪(北京六一仪器厂,型号:DYCZ-24DN、DYCZ-40)。
2 方法
2.1 造模与分组
40只健康雄性BALB/c小鼠适应性饲养1周后,将无菌抽取的H22小鼠腹腔积液调整肿瘤细胞密度至1×107/mL,在每只小鼠腋部皮下注射0.2 mL肿瘤细胞建立H22肝癌小鼠模型。24 h后随机分为模型组、低、高剂量组、阳性对照组,每组各10只小鼠。
2.2 给药
给药体积为0.1 mL/10 g,给药途径均为腹腔注射。模型组小鼠腹腔注射同等剂量0.9%氯化钠溶液,低、高剂量组小鼠腹腔注射TMP,剂量分别为25 mg/kg、50 mg/kg,每日1次,阳性对照组小鼠腹腔注射DOX 2 mg/kg,隔日1次。所有药物从接种第2天开始给药,持续10 d。
2.3 ELISA法测定H22小鼠血清转氨酶的含量
最后1次给药24 h后取材,眼球采血,取上清液检测ALT、AST含量。
2.4 检测肿瘤抑瘤率
采血完成后,采用脱臼法处死小鼠,解剖剥离各组小鼠的腋下瘤,称其质量,计算肿瘤抑瘤率。计算公式为:抑瘤率=(1-用药组平均瘤质量/模型组平均瘤质量)×100%。
2.5 HE染色检测肝脏组织的病理形态学改变
取腋下瘤组织在4%甲醛中固定24 h,流水冲洗,梯度乙醇脱水,二甲苯透明,石蜡包埋,制成5 μm的组织切片,进行HE常规染色。
2.6 免疫组化观察肿瘤组织微血管生成
采用免疫组化SP法检测H22肝癌小鼠肿瘤组织的微血管生成。肿瘤组织切片脱蜡水化,灭活内源性过氧化物酶,抗原修复,血清封闭,37 ℃一抗(CD34稀释200倍)孵化1 h,含吐温-20的磷酸盐缓冲液(phosphate buffered solution,PBST)洗3次,二抗孵育1 h,二氨基联苯胺(diaminobenzidine,DAB)显色,复染、流水蓝化,封片,镜检拍照。
2.7 Western blot检测腋下瘤组织中KLF4、VEGF和ADAMTS1蛋白表达
提取肿瘤组织总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)定量,取蛋白60 μg经10% SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electro phoresis,SDS-PAGE)电泳后,转膜,5%脱脂奶粉室温封闭1 h,一抗(GAPDH稀释1 000倍、VEGF稀释200倍、KLF4稀释1 000倍、ADAMTS1稀释500倍,4 ℃孵育过夜,含吐温-20的Tris盐缓冲液(tris buffered saline with tween-20,TBST)洗3次,加入HRP标记的二抗37 ℃孵育1 h,ECL发光法显色[16]。使用BandScan分析胶片灰度值。
2.8 统计学方法
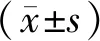
3 结果
3.1 TMP对H22肝癌小鼠肿瘤生长的影响
H22肝癌细胞接种后第4~5天起可触及接种时的肿瘤块。用药后低、高剂量组小鼠瘤重与模型组比较显著降低(P<0.01)。低、高剂量组和阳性对照组小鼠的抑瘤率分别为:31.60%、53.53%、53.27%,见表1。
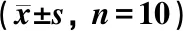
表1 川芎嗪(TMP)对H22肝癌小鼠肿瘤质量及肿瘤抑制率的影响
3.2 TMP对H22肝癌小鼠血清转氨酶的影响
图1结果显示:与模型组比较,低、高剂量组小鼠血清ALT、AST水平显著下降(P<0.01),阳性对照组小鼠血清ALT、AST水平显著上升(P<0.01)。与阳性对照组比较,低、高剂量组小鼠血清ALT、AST水平均下降,其中低剂量组小鼠血清ALT、AST水平下降更明显(P<0.01)。该结果表明,TMP对H22肝癌小鼠血清ALT、AST的升高有明显抑制作用,能改善H22肝癌小鼠肝功能。
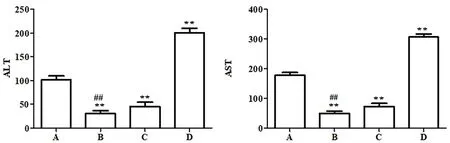
注:与模型组比较**P<0.01;与阳性对照组比较##P<0.01;谷丙转氨酶(ALT),门冬氨酸转氨酶(AST);A.模型组;B.低剂量组;C.高剂量组;D.阳性对照组
3.3 TMP对H22肝癌小鼠肿瘤组织病理学的影响
图2结果显示:模型组(A)小鼠的肿瘤组织呈典型的柱状、腺管样癌巢结构,肝癌细胞排列成索状、团块状,同时伴有炎细胞的浸润。低、高剂量组(B、C)和阳性对照组(D)小鼠的癌巢数量明显减少,出现不同程度的细胞坏死和胞核溶解现象,部分细胞呈空泡状改变。

A.模型组;B.低剂量组;C.高剂量组;D.阳性对照组
3.4 TMP对H22肝癌小鼠肿瘤血管生成的影响
通过免疫组化检测小鼠肿瘤组织CD34的表达,观察其微血管生成,图3结果显示,模型组(A)小鼠肿瘤组织的CD34阳性表达率高,可见大量微血管生成,与模型组比较,低、高剂量组(B、C)和阳性对照组(D)小鼠肿瘤组织的微血管生成有一定程度减少。该结果表明,TMP可抑制H22肝癌小鼠肿瘤组织的微血管生成。

A.模型组;B.低剂量组;C.高剂量组;D.阳性对照组
3.5 TMP对H22肝癌小鼠肿瘤组织血管生成相关蛋白表达的影响
图4结果显示,与模型组(1)比较,低、高剂量组(2、3)小鼠肿瘤组织血管生成相关蛋白KLF4蛋白的表达显著升高(P<0.01),VEGF的表达显著降低(P<0.01),ADAMTS1的表达显著升高(P<0.01),抑制血管生成作用明显。
4 讨论
TMP具有抗氧化、抗纤维化、改善心血管患者血液流变等功效。研究报道TMP在消化系统肿瘤的增殖、凋亡、侵袭、转移、血管生成、逆转耐药及调节免疫等方面均有一定的作用[17]。本研究发现低、高剂量组小鼠的瘤体大小和肿瘤质量显著低于模型组,表明TMP对H22肝癌小鼠的肿瘤生长有一定的抑制作用,同时TMP有降低H22肝癌小鼠血清AST和ALT的水平,改善H22肝癌小鼠肝功能的作用,并可抑制低、高剂量组小鼠肿瘤组织微血管的生成。
KLF4为肿瘤发展过程中的关键转录因子,能抑制肿瘤发生,它已经被证明作为肿瘤抑制基因抑制肿瘤细胞增殖[18]。ADAMTS1能抑制VEGF诱导的血管生成[19],其主要功能是通过TSPl型基序结合到血管内皮生长因子的受体结合区,阻断血管内皮生长因子受体的磷酸化,而血管内皮生长因子受体的磷酸化是血管生成和内皮增殖的主要途径,因此ADAMTS1高表达将不利血管内皮增殖。ADAMTS1表达越高,肿瘤血管生成越少,ADAMTS1与肿瘤血管生成呈负相关。本实验中TMP可以增加血管生成相关蛋白KLF4和ADAMTS1在肿瘤组织中的表达,该作用随药物浓度的增加而增加,同时TMP显著抑制了VEGF在H22肝癌小鼠肿瘤组织中的表达,并且随着药物浓度的增加,其抑制作用也逐渐增强,从而抑制小鼠肿瘤血管生成,进而抑制小鼠肿瘤生长,这有可能是其抗肿瘤的作用机制之一。
综上所述,TMP具有抗肿瘤作用,能够抑制H22肝癌小鼠实体瘤的生长,其作用机制可能与其上调KLF4表达,进而下调VEGF表达并且上调ADAMTS1表达以减少血管生成,但具体机制仍需进一步讨论。该研究为TMP用于肝癌治疗提供了实验依据。

