湖泊红球藻等离子诱变及其高产虾青素藻株培养条件的优化
代容春 ,林荣华,何文锦,薛 婷,陈建楠,陈 菁,孙化淼
(1.福建师范大学生命科学学院,福建福州 350117;2.福建师范大学南方海洋研究院,福建福州 350117)
虾青素是一种具有超强抗氧化活性的类胡萝卜素含氧衍生物,应用于医药、化妆品、功能性食品、养殖业等多个领域,经济价值高[1-2]。天然虾青素主要是从水产品的加工废弃物、细菌和真菌及藻类中获得。水产品的加工废弃物中虾青素含量比较低,且因为提取过程较为复杂导致提取的成本较高,因此不宜作为大规模提取天然虾青素的原料[3]。细菌和真菌虽然繁殖速度快、培养成本低,但是菌体虾青素含量很低,并不适合作为虾青素的制备原料[3]。综合考虑,藻类被认为是提取天然虾青素最佳的原材料。其中湖泊红球藻(Haematococcus lacustris)是公认的生产天然虾青素的理想来源,是高价值的工业微藻[4-6]。湖泊红球藻是淡水单细胞绿藻,目前主要采用两步法诱导藻细胞积累虾青素,首先,营养生长阶段最大限度地获取生物量,藻体为绿色;其次,虾青素诱导阶段通过逆境条件诱导虾青素的大量积累,藻体逐渐转为红色。当前培养周期长、虾青素产量不高及藻种退化等问题直接影响湖泊红球藻的工业生产应用[7-8]。因此,选育优良的湖泊红球藻藻株、筛选湖泊红球藻最适宜的培养条件具有重要意义。
近年来,许多研究者在提高湖泊红球藻的生长性能和虾青素产量方面进行了探索并取得了一定的成果。如Khorshidi 等[9]利用静磁场(SMF)促进了湖泊红球藻的生长和虾青素产量的提高。Lee 等[10]通过引入“红细胞”接种体系(RCIS)并在培养基中添加FeSO4、NaCl 和NaHCO3等成分有效缩短了湖泊红球藻的培养周期。Zhu 等[11]用纳米气泡水(NBW)代替培养基中的蒸馏水使湖泊红球藻的生物量提高了44%。但迄今为止国内外对湖泊红球藻的相关研究主要集中在促进藻株生长及虾青素积累的培养条件方面[9-13],藻种改良上仅见LE-FEUVRE 等采用秋水仙碱对湖泊红球藻进行多倍体育种使虾青素产量提高了33%[14]。诱变育种是一种重要的育种方法,但在湖泊红球藻中的应用尚未见报道。因此,利用诱变育种技术改良现有湖泊红球藻藻种,选育优良的高产突变藻株势在必行。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变是一种新型的诱变育种手段,具有高效、突变速度快、环境友好等特点[15];与其它物理诱变方法相比,ARTP 具有放电均匀、活性粒子浓度高、操作简单、安全性好等优点[16]。因此,ARTP 已广泛应用于微生物、微藻、植物种子等材料,并取得良好的诱变效果。如采用ARTP 诱变褐球固氮菌(Azotobacter chroococcum)使固氮酶活性提高了101.72%[15],ARTP 诱变裂殖壶菌(Schizochytrium limacinum)使二十二碳六烯酸(DHA)产量提高了46.12%[16];小新月菱形藻(Nitzschia closteriumf.minutissima)和湛江等鞭金藻(Isochrysis zhangjiangensis)经ARTP 诱变后藻株生长速度和目标产物产量均有明显的提高[17-18];ARTP 辐照还促进了两色金鸡菊(Coreopsis tinctoriaNutt.)种子的萌发和幼苗的生长[19],促进了玉米(Zea maysL.)幼苗的生长[20]。本研究利用常压室温等离子体诱变仪对湖泊红球藻进行诱变,筛选生长快、虾青素产量高的突变藻株。诱变之后采用单因素实验及正交试验,优化湖泊红球藻高产藻株生长的光照强度、培养温度、培养基等培养条件,并进一步筛选积累虾青素的适宜高光照条件。高产藻株多次继代后,通过测定其营养生长阶段的藻细胞密度以及虾青素诱导阶段的虾青素产量,来观察高产突变藻株的表型和遗传稳定性。实验采用等离子诱变结合培养条件的优化使湖泊红球藻能更高效地增加生物量和积累虾青素,结果对选育湖泊红球藻产虾青素工业藻株具有现实意义,对其他藻类的育种具有一定的参考价值。
1 材料与方法
1.1 材料与仪器
湖泊红球藻(Haematococcus lacustris)藻种H5武汉水生所,培养条件:BBM 培养基[21]、温度20 ℃、光照强度2000 lx、光暗比12 h:12 h;培养基各组成成分药品 分析纯,国药集团化学试剂有限公司;PCR 体系反应物、DNA Marker TaKaRa 公司;鲁哥氏碘液 生工生物工程(上海)股份有限公司;虾青素标准品、二氯甲烷 色谱级,上海阿拉丁生化科技股份有限公司;甲醇 色谱级,德国默克公司。
ARTP-ⅡS 常压室温等离子体诱变仪 无锡源清天木生物科技有限公司;5424R 高速离心机 德国艾本德股份有限公司;lifeECO PCR 仪 Gene Company Limited;SMART 光学显微镜 重庆奥特光学仪器有限责任公司;JXFSTPRP-64 全自动样品快速研磨仪 上海净信实业发展有限公司;LJG-12 真空冷冻干燥机 北京松源华兴科技发展有限公司;2695 高效液相色谱 沃特世科技上海有限公司。
1.2 实验方法
1.2.1 藻种的鉴定 藻种无菌纯化后扩大培养,取适量藻液,8000 r/min 离心5 min 后收集藻泥,CTAB法[22]提取藻细胞DNA,利用通用引物TGF、TGR(由生工生物公司合成)扩增18S rDNA,PCR 产物经琼脂糖凝胶电泳纯化,阳性条带切胶回收后送生工生物公司进行基因测序。使用NCBI 对18S rDNA 基因序列进行比对分析。
1.2.2 等离子诱变 参考潘艳飞[22]的实验方法。对数生长期的湖泊红球藻稀释100 倍后取200 µL 于载玻片上,均匀涂开,使用ARTP 诱变仪进行诱变。照射距离2 mm,气体流速10 L/min,输入功率:240 W或400 W,照射时间:30、60、90、120、150、180、210 s 7 个梯度,以照射时间0 s 为对照。诱变完成后,将载玻片上的藻液全部转移至离心管中,并用200 µL 培养基冲洗载玻片,一并转入离心管,黑暗静置3 h 后取200 µL 藻液均匀涂布到固体平板上。每个处理重复3 次。固体平板培养条件:BBM 琼脂培养基、光照强度2000 lx、培养温度20 ℃。21 d 后统计不同功率、不同诱变时间下的单藻落数量,计算致死率。致死率(%)=各处理单藻落数量/对照单藻落数量×100。确定致死率为90%左右的输入功率和照射时间,重新多次进行诱变实验。
1.2.3 高产藻株的筛选 突变株的初筛,待固体培养基上长出单藻落,将平板移至8000 lx 的高光照下进行培养,培养温度20 ℃,一定时间后挑选体积较大且颜色较红的单藻落培养于24 孔板,待藻细胞繁殖较多时进行扩大培养。
突变株的复筛,将通过初筛获得的藻株扩大培养至对数期,在光学显微镜下进行藻细胞准确计数,5000 r/min 离心5 min 收集藻细胞,以1.2×105cell/mL的起始藻细胞密度进行生长培养,培养条件:BBM 培养基、光照强度2000 lx、温度20 ℃,每天摇瓶2 次,培养14 d 后,再次进行藻细胞准确计数。计数方法:取藻液1 mL,加入鲁哥氏碘液10 µL 固定藻细胞,使用血球计数板进行计数,每个样品计数5 次,取平均值。筛选生长快速的藻株。将这些藻株的藻液转移至胁迫培养条件(光照强度8000 lx)下继续培养,培养温度20 ℃,21 d 后取样测定虾青素含量,计算藻株的虾青素产量。未经诱变的野生型藻株作为对照,选择生长快、虾青素产量高的突变株作为高产藻株进行后续的实验。
虾青素含量的测定方法:参考国标GB/T 31520-2015 红球藻中虾青素的测定,采用高效液相色谱法[23]。色谱柱为Sun Fire C18 250×4.6/5 µm(18600 2560),色谱条件:检测器为PDA,流动相为甲醇:去离子水=95:5,流速1 mL/min,检测波长474 nm,进样量20 µL,柱温25 ℃。用虾青素标准品制作标准曲线,得线性回归方程为y=200815x+1036(R2=0.9992),线性范围1~20 µg/mL,通过标准曲线计算湖泊红球藻的虾青素含量。
1.2.4 高产藻株培养条件的优化
1.2.4.1 高产藻株营养生长阶段培养条件的优化以藻细胞密度为指标对影响湖泊红球藻生长的因子光照强度、培养温度、培养基进行单因素实验。在温度20 ℃和BBM 培养基的条件下,分别以1000、1500、2000、2500、3000 lx 为光照强度,确定湖泊红球藻生长的适宜光照强度;在光照强度2000 lx 和BBM 培养基的条件下,分别以15、20、25、30、35 ℃为培养温度,确定湖泊红球藻生长的适宜培养温度;在光照强度2000 lx 和温度20 ℃的条件下,分别以MCM[21]、BBM、BG11[21]、TAP[24]、HS[24]为培养基,确定湖泊红球藻生长的适宜培养基。
采用L9(34)正交试验,依据单因素实验结果分别设计因素光照强度、培养温度、培养基的水平值(见表1),筛选湖泊红球藻高产藻株营养生长阶段的最适培养条件。
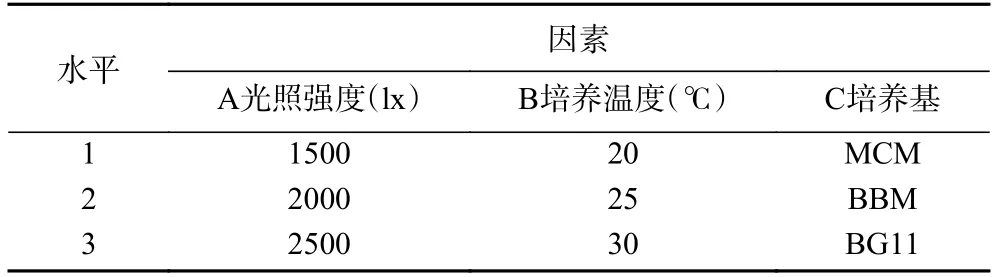
表1 正交试验因素水平表Table 1 Table of orthogonal experimental factor levels
按上述实验配制新鲜培养基于锥形瓶中,每瓶100 mL,各3 瓶。取预培养(培养条件同复筛实验)至对数期的高产藻株藻液,5000 r/min 离心5 min 收集藻细胞,加入培养基中,使藻细胞培养起始密度为1.2×105cell/mL,按单因素实验和正交试验的培养条件进行静置培养,每天摇瓶2 次,培养14 d 后,再次进行藻细胞准确计数。计算湖泊红球藻生长率。生长率(倍数)=[培养后细胞密度(cell/mL)-培养前细胞密度(cell/mL)]/培养前细胞密度(cell/mL)。
1.2.4.2 高产藻株虾青素诱导阶段光照强度的筛选高光照胁迫中,设置7000、8000、9000、10000、11000、12000 lx 6 个光照强度的梯度,观察不同光照强度对湖泊红球藻高产藻株虾青素积累的影响。取营养生长阶段在上述优化的培养条件下同步培养至对数期末的藻液放置于各高光照胁迫下,培养温度25 ℃,每个胁迫处理3 瓶,培养21 d 后取样品进行虾青素含量检测,并计算藻株的虾青素产量。
1.2.5 高产藻株多次继代后表型的观察测定 高产藻株营养生长阶段细胞密度的测定:在优化的培养条件下(光照强度2000 lx、温度25 ℃、培养基BG11)多次继代后,采用起始细胞密度1.2×105cell/mL 进行生长培养,分别在培养2、4、6、8、10、12、14、16 d后测定培养液中的藻细胞密度。部分藻液培养14 d后用于虾青素诱导阶段的培养测定。
高产藻株虾青素诱导阶段虾青素产量的测定:采用上述筛选后的光照条件(光照强度10000 lx)培养湖泊红球藻高产藻株,每3 d 取适量的藻液,8000 r/min离心10 min 后去上清,藻泥真空冷冻至完全干燥。当湖泊红球藻由绿色转为红色时结束取样,测定样品的虾青素含量,计算藻株的虾青素产量。
1.3 数据处理
采用SPSS 25.0 软件进行方差分析,数据以平均值±标准差表示。通过Duncan 法进行差异显著性检验,结果用标记字母法表示。利用Excel 软件制作柱形图和折线图。所有实验均重复进行3 次。
2 结果与分析
2.1 18S rDNA 序列的克隆、测序与比对
18S rDNA 序列在NCBI 中进行BLAST 同源性分析,结果显示该序列与Gen Bank 中登录号为KY364700.1 与LC013980.1 的Haematococcus lacustris的序列相似度分别为99.89%和99.66%,确认该藻株为湖泊红球藻(Haematococcus lacustris)。
2.2 等离子诱变条件的确定
ARTP 产生的等离子活性粒子可以穿透细胞壁进入细胞内,造成遗传物质损伤,引发细胞修复,从而实现细胞的快速诱变[25-26]。由图1 可以看出,ARTP输入功率240 W 和400 W 均会导致湖泊红球藻不同程度的损伤死亡,随着诱变时间的延长,致死率不断提高;功率240 W 诱变时间150 s 致死率为89.7%,功率400 W 诱变时间120 s 致死率为90.5%;诱变时间过长则会导致藻细胞全部死亡,功率240 W 诱变时间210 s 以上或功率400 W 诱变时间180 s 以上致死率均为100%。选择90%左右的致死率作为诱变的条件,因为此时,大部分细胞死亡,少部分的细胞可能通过自身修复引起细胞基因和表型的改变。因此,湖泊红球藻等离子诱变的适宜条件是功率240 W、诱变时间150 s 或功率400 W、诱变时间120 s。后续诱变实验中约半数诱变处理采用功率240 W、诱变时间150 s 的条件,其余采用功率400 W、诱变时间120 s 的条件。
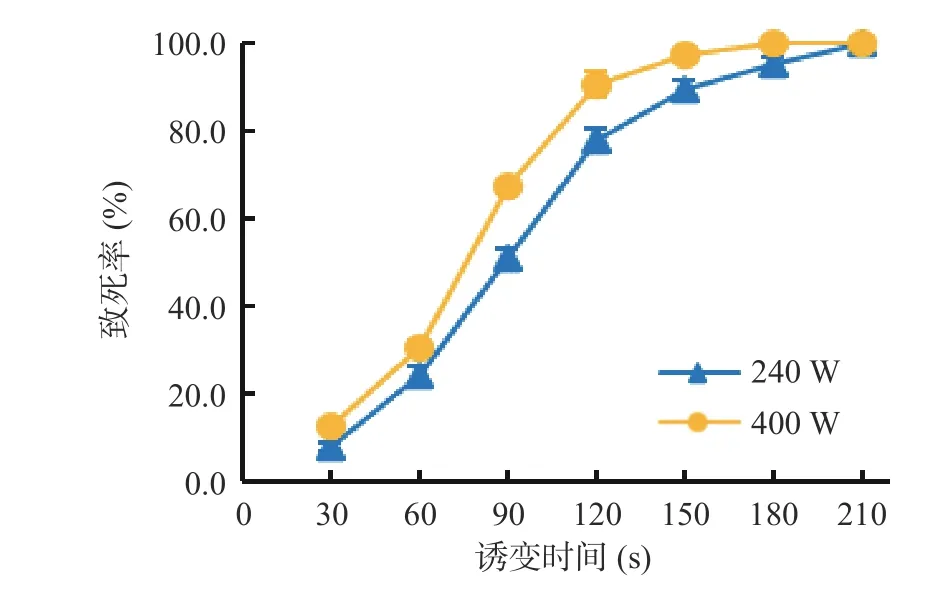
图1 ARTP 输入功率与诱变时间对湖泊红球藻致死率的影响Fig.1 Effects of input power and mutation time of ARTP on the lethal rate of Haematococcus lacustris
2.3 高产藻株的筛选
2.3.1 高产藻株的初筛 未经诱变的湖泊红球藻在固体平板上于2000 lx 光照下培养28 d 后,藻落数量多、分布均匀、大小较为一致(图2a)。经过ARTP适当诱变处理后大部分藻细胞死亡,相同条件培养后长出的藻落数量少,但有些单藻落长势良好;继续在8000 lx 的高光强下培养28 d,出现一些体积大、颜色红的单藻落(图2b),挑选培养于24 孔板,一定时间后转移至锥形瓶中进行扩大培养。本实验经过初筛获得了68 株突变藻株进一步扩大培养。
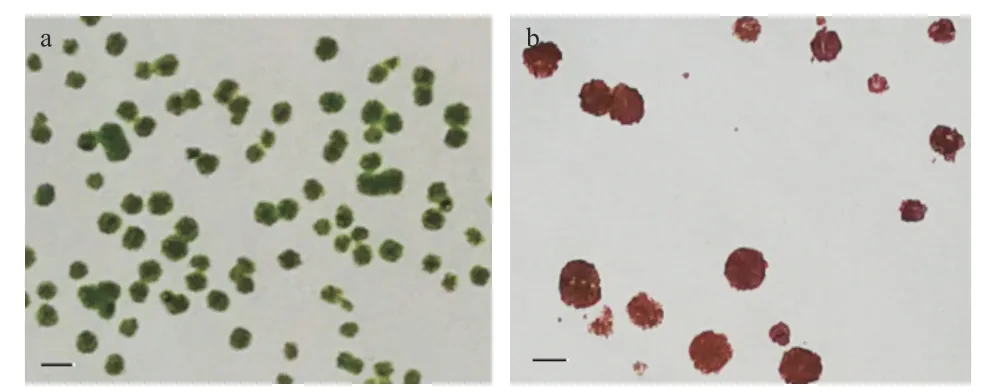
图2 湖泊红球藻在固体平板上的生长情况Fig.2 Growth of Haematococcus lacustris on solid plate
2.3.2 高产藻株的复筛 如图3,经过初筛获得的68 株突变藻株及野生型藻株通过营养生长阶段培养14 d 后,野生型藻细胞密度为5.1×105cell/mL,测定得到细胞密度提高10%以上的突变藻株有21 株,将此21 株藻株按实验先后顺序进行编号,其中编号为HP3、HP5 和HP9 的藻细胞密度最高,均为6.4×105cell/mL,比野生型提高了25.5%。
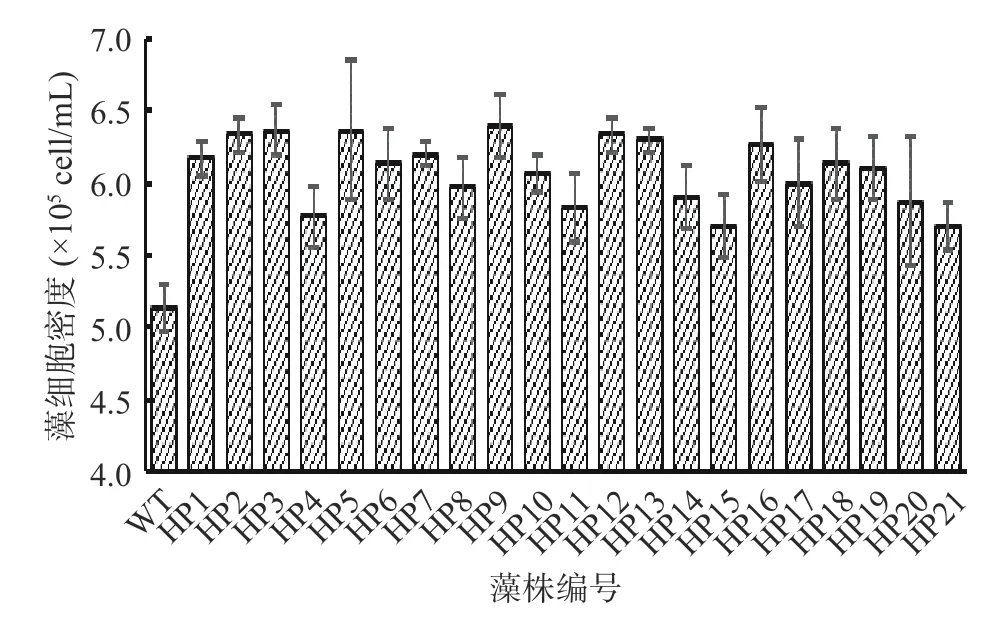
图3 筛选获得的生长较快的突变藻株的细胞密度Fig.3 Cell density of the mutant strains with fast growth was obtained
如图4,野生型藻株再经过虾青素诱导阶段培养21 d 后虾青素产量为16.224 mg/L。上述经过筛选获得的生长较快的21 株诱变藻株经过胁迫培养后,测定得到虾青素产量提高40%以上的有11 株,其中编号为HP2、HP3 和HP9 的3 株产量最高,分别为25.192、26.212、25.004 mg/L,虾青素产量分别提高了55.3%、61.6%和54.1%。因此,选择生长最快、虾青素产量最高的突变株HP3 作为高产藻株,进行后续藻株培养条件的优化。
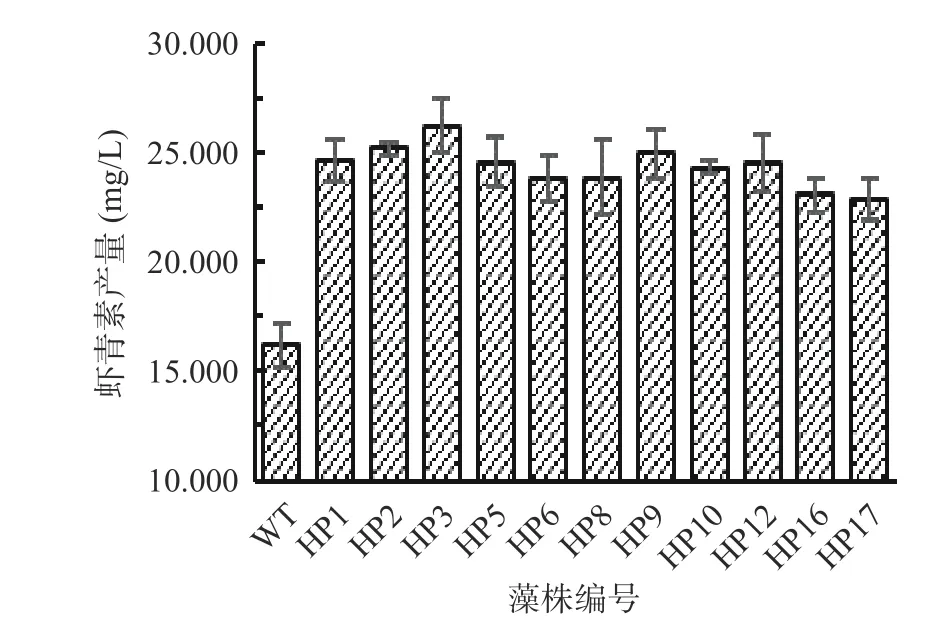
图4 筛选获得的较高产突变藻株的虾青素产量Fig.4 Astaxanthin yield of the mutant strains with high yield was obtained
2.4 高产藻株培养条件的优化
2.4.1 高产藻株营养生长阶段培养条件的优化
2.4.1.1 单因素实验结果 由图5 可知,光照强度对湖泊红球藻生长的影响较大。当光照强度从1000 lx增强到2000 lx 时,藻细胞生长率显著增大;当光照强度为2000 lx 时,藻细胞生长率达最大值,为4.3倍;当光照强度继续增强从2000 lx 增加到3000 lx时,藻细胞生长率显著减小。光照强弱可直接影响湖泊红球藻的光合作用从而影响培养体系中的藻细胞数量,过高和过低的光照强度都不利于藻的生长。因此,高产藻株HP3 的适宜光照强度为2000 lx。
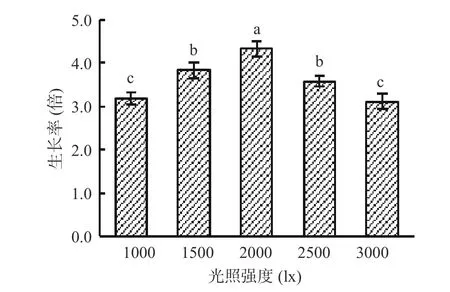
图5 光照强度对藻株HP3 生长的影响Fig.5 Effect of light intensity on the growth of HP3
由图6 可知,在培养温度为15~25 ℃时,藻细胞生长率随温度升高而增大;在培养温度为25~35 ℃时,藻细胞生长率随温度升高而减小。当培养温度为25 ℃时,藻细胞生长率达最大值,为4.6 倍。因此,湖泊红球藻高产藻株HP3 的适宜培养温度为25 ℃。
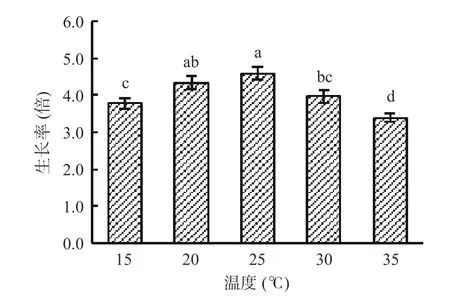
图6 温度对藻株HP3 生长的影响Fig.6 Effect of temperature on the growth of HP3
MCM、BBM、BG11、TAP、HS 是常用的藻类培养基,MCM、BBM、BG11 培养基为藻类生长提供NO3-作为N 源[21],TAP、HS 培养基为藻类生长提供NH4+作为N 源[24]。王晓丹等[27]的研究表明,以NaNO3为氮源培养雨生红球藻生长好于以NH4Cl为氮源。由图7 可知,在培养基MCM、BBM、BG11 中,湖泊红球藻生长较好,其中在BBM 培养基中藻细胞生长率最高。在培养基TAP、HS 中,湖泊红球藻生长较差,细胞生长率低,这可能与培养基的N 源种类有关。因此,湖泊红球藻高产藻株HP3 的适宜培养基为BBM 培养基。
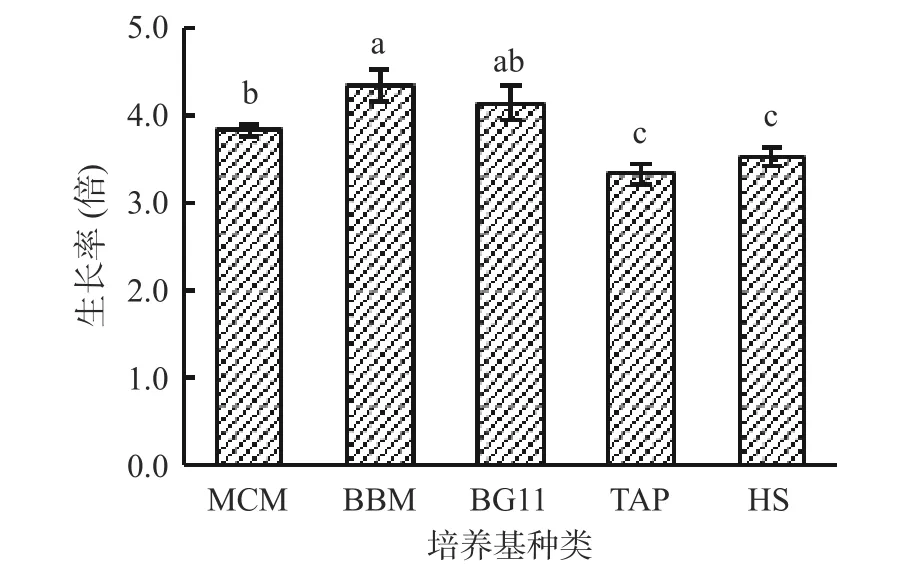
图7 培养基对藻株HP3 生长的影响Fig.7 Effect of culture-medium on the growth of HP3
2.4.1.2 正交试验结果 正交试验结果见表2。由每个因素的3 个K 值大小比较得出,各因素的最佳水平为光照强度2000 lx、温度25 ℃、培养基BG11,此组合正是5 号处理(A2B2C3)。由极差分析可以看出,各因素的主次顺序为:A>C>B,在三个因素中,光照强度对湖泊红球藻的生长影响最大。优化前的培养条件为4 号处理(A2B1C2),即光照强度2000 lx、温度20 ℃、培养基BBM,培养条件优化后藻细胞终密度提高了14.3%。
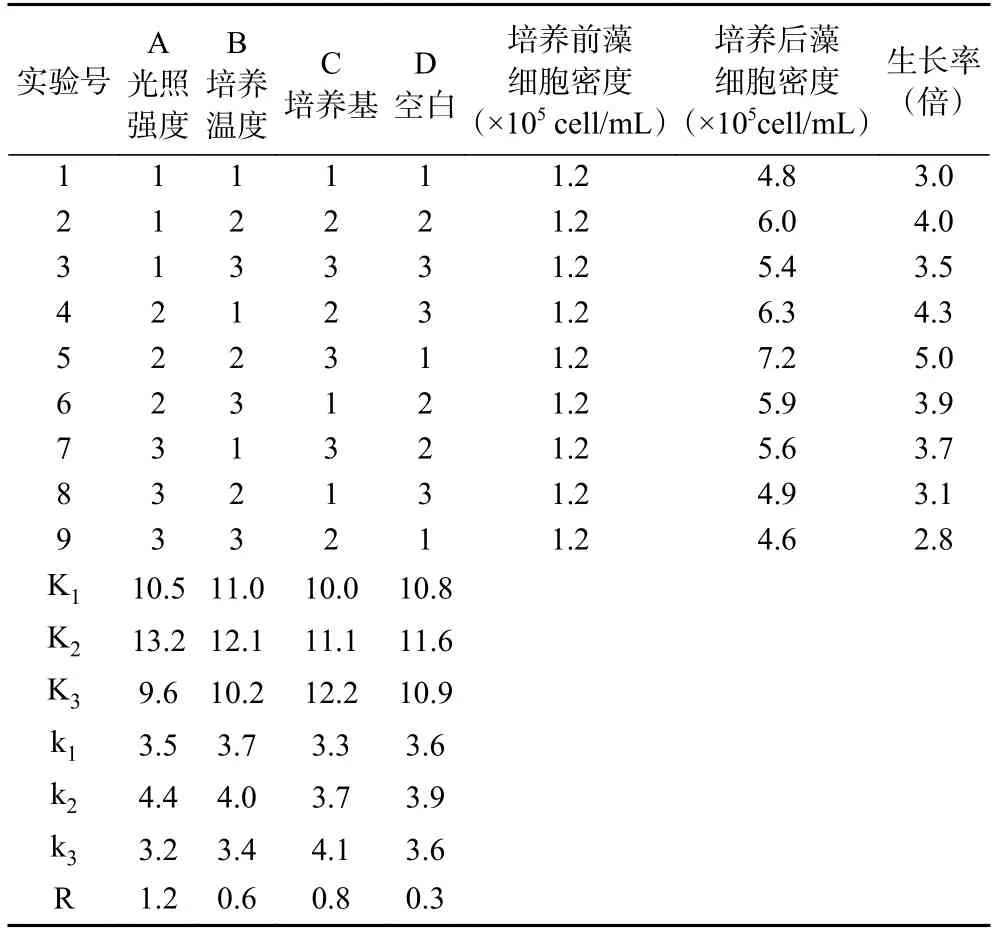
表2 L9(34)正交试验结果表Table 2 Results of the orthogonal experiment L9 (34)
2.4.2 高产藻株虾青素诱导阶段光照强度的筛选适宜的高光照条件是提高红球藻虾青素积累的重要方法[28-30]。由图8 可以看出,高光胁迫能够促进湖泊红球藻虾青素的积累,当光照强度为7000 lx 时,虾青素产量为27.353 mg/L;光照强度继续增强,虾青素积累量也随之增加;当光照强度达10000 lx 时,虾青素产量达最高,为31.264 mg/L;当光照强度超过10000 lx 时,虾青素积累量反而减少,可能原因是光照太强引起活性氧产生过多导致藻细胞失活[12]。可见,10000 lx 是湖泊红球藻高产藻株虾青素诱导阶段的最适光照强度,虾青素产量较培养条件优化前(26.212 mg/L)提高了19.3%。
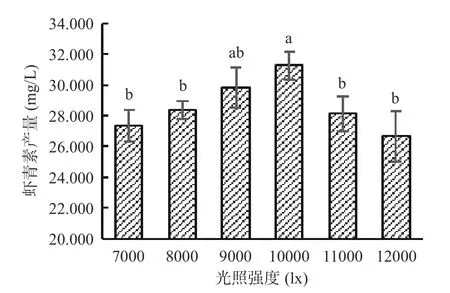
图8 光照强度对藻株HP3 虾青素积累的影响Fig.8 Effect of light intensity on astaxanthin accumulation in HP3
2.5 高产藻株多次继代后表型的观察测定
湖泊红球藻高产藻株多次继代后生长良好。由图9 可以看出,以1.2×105cell/mL 为起始培养密度,湖泊红球藻能快速进入对数生长期,培养12 d 即达对数生长期末期,培养14 d 后藻细胞密度达7.1×105cell/mL,为初始培养时的5.92 倍。说明HP3 藻株接种后适应期短,能快速恢复生长,呈现很好的分裂生长能力。
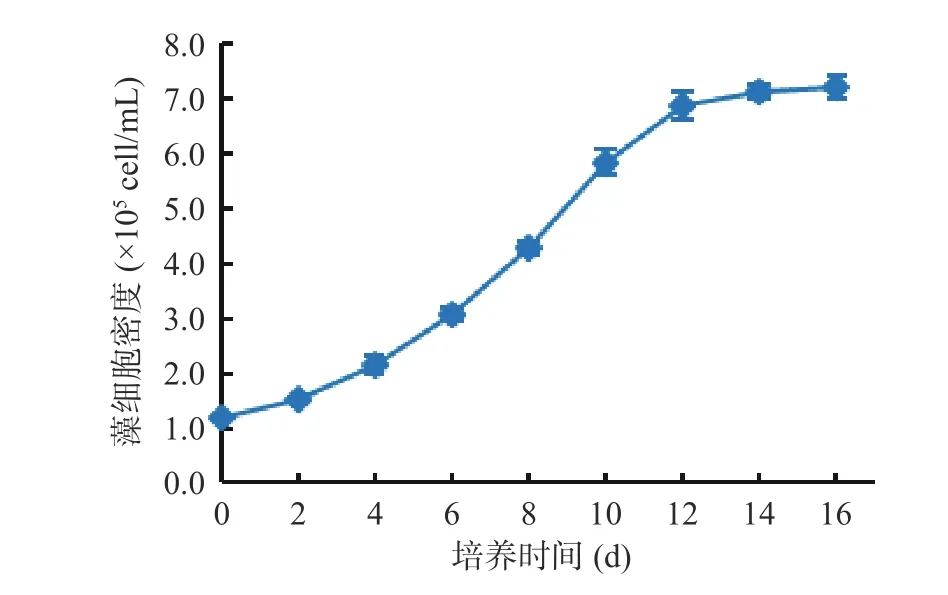
图9 藻株HP3 营养生长阶段细胞密度的变化Fig.9 Changes in cell density in vegetative growth stage of HP3
由图10 可以看出,湖泊红球藻高光照胁迫处理之前虾青素产量很低,仅为0.546 mg/L,随着胁迫时间的延长,虾青素产量逐渐增高,到21 d 时达到最大值(30.691 mg/L),为初始培养时的56.21 倍。说明HP3 藻株在转移至高光照前细胞状态好,因此藻体虾青素含量低,而后在高光照的诱导下不断合成并累积虾青素。
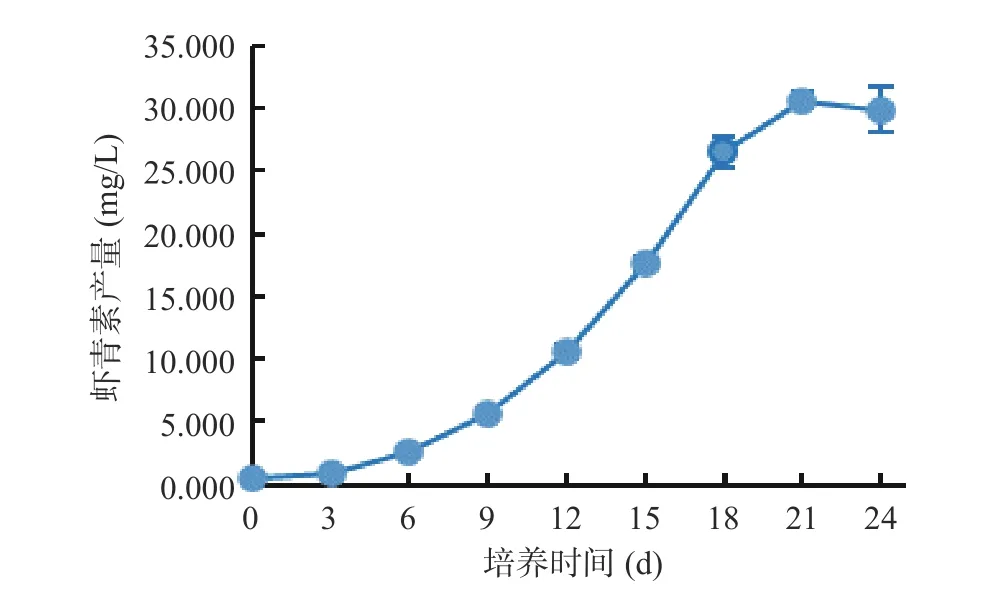
图10 藻株HP3 虾青素诱导阶段虾青素产量的变化Fig.10 Changes in astaxanthin yield in astaxanthin induction stage of HP3
综上,湖泊红球藻突变藻株HP3 在优化的培养条件下多次继代后生长快、虾青素产量高,表型好;营养生长阶段培养14 d 后藻细胞密度和虾青素诱导阶段培养21 d 后虾青素产量均与初代培养相当,说明遗传稳定性好。此等离子诱变筛选的湖泊红球藻高产藻株可为后续的研究提供很好的种质资源,为湖泊红球藻产虾青素的工业育种打下了实验基础。
3 结论
藻类在人类生活及经济发展中起着重要的作用,藻类养殖中种质是养殖质量和产量的关键所在,藻类诱变育种是人工获得优良品系或品种的重要手段。本研究使用ARTP 诱变仪对湖泊红球藻进行等离子诱变,确定了等离子诱变的适宜条件是功率240 W、诱变时间150 s 或功率400 W、诱变时间120 s。通过初筛和复筛获得了生长最快、虾青素产量最高的突变藻株HP3,培养后其藻细胞密度为6.4×105cell/mL,较出发株提高了25.5%;虾青素产量为26.212 mg/L,较出发株提高了61.6%。湖泊红球藻的诱变育种是一项有意义的长期的系统工程,在下一步的研究中可以采用复合诱变方法以提高诱变频率,扩大诱变谱。可以尝试使用ARTP 重复处理、ARTP+紫外线、ARTP+化学诱变等复合诱变方法对湖泊红球藻进行诱变,以获取更高价值的突变藻株。
本研究对高产突变藻株HP3 进行培养条件的优化,确定其营养生长阶段的适宜培养条件为光照强度2000 lx、温度25 ℃、培养基BG11;虾青素诱导阶段适宜的光照强度为10000 lx。在此条件下营养生长阶段培养14 d 后藻细胞密度达7.2×105cell/mL,较野生型藻株提高了41.2%;虾青素诱导阶段培养21 d 后虾青素产量达31.264 mg/L,较野生型藻株提高了92.7%。实验采用等离子诱变结合培养条件的优化使湖泊红球藻的生物量显著增加,虾青素产量大幅提高,结果对选育湖泊红球藻产虾青素工业藻株及其实际应用具有较大意义。

