异硫氰酸烯丙酯对产气荚膜梭菌的抑菌作用及在熟猪肉糜中的应用
黎琳莹,林以琳,温耀升,廖彩虎, ,余以刚,
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.韶关学院英东食品学院,广东韶关 512005)
产气荚膜梭菌(Clostridium perfringens,C.perfringens)是肉类食品中最常见的食源性致病菌之一,能形成芽孢和产生多种毒素,对人类和其它动物具有致病性[1-2]。目前,由C.perfringens引起的食物中毒仍是一个严峻的公共卫生问题,消费者食用了被C.perfringens污染的食品(一般大于6 log CFU/g)后会引发腹部绞痛、腹泻等症状,严重时可能导致死亡[3]。因此,有效控制肉制品中的C.perfringens是食品工业领域中亟待解决的问题。
近年来,植物精油由于具有来源广泛、广谱抑菌活性、天然低毒等优势而被逐渐开发应用于食品防腐[4-5]。已有研究表明,从罗勒、迷迭香、百里香和茴香中提取的精油对C.perfringens均具有抑菌效应[6],但植物精油对C.perfringens的抑菌机制尚未深入研究。异硫氰酸烯丙酯(Allyl isothiocyanate,AITC)是芥末精油的主要活性成分,广泛存在于十字花科植物,对金黄色葡萄球菌[7]、大肠杆菌[7-8]、单增李斯特菌[9-10]和沙门氏菌[8,11]等多种病原微生物均具有很强的抑菌效应。Alanazi 等[12]研究了四种植物精油成分(肉桂醛、丁香酚、香芹酚和AITC)对C.perfringens芽孢的萌发、二次生长以及营养细胞的生长抑制作用,结果表明:在实验室培养基体系中,四种精油成分均能抑制C.perfringens芽孢的二次生长和营养细胞的生长,其中香芹酚和AITC 的抑制效果最佳;但将精油应用于熟制鸡肉基质时,只有AITC(添加量为0.5%~2.0%)能抑制C.perfringens的生长,而香芹酚即使添加量达到5%也无法抑制C.perfringens的生长。由此可见,AITC 在抑制肉制品中的C.perfringens方面具有广阔的应用前景,然而其对C.perfringens的抑菌机制尚不清楚。因此,本研究尝试从细胞膜损伤和蛋白质代谢两个方面来探究AITC 对C.perfringens的抑菌作用方式,为有效利用AITC 作为食品工业的天然抑菌剂提供依据。
1 材料与方法
1.1 材料与仪器
C.perfringensCICC24751 由华南理工大学食品科学与工程学院食品安全与检测实验室保藏;生鲜猪瘦肉 购于广州市盒马鲜生超市;AITC(≥99%)山东西亚化学有限公司;液体硫乙醇酸盐(Fluid thiolglycollate,FTG)培养基、胰胨-亚硫酸盐-环丝氨酸(Tryptose sulfite cycloserine,TSC)琼脂基础培养基 北京陆桥技术股份有限公司;吐温80(食品级)郑州欧尼嘉商贸有限公司;戊二醛固定液(2.5%)上海麦克林生化科技有限公司;碘化丙啶(Propidium iodide,PI)染液 上海阿拉丁生化科技股份有限公司;超微量总ATP 酶试剂盒、总蛋白定量试剂盒 南京建成生物工程研究所。
Ⅱ级A2 型生物安全柜 赛默飞世尔(上海)仪器有限公司;LRH-250A-Ⅱ生化培养箱 韶关泰宏医疗器械有限公司;Cytation5 型多功能酶标仪 美国Bio Tek 公司;Phenom Pro 扫描电子显微镜(Scanning electron microscopy,SEM)荷兰Phenom 公司;Leica DMi8 倒置荧光显微镜 德国Leica 公司;GelDoc XR+凝胶成像分析仪 美国Bio-rad 公司;Scientz-IID 型超声波细胞粉碎机 宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1C.perfringens悬液的制备 将保存在-80 ℃瓷珠管中的瓷珠转移至含有10 mL FTG 培养基的试管中,于37 ℃厌氧培养过夜;将所得培养物用接种环沾取少量穿刺于含有10 mL TSC 培养基中,于37 ℃厌氧培养过夜后保存在4 ℃。在每次实验前,用接种环挑取穿刺管中少量黑色菌落至含有10 mL FTG 培养基的试管中,于37 ℃厌氧培养至稳定期(~1×108CFU/mL),用无菌FTG 培养基或PBS 溶液进行适当稀释,得到所需菌体浓度并用于后续实验。
1.2.2 AITC 对C.perfringens最小抑菌浓度(Minimum inhibition concentration,MIC)的测定 采用二倍稀释法测定AITC 对C.perfringens的MIC[13]。将AITC 溶于10%(m/v)的吐温-水溶液中,配制成40 μL/mL 母液;在各无菌试管中加入1 mL FTG 培养基,加入1 mL 稀释的AITC 溶液,充分混匀后吸取1 mL 混合液移至下一试管,以此类推,得到AITC浓度分别为0.4000、0.2000、0.1000、0.0500、0.0250、0.0125 μL/mL 的系列培养体系(编号为1~6)。对照组不含AITC,以等量的吐温-80 溶液代替(编号为7)。随后向各试管中加入1 mL 菌悬液(~1×107CFU/mL),将上述试管混合均匀后,置于37 ℃培养箱中厌氧培养24 h。使用酶标仪测定各组试管中菌液的OD600nm值,无明显细菌生长的最低AITC 浓度即为MIC。
1.2.3 AITC 对C.perfringens生长曲线的影响 参考Wu 等[14]的方法稍作修改以评估AITC 对C.perfringens生长曲线的影响。将AITC 溶液与菌悬液在试管中混合均匀(菌体终浓度~5×106CFU/mL,AITC的终浓度为1 MIC 和2 MIC),空白对照含相同浓度的无水乙醇。将上述试管置于37 ℃培养箱中厌氧孵育24 h,每2 h 取样测定OD600nm值以监测细菌生长情况。
1.2.4 AITC 对C.perfringens细胞形态的影响 参考Luo 等[15]的方法探究AITC 对C.perfringens细胞形态的影响。将过夜培养的菌悬液离心(8000 r/min,4 ℃,5 min,后续离心条件一致),弃去上清,用0.01 mol/L 磷酸盐缓冲液(Phosphate buffer solution,PBS,pH7.4)洗涤两次并重悬于试管中,加入AITC溶液使其终浓度分别为1 MIC、2 MIC 和 4 MIC。对照组试管中不添加AITC。将上述试管置于37 ℃培养箱中厌氧孵育8 h 后,将样品离心,用PBS 洗涤两次并重悬于2.5%(v/v)戊二醛溶液中,置于4 ℃下过夜固定。对固定过的样品进行洗涤,随后用不同体积分数(30%、50%、70%、90%、100%)的乙醇水溶液进一步梯度脱水,每次15 min,最后重悬于无水乙醇中。取2 μL 菌悬液滴于盖玻片,待其自然风干后进行喷金处理,在SEM 下观察细菌形态。
1.2.5 AITC 对C.perfringens细胞膜完整性的影响按照1.2.4 所述的方法制备菌悬液并加入AITC溶液,得到AITC 终浓度分别为1 MIC、2 MIC 和 4 MIC 的样品,在37 ℃条件下厌氧处理8 h 后,用生理盐水清洗两次,加入10 μg/mL 的PI 染液,室温下避光染色30 min 后用生理盐水清洗、重悬。随后,在荧光显微镜下观察细菌染色情况,并使用酶标仪测定样品的荧光光谱,设置激发波长为495 nm,发射光谱的扫描范围为550~700 nm,步幅为5 nm。
1.2.6 AITC 对C.perfringens蛋白质代谢的影响根据Cui 等[16]报道方法并进行适当修改,以评估AITC 对C.perfringens蛋白质代谢的影响。将过夜培养的菌悬液离心弃去上清,用PBS 洗涤后重悬于含有AITC 的PBS 体系中,得到AITC 终浓度分别为1/2 MIC、1 MIC、2 MIC 和4 MIC 的混合体系。对照组样品中不添加AITC。37 ℃厌氧孵育6 h后,用PBS 清洗菌体并重悬,取40 μL 菌液与10 μL 5×蛋白上样缓冲溶液混合均匀,沸水浴加热5 min,冷却至室温后离心,收集上清液。取10 μL 上清液加至预先制备好的凝胶(12%的分离胶和5%的浓缩胶)孔中进行SDS-PAGE 分析,电泳完成后对凝胶染色、脱色,最后使用凝胶成像仪对分离的蛋白条带进行拍照。
1.2.7 AITC 对C.perfringensATP 酶活性的影响参考Guo 等[17]的方法稍加修改,取过夜培养物离心弃去上清,用生理盐水洗涤、重悬,加入AITC 溶液使混合体系中AITC 的终浓度分别为1 MIC、2 MIC和4 MIC,置于37 ℃厌氧孵育6 h。随后,用生理盐水洗涤菌体两次并重悬,在冰水浴中进行超声处理(功率25%,每个循环超声4 s,间隔5 s,重复20 个循环),随后按照ATP 酶试剂盒的说明书进行定磷,通过计算得出不同处理组中C.perfringens的ATP酶活性。
1.2.8 AITC 对熟猪肉糜中C.perfringens的抑制效果 参考Zhu 等[13]的方法探究AITC 对熟猪肉糜中C.perfringens的抑制效果。将绞碎的猪肉糜进行高压灭菌以除去本体菌,分装成10 g/袋,分别接种C.perfringens并加入AITC 溶液,得到初始菌量约为1×104CFU/g,AITC 终浓度分别为0.1%、0.2%、0.3%、0.4%(v/m)的熟肉样品。对照组不含AITC,以等量的吐温-水溶液代替。将所有样品充分混匀之后进行真空包装,置于37 ℃条件下培养18 h。将肉糜与无菌生理盐水充分混匀,随后进行梯度稀释。取1 mL 合适梯度的样品与10 mL 无菌TSC 琼脂混合均匀,待其凝固后,再在平板表面倾注一层TSC 琼脂以覆盖下层琼脂,平板凝固后将培养皿的盖子敞开,在超净工作台中吹干1 h。将制备好的平板置于37 ℃培养箱中厌氧培养18~24 h,可见C.perfringens在TSC 琼脂平板上呈典型的黑色菌落,对平板进行菌落计数和结果计算[18]。
1.3 数据处理
本研究实验均重复三次取平均值。使用SPSS 22.0 软件进行单因素方差分析,确定均值之间的显著性差异(P<0.05),采用Origin 2017 软件绘图。
2 结果与分析
2.1 AITC 对C.perfringens 的MIC 及其对生长曲线的影响
AITC 对C.perfringens的MIC 测定结果如表1和图1A 所示。从图1A 可知,对照组及含有0.0500、0.0250、0.0125 μL/mL 的AITC 的FTG 试管呈现浑浊状态,并有气泡产生,表明有C.perfringens生长;而含有0.4000、0.2000、0.1000 μL/mL 的试管仍保持澄清,表明无C.perfringens生长。同时测定各试管对应的OD600nm值(表1),结果发现,用0.1000 μL/mL AITC 处理时,菌液的OD600nm值与更低浓度的AITC 处理组相比开始发生显著变化,表明AITC对C.perfringens的MIC 为0.1000 μL/mL。该结果与邓群等[19]报道AITC 对C.perfringens的MIC(800 μL/L)存在一定差异,可能是由于菌株、抑菌剂和培养条件等因素不同。为进一步研究AITC 对C.perfringens的抑菌效果,测定了不同浓度AITC 对C.perfringens生长曲线的影响。如图1B 所示,空白对照组中的C.perfringens在2~10 h 期间呈指数型增长,在12 h 时OD600nm值达到最大值,随后进入细菌生长的稳定期。然而,1 MIC 和2 MIC 处理组中C.perfringens的OD600nm值基本不变,表明AITC 能够有效抑制菌体的增殖。

图1 AITC 对C.perfringens 的MIC(A)及其对生长曲线(B)的影响Fig.1 MIC of AITC against C.perfringens (A) and the effect of AITC on the growth curve of C.perfringens (B)

表1 不同浓度AITC 处理C.perfringens 24 h 后的OD600nm 值Table 1 OD600nm values of C.perfringens after 24 h treatment with different concentrations of AITC
2.2 AITC 对C.perfringens 细胞微观形貌的影响
AITC 处理前后的C.perfringens的细胞形态如图2 所示。空白对照组的菌体呈完整、饱满的杆状结构,表面光滑圆润(图2A)。当用1 MIC 的AITC处理时,部分菌体的细胞膜出现褶皱和凹陷,甚至破裂(图2B);在2 MIC 处理组中,菌体的形态受损更为严重,其表面不再光滑,部分菌体被溶解(图2C);随着AITC 的浓度增至4 MIC,菌体的周围出现大量粘连物质,表明细胞膜完全受损,细胞内容物泄出(图2D)。Turgis 等[11]也观察到类似的现象,经芥末精油处理的大肠杆菌O157:H7 和伤寒沙门氏菌的细胞膜均受损,形态也发生改变;Wang 等[20]通过SEM发现异硫氰酸苄酯可以破坏蜡样芽孢杆菌和阪崎克罗诺肠杆菌的细胞膜。目前普遍认为,造成膜损伤的主要原因是植物精油的疏水性使其更易于与细胞膜相互作用,从而破坏细胞膜原有的结构[21-23]。因此,AITC 处理后细胞微观形态的变化,可能是与C.perfringens细胞膜损伤有关,且损伤程度与AITC 浓度具有高度的依赖性。

图2 AITC 对C.perfringens 细胞微观形貌的影响Fig.2 Effect of AITC on cell morphology of C.perfringens
2.3 AITC 对C.perfringens 细胞膜完整性的影响
当细胞膜被破坏时,PI 分子可以进入细胞并与核酸结合,在特定激发波长下能够发出红色荧光[24],故通过荧光显微镜观察和荧光光谱扫描研究AITC对C.perfringens细胞膜完整性的影响。图3A 显示对照组的C.perfringens几乎没有出现红色荧光,表明细胞膜完整性良好;经过AITC 处理后,观察到明显的红色荧光,且呈红光的细菌数量随着AITC 浓度的升高而增加(图3B~图3D)。通过测定各组荧光强度值,发现对照组和AITC 处理组(1 MIC、2 MIC和4 MIC)在620 nm 处的荧光强度分别为9952、10794、14046 和16309(图3E),与荧光显微镜观察到的结果相一致。以上结果表明,AITC 能够以剂量依赖性的方式破坏C.perfringens细胞膜完整性,该实验现象与Borges 等[25]的研究结果相似,这主要归因于异硫氰酸酯类化合物与细胞膜的相互作用,使得细胞膜通透性增强和完整性破坏,最终导致菌体死亡。
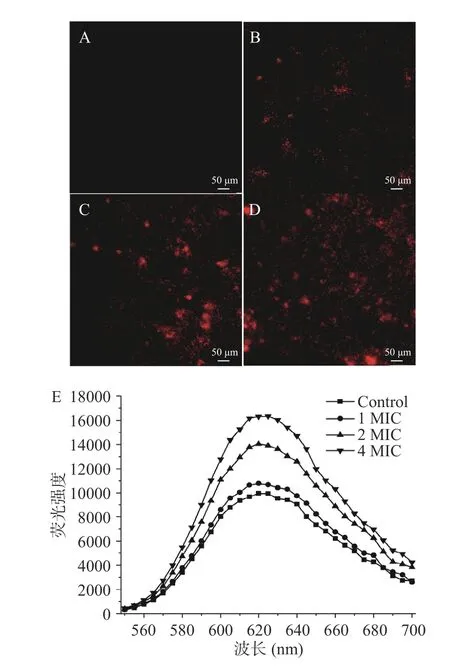
图3 AITC 对C.perfringens 细胞膜完整性的影响Fig.3 Effect of AITC treatment on the cell membrane integrity of C.perfringens
2.4 AITC 对C.perfringens 蛋白质代谢的影响
蛋白质是维持活细胞结构及其生存的基本物质,参与细菌代谢、物质合成等重要生化过程。采用SDS-PAGE 分析AITC 处理后C.perfringens蛋白条带的变化,结果如图4 所示。1/2 MIC 处理组的蛋白条带与对照组相比颜色变浅,而在1 MIC、2 MIC和4 MIC 处理组中部分条带几乎消失,表明AITC能够影响C.perfringens的蛋白质代谢过程。Wang等[26]使用生姜精油处理大肠杆菌和金黄色葡萄球菌的SDS-PAGE 图谱中也观察到类似的实验现象,其推测可能是精油处理增强了细胞膜的通透性,从而导致蛋白质泄漏。结合上述SEM 和PI 染色实验结果,推测AITC 对蛋白质的影响可能是两种作用机制:a.AITC 对细胞膜造成破坏可能促进蛋白外渗,进而降低细胞内的蛋白质含量;b.细菌本身蛋白质合成受到抑制或降解[27]。这些变化均对细胞的正常代谢活动造成影响。

图4 AITC 对C.perfringens 蛋白质代谢的影响Fig.4 Effect of AITC on protein metabolism of C.perfringens
2.5 AITC 对C.perfringens ATP 酶活性的影响
ATP 酶是一种能够催化ATP 水解产生能量的蛋白酶,在细胞能量代谢中发挥着重要作用[28],当生物体受到外界环境胁迫时,其活性可能随之发生改变。本研究测定了不同处理组中C.perfringens的ATP 酶活力变化,结果表明,1 MIC(1.57±0.01 U/mg prot)和2 MIC(1.48±0.02 U/mg prot)处理组中C.perfringens的 ATP 酶活力与对照组(1.96±0.04 U/mg prot)相比显著下降(P<0.05),而在4 MIC 处理组中ATP 酶活性(1.38±0.10 U/mg prot)进一步降低(图5)。ATP 酶活性的降低会影响细胞的呼吸代谢,进而阻碍细胞生长,甚至导致死亡。根据SDS-PAGE 的结果分析,可以推测AITC 通过抑制C.perfringens细胞内蛋白质的合成,使得胞内酶合成受阻[29]。Wen等[30]研究发现从辣木种子中提取的异硫氰酸酯显著降低了单增李斯特菌的ATP 酶活性,并导致胞内ATP 含量降低,可能是由于异硫氰酸酯通过影响细胞的糖代谢干扰能量代谢,进而影响细胞分解代谢产物的自身修复的过程,从而抑制细菌生长。因此,推测AITC 可能通过降低C.perfringens的ATP 酶活力对菌体能量代谢造成干扰,进而发挥抑菌效果。

图5 AITC 对C.perfringens 的ATP 酶活力的影响Fig.5 Effect of AITC on ATPase activity of C.perfringens
2.6 AITC 对熟猪肉糜中C.perfringens 的抑制效果
由于肉类体系中成分复杂,抑菌剂添加量通常需要比在实验室培养基体系更高才有可能展现出良好的显示出抑菌效果[21]。图6 为不同添加量AITC的熟猪肉糜中C.perfringens的增长情况。可以看到,对照组(不含AITC)中C.perfringens数量生长繁殖至8.63±0.18 log CFU/g,而添加了0.1%、0.2%、0.3%、0.4%AITC 的熟肉样品中的C.perfringens数量显著减少(P<0.05),分别为8.03±0.23、7.18±0.24、6.10±0.04、5.28±0.03 log CFU/g。本实验结果与其它植物精油对鸡胸肉中C.perfringens[13,31]的抑制效果相似,表明AITC 对熟猪肉糜中的C.perfringens具有良好的抑制效果。
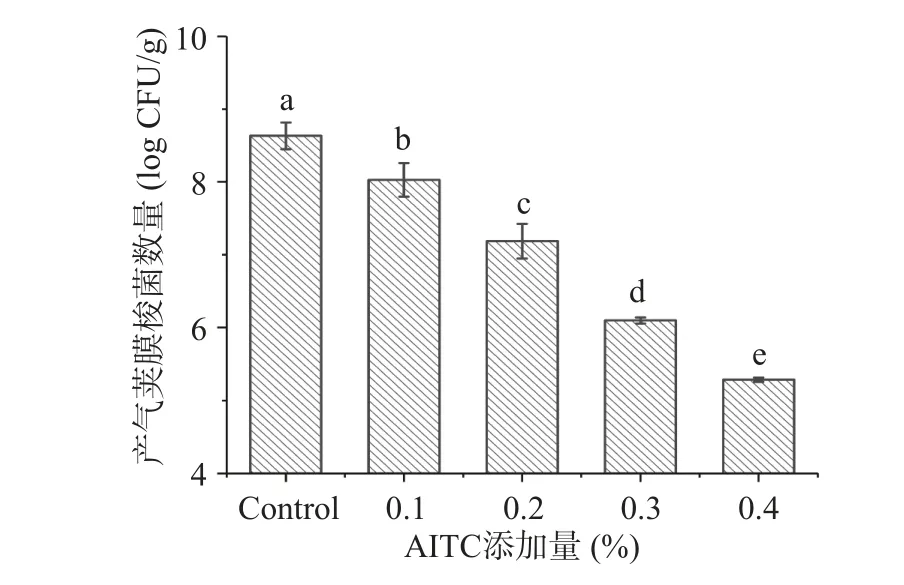
图6 AITC 对熟猪肉糜中C.perfringens 的抑制效果Fig.6 Effect of AITC on the inhibition of C.perfringens in cooked ground pork
3 结论
本文中生长曲线的实验结果表明AITC 对C.perfringens的生长繁殖具有良好的抑制作用。随后利用SEM、荧光显微镜、SDS-PAGE 等手段初步探讨其对C.perfringens的抑菌作用方式,结果表明,AITC 主要作用于C.perfringens的细胞膜结构,使菌体发生形变,导致细胞膜完整性丧失、通透性增强,进而引起蛋白质泄漏,同时能够显著降低ATP 酶活性,影响细胞的正常代谢活动,最终抑制菌体生长甚至导致其死亡。在熟猪肉糜体系中,添加低剂量的AITC 就能够有效抑制C.perfringens的生长。总之,本研究为利用AITC 抑制肉类食品中的C.perfringens提供了一种可行性方案,后续应针对性研究精油类抑菌剂对肉制品品质的影响。

