HER2阳性型乳腺癌肿瘤间质淋巴细胞浸润程度表达的临床病理意义
满其荣 赵甜甜 段超 李苓
1济宁医学院附属滕州市中心人民医院肿瘤科,滕州 277500;2济宁医学院附属滕州市中心人民医院病理科,滕州 277500
2022 年全球癌症流行病学数据调查显示,乳腺癌已超过肺癌成为全球发病率第一的癌症,其中人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)阳性型乳腺癌患者占总数的15%~20%,这种类型的乳腺癌常常分化较差,肿瘤恶性程度高,侵袭性强,患者预后差[1]。但随着抗HER2 靶向药物的出现和使用,此类型患者反倒成为治疗疗效最好的一类。然而只有50%~80%的患者能够获益于靶向药物的使用,20%~50%的患者会有对靶向药物不敏感的情况或使用后耐药导致病情进展,此时患者可以使用的治疗方案已较少。如果在治疗之前能有评价治疗效果的指标或发现新的治疗靶点,能给这种类型的患者带来新的生存希望。在2011 年圣加伦(St.Gallen)国际乳腺癌会议上,有专家提出抗HER2 靶向治疗效果与机体免疫状态密切相关。肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)是指肿瘤间质中的异质性淋巴细胞,包括T细胞及自然杀伤(NK)细胞等。在多数实体肿瘤中都有研究,如乳腺癌、结肠癌、黑色素瘤和肺癌等[2]。TILs 的主要功能是在肿瘤局部免疫反应中抑制肿瘤细胞的生长和转移。有临床研究表明,TILs 在HER2 阳性型乳腺癌中含量越高,患者预后越好,但患者使用曲妥珠单抗治疗后TILs含量与预后的相关性消失[3]。另有研究报道,当乳腺癌TILs含量≥60% 时称作淋巴细胞优势的乳腺癌(lymphocyte predominant breast cancer,LPBC),LPBC 患者与非LPBC 患者相比,无论是接受新辅助化疗还是靶向治疗,在治疗后更容易发生病理完全缓解[4]。尽管众多研究已经明确TILs 在判断乳腺癌患者预后方面的作用,但仍存在不同的结果。因此,本文将对TILs 在HER2 阳性型乳腺癌中表达的临床病理意义进行进一步研究。
材料与方法
1.一般材料
收集2016年10月至2018年10月期间滕州市中心人民医院收治的HER2 阳性型乳腺癌患者94 例,本研究使用乳腺癌患者的石蜡标本做相关检测。其中,49 例患者接受曲妥珠单抗靶向治疗和化疗,45例患者仅接受化疗;所有患者均为女性,中位年龄51 岁(32~73 岁)。入组标准:(1)组织学蜡块经免疫组织化学方法检测HER2 的结果为+++,或者经荧光原位杂交方法检测HER2 的结果为阳性;(2)术后常规病理结果为乳腺非特殊型浸润性癌;(3)女性原发性单侧乳腺癌;(4)临床病理资料完整,同时有明确的肿瘤临床分期。排除标准:(1)术前曾接受过放化疗;(2)有严重的全身性疾病;(3)就诊时已经发生癌转移。
2.TILs结果判定
由两名高年资病理主治医师共同判定。根据TILs国际工作组推荐的乳腺癌TILs 组织学评判标准,首先在4×目镜下观察肿瘤细胞和TILs 的大致分布;然后在10×目镜下每个标本选择3 个区域,标准是有肿瘤细胞、基质和TILs,并且没有明显的非特异性染色和大面积的组织缺失。当TILs分布有异质性时,要避免选择过多或过少的区域;最后在20×目镜下评分癌巢和肿瘤基质中的TILs。癌巢中TILs 的表达值为计数选择区域中TILs 的数量和肿瘤细胞的数量,最后计算值为TILs 数量比肿瘤细胞的比值;肿瘤基质中TILs 的表达值通过评估淋巴细胞占肿瘤基质区域的比例;最后结果为多个区域计算的平均值为该样本的表达值。最后以轻度(TILs:0~10%)、中度(TILs:>10%~40%)、重度(TILs:>40%~90%)浸润表述,由于本研究样本数少,且轻度和中度有相似的生存趋势,因此将轻度和中度归为一个轻度组。
3.病例随访
采用电话、门诊和住院的方式随访患者的无复发生存期(recurrence-free survival,RFS),即从确诊为恶性肿瘤首次治疗到首次复发、转移的时间(包括病理学确诊及影像学提示的远处转移)。随访截止时间为2022 年10 月,随访时间4~71个月,中位随访时间是48个月。
4.统计学分析
使用SPSS 25.0软件进行统计比较。采用Excel 2019建立数据库;使用χ2检验对分类资料进行统计分析;使用Kaplan-Meier 生存曲线和Cox 回归法对预后相关指标行单因素和多因素分析。所有统计数据采用双侧检验,以P<0.05表示差异有统计学意义。
结果
1.TILs 浸润程度与HER2 阳性型乳腺癌患者临床病理特征的关系
94例HER2阳性型乳腺癌患者,61例呈轻度浸润,33例呈重度浸润。本文统计了包括年龄、组织学分级、P53、Ki-67、雌激素受体(ER)、孕激素受体(PR)、TNM 分期在内的7 项与预后相关的临床病理参数,根据统计结果得出:TILs 浸润程度与各临床病理参数均无明显相关性(均P>0.05),见表1。
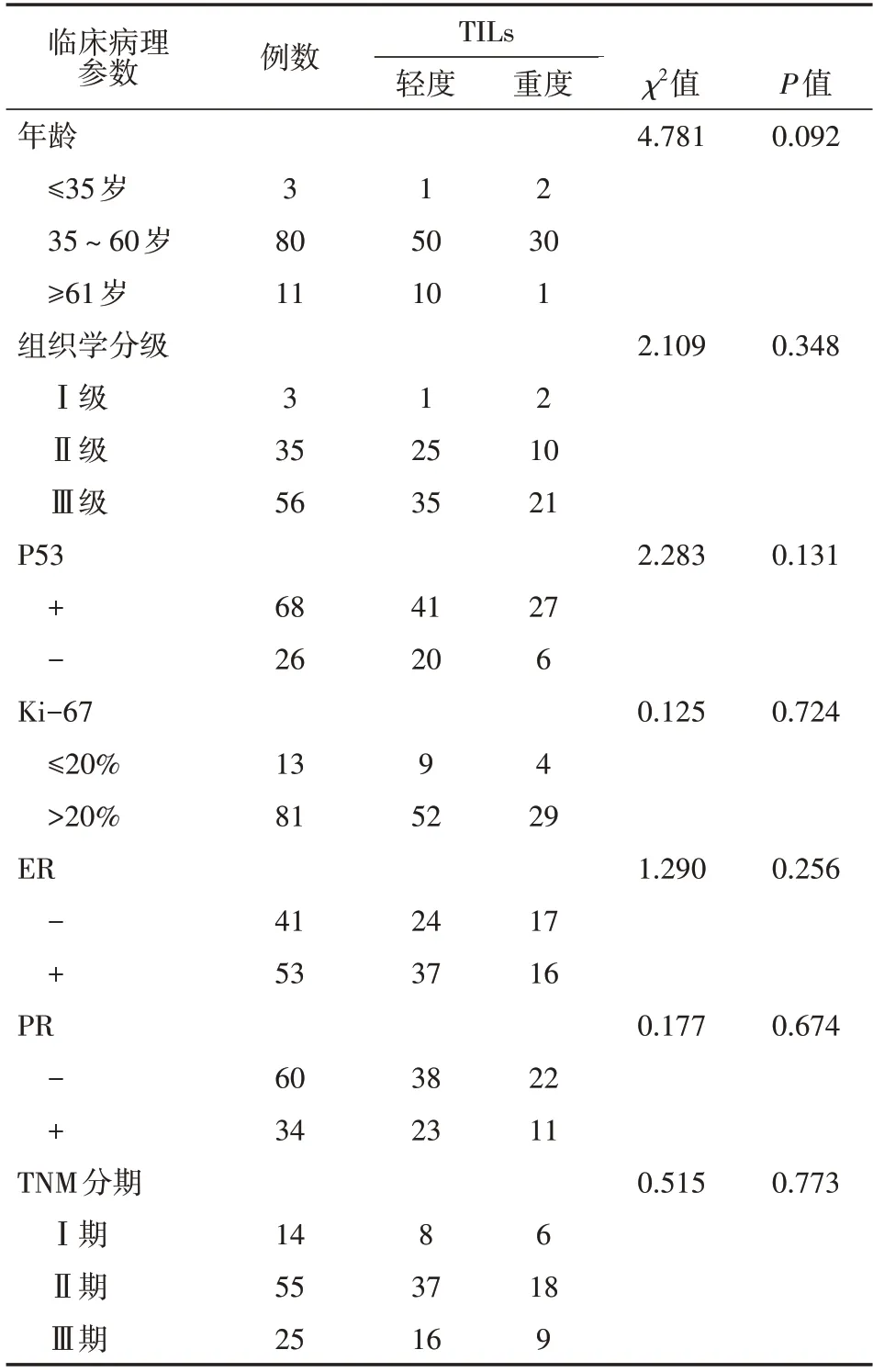
表1 TILs与HER2阳性型乳腺癌临床病理特征的关系(例)
2.TILs浸润程度与HER2阳性型乳腺癌患者预后的关系
应用Kaplan-Meier 生存曲线和Cox 比例风险回归模型对HER2 阳性型乳腺癌患者预后相关因素进行单因素和多因素分析。94 例患者中,49 例接受曲妥珠单抗靶向治疗和化疗为靶向治疗组,45例仅接受化疗为普通化疗组;对两组患者分别做预后相关分析。靶向治疗组:32例呈轻度浸润,17 例呈重度浸润。Kaplan-Meier 分析结果得出,TILs 重度浸润患者RFS 长于TILs 轻度浸润者(P=0.036,图1);Cox 回归分析结果得出,TNM 分期和TILs 浸润程度均是HER2 阳性型乳腺癌患者预后的独立因素(P=0.003、P=0.029,表2)。普通化疗组:29 例呈轻度浸润,16 例呈重度浸润。Kaplan-Meier 分析结果得出,与TILs 轻度浸润患者相比,TILs 重度浸润患者的RFS 更长(P=0.049,图2);Cox 回归分析结果得出,TNM 分期和TILs 浸润程度均是患者预后相关的独立因素(P=0.001、P=0.028,表3)。
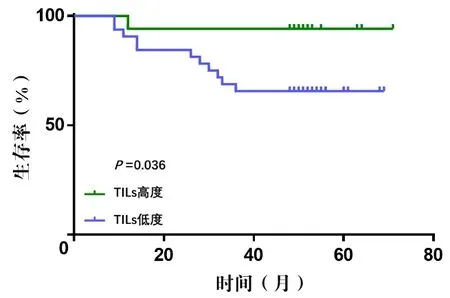
图1 49 例行靶向治疗的HER2 阳性型乳腺癌患者TILs浸润程度与RFS关系

图2 45 例行普通化疗的HER2 阳性型乳腺癌患者TILs浸润程度与RFS关系

表2 49例行靶向治疗的HER2阳性型乳腺癌患者RFS单因素和多因素分析
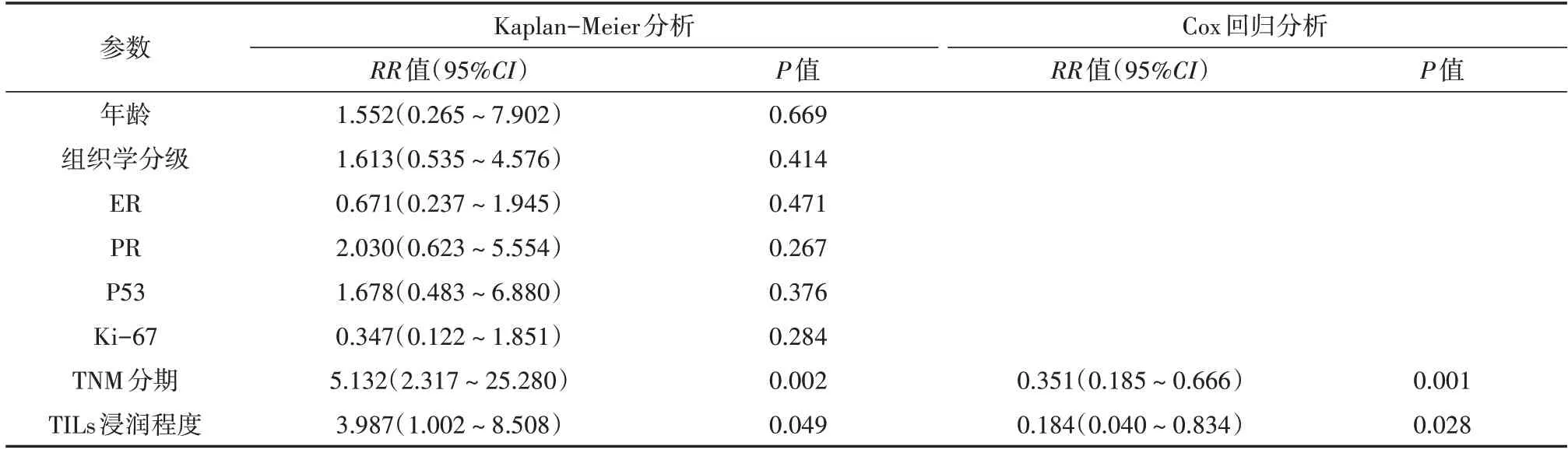
表3 45例行普通化疗的HER2阳性型乳腺癌患者RFS单因素和多因素分析
讨论
乳腺癌是女性最常见的恶性肿瘤,根据病理指标ER、PR、HER2、Ki-67 的表达状态,乳腺癌分为4 种分子分型:Luminal A、Luminal B、三阴性和HER2 阳性。针对HER2 阳性型乳腺癌患者,与传统化疗相比,靶向药物的使用不仅毒副反应小,而且能够明显提高患者的病理完全缓解率,延长患者的无病生存期和总生存期[5]。但其原发和继发耐药现象一直困扰着医生和患者,耐药机制尚不明确,有研究发现耐药与机体免疫相关[6]。在乳腺癌分子亚型中,三阴性乳腺癌免疫原性最强,肿瘤间质中TILs比例更高,关于TILs的研究目前大多数是这种类型;其次是HER2 阳性型乳腺癌,研究较少并且还没有得出一致性结论[7]。在一项回顾性研究中发现,当肿瘤中表达高比例的TILs 时通常肿瘤有更强的侵袭性,且患者对化疗也更敏感[8]。免疫系统在抑制肿瘤细胞生长繁殖的过程中发挥重要作用,因此TILs 是乳腺癌一个非常重要的预后指标和预测治疗效果的指标。
既往有较多关于TILs浸润程度与乳腺癌临床病理特征关系的研究,但尚无一致性结论。在4 种乳腺癌分子分型中,TILs 比例在三阴性乳腺癌中最高,且与组织学分级有关,肿瘤分级越高,TILs 比例越高[9]。陈翱翔等[10]的研究发现TILs 比例与激素受体状态明显相关,激素受体阴性乳腺癌的TILs 比例明显高于激素受体阳性,与其余临床病理特征无明显相关性。侯欣喜等[11]的研究结果显示,TILs 与乳腺癌的肿瘤大小、淋巴结转移、TNM分期及组织学分级密切相关。本研究结果显示,TILs 浸润程度与各临床病理参数均无明显相关性。推测上述研究结果不一致的原因可能是TILs 比例界定不同,本研究以2014 年TILs 国际工作组推荐的乳腺癌TILs 组织学评判标准[12],以轻度(TILs:0~10%)、中度(TILs:>10%~40%)、重度(TILs:>40%~90%)浸润表述,由于病例样本数少,且轻度和中度有相似的生存趋势,因此将轻度和中度归为一个轻度组。
在过去十年里,包括临床试验在内的几项研究评估了TILs 与乳腺癌预后的相关性。杨月等[13]研究结果得出CD8在肿瘤间质和瘤内TILs中的表达与患者的无瘤生存期显著相关。Loi等[14]研究发现,患者治疗方式为曲妥珠单抗靶向治疗加化疗时,其TILs 浸润量越高,临床获益越大;同时TILs 量每增加10%,肿瘤的远处转移风险会减少10%。Gelber 等[15]研究中,帕妥珠单抗联合辅助化疗加曲妥珠单抗治疗时,TILs 数量越多,患者预后越好。Perez 等[16]研究中,患者仅接受化疗而不用靶向治疗时,TILs重度浸润患者无病生存期明显长于TILs轻度浸润者。本研究依据患者是否接受靶向治疗,分为曲妥珠单抗加化疗的靶向治疗组和仅接受化疗的普通化疗组,两组的统计结果都显示TILs 重度浸润患者RFS 长于TILs 轻度浸润者,与上述临床研究结果相一致。
与上述结果不同的是,Kim 等[17]试验结果显示,无论是曲妥珠单抗加化疗的靶向治疗组,或仅接受化疗的普通化疗组,患者的无病生存期与TILs 浸润程度无明显相关性。Dieci 等[18]研究中,对比了曲妥珠单抗联合化疗治疗9 周和1 年的TILs 表达影响差异,发现靶向治疗时间9 周时,TILs数量每增加10%,远处转移风险明显降低;靶向治疗时间1年时,TILs数量每减少20%,远处转移风险明显降低。
对于靶向药物耐药或者发生远处转移的患者来说,TILs 可作为免疫治疗靶点,药物通过作用于TILs 来识别和攻击癌症细胞,目前已经取得了明显成效。在Loi等[19]研究中,对曲妥珠单抗耐药的HER2 阳性乳腺癌患者给予培美布鲁珠单抗联合曲妥珠单抗治疗,当肿瘤PD-L1 表达阳性时患者有很好的临床治疗效果,且PD-L1 阳性的肿瘤TILs水平升高。与上述研究结果不同的是,在Emens 等[20]研究中,阿替利珠单抗联合恩美曲妥珠单抗治疗晚期HER2 阳性乳腺癌症并没有显示无进展生存期的增加,而且有更多的不良事件。推测原因为TILs 包括CD8+和CD4+效应T 细胞、调节性T 细胞(Treg)、B 细胞、NK 细胞和巨噬细胞,不仅是淋巴细胞浸润的数量,而且淋巴细胞种类也影响临床治疗效果和预后。
综上所述,在HER2 阳性型乳腺癌中,评估TILs 的表达情况逐渐成为抗HER2 治疗的预测疗效和预后生物标志物,并有可能成为肿瘤新的治疗靶点,但还需要做进一步研究以明确。
作者贡献声明满其荣:酝酿和设计试验,实施研究,采集数据,分析∕解释数据,起草文章,统计分析;赵甜甜、段超:实施研究,采集数据,分析∕解释数据,统计分析,获取研究经费,行政、技术或材料支持,指导,支持性贡献;李苓:酝酿和设计试验,对文章的知识性内容作批评性审阅,获取研究经费,行政、技术或材料支持,指导,支持性贡献

