硅对镉胁迫下玉米生长和抗氧化防御系统的影响
卢园 李瑞娟 赵娜 张盼 李霄霄 吴佳文

摘要:为探究硅(Si)对镉(Cd)胁迫下玉米的缓解机制,本研究以玉米幼苗为试验材料,分析Cd污染已经存在后,外源施加Si对玉米的缓解作用。以水培法添加5 μmol/L Cd胁迫20 d后,外源施加1 mmol/L Si溶液,添加Si 处理 7 d 后,测定玉米的生物量、Cd浓度、Cd积累量和Cd转运速率(TF)、活性氧[包括过氧化氢(H2O2)和超氧阴离子(O-2·)]含量、总抗氧化能力和抗氧化酶[包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)]活性,以及非酶类抗氧化物质[包括抗坏血酸(AsA)和还原性谷胱甘肽(GSH)]含量。结果表明,Cd胁迫对玉米地上部和根系鲜质量以及H2O2和O-2·含量均未有顯著性影响,表示玉米有较强的Cd耐受性。施加Si较不施加Si显著地降低了玉米地上部的Cd浓度和Cd积累量,分别降低了44.14%和39.08%;Cd TF降低了35.78%。在叶片中,Cd胁迫下施加Si没有改变玉米的总抗氧化能力、CAT活性、SOD活性、GSH含量和AsA含量,但是加Si显著降低了叶片POD活性。在根系中,Cd胁迫下施加Si显著减少了H2O2含量,POD活性和GSH含量也显著降低。综上,玉米对Cd胁迫有较高的耐受性,而且已经遭受Cd胁迫后再外源施加Si仍能显著降低玉米体内的Cd浓度,减缓Cd污染对玉米生长的潜在危害。
关键词:玉米;镉;硅;抗氧化系统;缓解
中图分类号:S513.01 文献标志码:A
文章编号:1002-1302(2023)20-0077-08
近些年来由于工业废水的不达标排放,污水灌溉,污泥施用,空气沉降以及农业中含金属镉(Cd)的化肥和农药的不规范使用等,土壤Cd污染问题日益严重,现已成为我国乃至世界范围重要的土壤环境问题[1-5]。若污染土壤种植粮食后Cd会通过食物链在人体中积累[6],引发诸多疾病,如肝脏疾病、骨质疏松[7]、慢性肾脏疾病[8]。根据纪文贵等对我国已知的305个土壤位点的分析可知,Cd的点位超标率为5.10%,远高于其他元素的点位超标率,并且Cd已成为全国主要的重金属污染物之一[9]。Cd的毒性会导致植物形态、生理和分子水平的变化[10]。研究表明Cd胁迫会抑制种子萌发,降低植物的株高以及根的生长,还会减少植物的叶片数量,甚至导致植株死亡[11-13]。因此,如何缓解农作物Cd胁迫及降低Cd污染至关重要。
硅(Si)元素是土壤中最为丰富的元素之一,其在地壳中的含量仅次于氧[14],但土壤中的Si基本上以二氧化硅(SiO2)的形式存在,而植物仅以单硅酸(H4SiO4)的形式吸收Si[15-16]。前人大量研究表明,外源施加Si可显著缓解植物Cd胁迫,如水稻在吸收Si后可形成半纤维素-Si-Cd复合物,降低Cd向胞内的移动性,增加水稻对Cd的抗性[17]。Chen等发现外源Si显著降低了水稻中Cd胁迫诱导增加的MDA、H2O2和超氧阴离子(O-2·)含量,Si同时增加了抗氧化酶活性[15]。笔者所在团队前期研究还发现Si通过诱导小麦根尖分泌草酸,在根际外形成草酸-Cd复合物,降低根系对Cd的吸收[18]。外源Si能激活小麦体内POD、SOD、CAT等抗氧化酶活性及增加AsA/DHA、GSH/GSSG,清除因Cd胁迫导致的氧化损伤[19-20]。
玉米在我国种植广泛,不仅是重要的粮食,还应用于饲料和青贮等[21]。虽有研究表明,外源施加Si,可以增加Cd胁迫下玉米的株高、主根长、生物量[22];缓解Cd对玉米原生质体的活力影响[23];增加土壤pH值以及降低可利用形态Cd,降低玉米根部对Cd的吸收[24-25];Si还可以增加Cd胁迫下玉米叶片的光合能力[26]。然而,外源施加Si对Cd胁迫下玉米抗氧化防御系统的研究鲜见,而且前人研究多为同时添加外源Si和Cd胁迫,实际上土壤Cd污染长期存在,后期施加Si是否会同样缓解植物Cd胁迫尚不清楚。因此,本试验以玉米为供试材料,采用水培的方式,先进行Cd胁迫,随后添加Si处理,通过测定玉米鲜质量、Cd浓度、H2O2含量、O-2· 含量、总抗氧化能力以及抗氧化酶SOD、POD、CAT活性和非酶类抗氧化物质AsA和GSH含量,系统研究后期施加外源Si对Cd胁迫玉米生长及抗氧化防御系统的影响。
1 材料与方法
1.1 试验材料
供试玉米为浚单20,购自北京屯玉种业有限公司。
1.2 试验设计
本试验在2021年7—8月于延安大学生命科学学院人工气候生长室中进行。选择饱满、大小一致的玉米种子,用0.5 mmol/L CaCl2在避光且通气条件下浸泡6 h,其中0.5 mmol/L CaCl2用于保证种子萌发吸收过程中内膜系统的稳定性。浸泡后的种子播于以珍珠岩 ∶蛭石 ∶陶粒体积比为1 ∶1 ∶1混合的无机基质中萌发。萌发5 d后选取长势一致的幼苗移至1/2 浓度Hoagland营养液的聚乙烯黑色桶(体积为 5 L)中进行预培养3 d,然后换入完全浓度Hoagland营养液中再培养4 d,以保证移苗后植株的恢复。
预培养结束后,开始5 μmol/L Cd处理,Cd以CdCl2·2.5H2O的形式提供,以不加Cd为对照。Cd处理 20 d,开始外源1 mmol/L Si处理,Si处理 7 d,其中一直未加Cd和Si的是对照(CK),不加Cd仅后期加Si的为单独Si处理(Si),一直加Cd但未加Si的是Cd处理(Cd),一直加Cd后期添加Si的为Si+Cd处理(Si+Cd)。溶液每7 d更换1次,用通气泵持续通气,以HCl或NaOH调节溶液pH值为6±0.1。玉米幼苗在人工植物生长气候室中培养,温度设置为白天28 ℃、夜间20 ℃,光—暗周期16 h—8 h,光照度为350 μmol/(m2·s),湿度为75%。
1.3 测定指标与方法
1.3.1 植物鲜质量的测定 取出完整植株,冲洗干净后用滤纸吸干植株表面水分。将植株分为地上部、根系,称量鲜质量。
1.3.2 Cd浓度的测定 将烘干的玉米地上部和根系样品研磨至细粉备用。称取0.1 g植物干样至消解罐中,加入8 mL优级纯HNO3在微波消解仪(ETHOS UP,Milestone,意大利)中消解,预热 10 min,190 ℃加热15 min,冷却20 min,结束后定容至50 mL。采用电感耦合等离子体质谱仪(ICP-MS,Nexl ON 1000,PerkinElmer,美国)测定Cd含量。
1.3.3 H2O2和超氧阴离子(O-2·)含量的测定 取0.1 g新鲜叶片或根系样品在冰浴中加入1 mL 0.1%(质量浓度)三氯乙酸(TCA)研磨,匀浆4 ℃ 12 000 g 离心10 min,上清液在4 ℃冰箱中保存。取0.25 mL上清液先后加0.25 mL 10 mmol/L磷酸缓冲液(pH值为7.0)和0.5 mL 1 mol/L KI,反应15 min后,在390 nm处测定吸光度。分别取 10 mmol/L H2O2溶液1、5、15、20、30、40、50、60 L做标准曲线,根据标准曲线计算样品中H2O2含量。
超氧阴离子(O-2·)含量通过超氧阴离子含量检测试剂盒(索莱宝 BC1295)测定。
1.3.4 总抗氧化能力的测定 取0.1 g新鲜叶片或根系样品加入1 mL 体积分数为50%的乙醇研磨,随后在4 ℃ 12 000 r/min 离心10 min,取50 μL上清液,加入0.9 mL 体积分数为99%的乙醇和 50 μL 3 mmol/L 的1,1-二苯基-2-三硝基苯肼(DPPH),在室温黑暗条件下反应10 min,测定 515 nm 处的吸光度。以950 μL 99%(体积分数)乙醇加入50 μL DPPH为对照。计算公式如下:
总抗氧化能力=(D0-D1)/D0 ×100%。
式中:D0为对照吸光度;D1为样品吸光度。
1.3.5 抗氧化酶活性的测定 粗酶液的提取:称取1.5 g新鲜叶片或根系样品,在冰浴中加入2 mL 50 mmol/L 磷酸缓冲液(pH值为 7.8)内含1 mmol/L EDTA-Na2和质量浓度为1%的聚乙烯吡咯烷酮聚合物(PVPP)提取研磨,离心后取上清液,即粗酶液。
可溶性蛋白含量测定(考马斯亮蓝法):取 100 μmol/L 牛血清白蛋白0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL,分别加入5 mL考马斯亮蓝G-250(称取0.1 g考马斯亮蓝G-250溶于50 mL 体积分数为95%的乙醇中,加入100 mL体积分數为85%的磷酸,蒸馏水定容至1 000 mL)制作标准曲线溶液,充分混匀后反应2 min,在595 nm波长下比色测定制作标准曲线。取0.1 mL粗酶液加入0.8 mL蒸馏水,再加入5 mL考马斯亮G-250试剂,充分混合,室温放置5 min后,在595 nm波长下比色测定。用标准曲线计算可溶性蛋白含量。
SOD活性采用氮蓝四唑(nitroblue tetrazolium,NBT)光化学还原法测定:向10 mL玻璃管中依次加入1.5 mL 50 mmol/L pH值为7.8的磷酸缓冲液、0.3 mL 130 mmol/L甲硫氨酸溶液、0.3 mL 750 μmol/L NBT溶液、0.3 mL 1 μmol/L EDTA-Na2溶液、0.3 mL 0.2 μmol/L核黄素溶液、粗酶液0.1 mL、蒸馏水0.2 mL。充分混匀后,放置在 4 000 lx 光下反应10 min。另外取2支试管,用蒸馏水代替上述的酶液作为对照,混匀后将一支对照试管置于暗处,另一支对照试管和其他加酶液试管一起置于日光灯下反应10 min,反应结束后立即避光。以不照光对照管作为空白参比,在560 nm波长处测定吸光度。计算公式如下:
SOD活性(U/g)=(DCK-DE)×V/DCK×0.5×Pro×VS。
式中:DCK表示对照管光反应的吸光度;DE表示样品管光反应的吸光度;V表示样品提取液总体积,mL;VS表示测定时所取酶液体积,mL;Pro表示样品可溶性蛋白含量,g。
POD活性采用愈创木酚法测定:取100 mmol/L pH值为6.0的磷酸缓冲液100 mL,加入愈创木酚 56 μL,加热搅拌至愈创木酚溶解,冷却后加入 300 g/L H2O2 溶液38 μL,混匀,4 ℃保存,得到反应混合液。取2支比色杯,向一支中加入反应混合液0.3 mL、50 mmol/L 磷酸缓冲液0.1 mL作为校零对照,另一支中加入反应混合液0.3 mL、粗酶液 0.1 mL,立即于分光光度计470 nm波长下测定吸光度(D470 nm),每隔0.2 min读数1次,共读8 min;以1 min D470 nm变化0.01为1个POD活性单位(U)。计算公式如下:
POD活性[U/(g·min)]=ΔD470 nm×V/0.01×VS×t×Pro。
式中:ΔD470 nm表示反应混合液在470 nm处的吸光度变化值;V表示样品提取液总体积,mL;VS表示测定时所取酶液体积,mL;t表示酶促反应时间,min;Pro表示样品可溶性蛋白含量,g。
CAT采用紫外分光光度法测定:取20 mmol/L H2O2溶液3 mL加入到10 mL试管中,加入50 μL粗酶液并迅速混匀后转移到比色杯中,在 240 nm 波长下测定吸光度D240 nm,每隔10 s读数1次,共读3 min。以1 g鲜质量样品1 min内D240 nm变化0.01作为1个过氧化氢酶活性单位。计算公式如下:
CAT活性[U/(g·min)]=ΔD240 nm×V/0.01×VS×t×Pro。
式中:D240 nm表示反应混合液在240 nm处的吸光度变化值;V表示提取样液总体积,mL;VS表示测定时所取酶液体积,mL;t表示酶促反应时间,min;Pro表示样品可溶性蛋白含量,g。
1.3.6 谷胱甘肽(GSH)和抗坏血酸(AsA)含量的测定 GSH和AsA分别使用还原性谷胱甘肽含量检测试剂盒(索莱宝 BC1175)和抗坏血酸含量检测试剂盒(索莱宝 BC1230)测定。
1.4 数据处理和分析
试验采用Excel 2016、GraphPad Prism 9 软件对数据进行统计分析及作图。采用SPSS 18.0进行数据显著性分析,玉米Cd与Cd+Si处理的地上部和根部Cd浓度和积累量,及根部向地上部的转移系数以t测验分析在0.01、0.05水平的差异,其他数据以单因素方差,Duncans多重比较法分析在0.05水平上的差异。
2 结果与分析
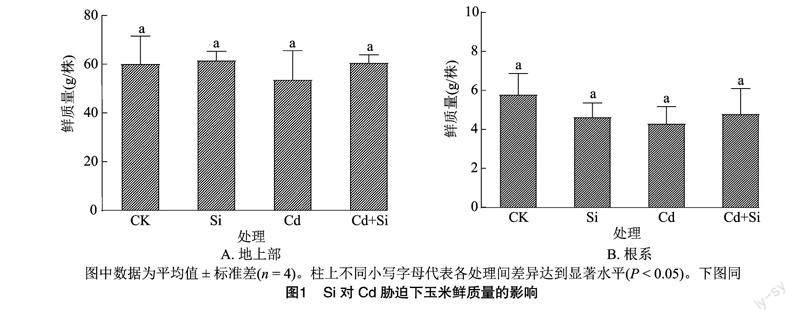
2.1 Si对Cd胁迫下玉米鲜质量和Cd浓度的影响
由图1可知,无论是玉米地上部还是根系,不同处理下的玉米鲜质量都没有显著性差异。这表明浓度为5 μmol/L的Cd胁迫浓度对玉米的生长没有显著影响,玉米对Cd胁迫具有较强的耐性。此外,Si的施加也并没有对玉米的生长产生显著影响。
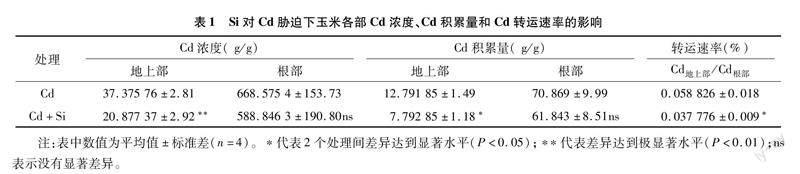
由表1可知,Cd胁迫下玉米根部的Cd浓度、Cd积累量和Cd转运速率(TF)较高,根部的Cd浓度和Cd积累量大约是地上部分的17.88、5.55倍。与Cd处理相比,Cd+Si处理下玉米地上部的Cd浓度和Cd积累量显著降低;根部的Cd浓度和Cd积累量有所降低,但未达到显著水平。施加Si后,地上部和根部的Cd浓度分别降低了44.14%和11.92%,Cd积累量分别降低了39.08%和12.74%,并且Cd转运速率(TF)也降低了35.78%,表明加Si抑制了Cd从根部向地上部的转运。
2.2 Si对Cd胁迫下玉米的H2O2和超氧阴离子(O-2·)含量的影响
由图2可知,在玉米叶片中,各处理之间的H2O2和O-2·含量并无显著性差异。而在玉米的根中,如图2-B所示,与单独施加Cd处理相比,Si+Cd处理的H2O2含量显著降低; 单独施加Si处理与CK之间的H2O2含量并无显著性差异。如图2-D所示,与CK相比,Si+Cd处理和Si处理的O-2·含量显著增加,但Cd处理与其他3组相比并无显著差异。说明玉米根系对Cd胁迫相较于叶片更为敏感,更易产生活性氧,Cd胁迫20 d后外源施加Si降低了H2O2对玉米根系的损伤。
2.3 Si对Cd胁迫下玉米总抗氧化能力和抗氧化酶活性的影响
由图3可知,在玉米叶片中单独施加Si时,DPPH·的含量与对照和Cd+Si处理相比显著增加;与Cd处理相比,Cd+Si处理的DPPH·含量无显著变化。而在根部,CK组的DPPH·含量显著高于其他3组,其他3组之间并无显著性差异。由图4可知,4种处理的CAT和SOD活性对比均无显著性差异。POD活性在玉米中發生变化,在玉米根部,单独施加Cd处理的POD活性显著低于对照组,施加Si后POD的活性进一步降低;在玉米叶片中,与Cd处理对于,Cd+Si处理的POD活性显著降低。说明Si可以增加玉米叶片的抗氧化能力,但在Cd胁迫发生后,并没有增加玉米植株的抗氧化能力;在5 μmol/L Cd胁迫下,Si的施加也并没有激发抗氧化酶发挥清除活性氧自由基的作用。
2.4 Si对Cd胁迫下玉米GSH和AsA含量的影响
由图5可知,玉米叶片的GSH含量在各处理间没有显著差异,但在根系,单独施加Cd后的GSH含量显著高于其他3组,Cd+Si处理的GSH含量显著低于单独施加Cd处理。而对于AsA含量,单独施加Cd后玉米叶片中的AsA含量显著低于对照组;Si+Cd处理的AsA含量虽然高于Cd处理,但没有显著差异。说明外源施加Si后,降低了5 μmol/L Cd胁迫下GSH的含量,但对AsA的含量并没有显著影响,表明在玉米根系中的GSH主要参与了活性氧的清除,而AsA并没有发挥作用。
3 讨论与结论
重金属Cd是植物非必需元素,还对植物生长有抑制作用,但是Cd2+会通过必需元素如Fe2+、Ca2+和Mn2+等的转运体进入植物体内[27]。玉米是全球三大农作物之一,也不可避免地遭受着Cd污染胁迫。姜瑛等报道1 mmol/L Si可以缓解50 μmol/L Cd胁迫下玉米的Cd毒作用和增加植株鲜质量[26]。本研究中在玉米移苗培养20 d后外源施加1 mmol/L Si并没有显著增加玉米的鲜质量,这可能与施加Si时间太短有关。值得一提的是本研究中5 μmol/L Cd并未显著抑制玉米地上部和根系的鲜质量,表示玉米有较高的Cd耐受性。尽管Cd或Si没有显著改变玉米的鲜质量,但外源施加Si极大地降低了玉米地上部Cd浓度和积累量,以及根部向地上部的TF,这与Chen等的研究结果[15,26]一致。然而,Mal[KG-*5]c[DD(-1*3]ˇovská等却报道Si对Cd胁迫下玉米的Cd浓度和Cd的TF没有显著影响[28]。笔者推测Si的施加时间,施加方式,以及玉米品种可能均关系着根系吸收和转运Cd的情况。
Cd胁迫下,植株体内的活性氧自由基大量产生,活性氧包括过氧化氢(H2O2)、羟自由基(·OH)和超氧阴离子(O-2·)等,这些活性氧的产生会引发膜脂过氧化,破坏细胞膜系统[29]。尽管Cd不直接产生活性氧,但是活性氧的大量产生却也是Cd毒的作用之一[30]。外源施加Si可以降低Cd胁迫下小麦[19]、干旱胁迫下水稻[31]以及Cd胁迫下豌豆的活性氧含量[32]。本研究发现,Cd胁迫增加了玉米根部的H2O2含量,对O-2·并无显著影响;施加Si后,玉米根部的H2O2含量显著降低,而O-2·的含量却上升。在前人的研究中,Cd胁迫下的小麦[19]、山葵植株体中H2O2含量显著增加[33],同时施加Si与Cd处理下的含量有所下降,本研究结果与之类似。但在El-Okkiah的研究中,Cd胁迫增加了豌豆植株体中O-2·的生产速率,同时施加Si与Cd处理的生产速率极大降低[32]。推测物种的不同,其体内活性氧的含量也不尽相同,其次在Cd胁迫发生后施加Si会影响Si所引发的活性氧清除机制与同时施加Cd和Si的影响产生差异,进而使得植物体内活性氧含量出现不同的变化。
在植物進化过程中,植物体内形成了清除防御活性氧的抗氧化系统,主要包括酶系统和非酶系统的抗氧化物质。抗氧化酶系统主要包括POD、CAT、SOD等[34-35],POD可以代谢掉植物体内O-2·,并将其歧化为H2O2和O2,H2O2再被POD转化为H2O,使活性氧的水平达到较低水平[36];通常情况下,SOD作为清除H2O2的重要物质,可以抑制活性氧的积累,从而保护细胞膜;CAT可与SOD协同作用,清除体内的活性氧自由基[37]。在本研究中,从总的抗氧化能力来看,单独施加Si处理的玉米叶片中DPPH·含量显著高于对照,Cd处理和Cd+Si处理的DPPH·含量并显著差异,说明Si可以提高玉米叶片的抗氧化能力,但Cd胁迫后施加Si时抗氧化能力并没有得到增加;而SOD、CAT的活性在4种处理中并无显著变化,Cd+Si处理的POD活性在玉米叶片和根系中均降低。因此,由于玉米自身较强的抗逆性,Cd胁迫没有显著引起抗氧化酶活性的变化,Si的施加也没有引起抗氧化酶活性的显著变化。在Lukacova等的研究中,Cd胁迫下,Si对玉米植株的SOD等抗氧化酶活性的影响随处理时间、处理植株部位的不同而表现出不同的变化[25]。因此Si对Cd胁迫下玉米抗氧化酶活性的影响机制还有待进一步研究。众所周知,AsA-GSH循环是在植物细胞质和叶绿体中清除活性氧的主要途径,其中AsA和GSH可以维持蛋白质的稳定性和防止细胞膜过氧化,是AsA-GSH循环中重要的非酶类物质。AsA可以在抗坏血酸过氧化氢酶(APX)的帮助下将H2O2直接分解为水和氧气[20];GSH不仅可以通过AsA-GSH循环间接清除H2O2,还可以直接清除活性氧;除此之外,GSH还是金属元素的螯合剂,因其半胱氨酸残基上的巯基对Cd具有很高的亲和力,GSH在Cd的螯合上也发挥着重要的作用[38]。在本研究中Cd胁迫下玉米根系中GSH的含量较CK显著增加,AsA含量并没有显著变化;施加Si后,玉米根系中GSH含量相较于Cd处理显著降低。在Swati等的研究中,Cd胁迫下降低了小麦体内的AsA、DHA、GSH和GSSG及AsA/DHA、GSH/GSSG,Si的施加AsA/DHA、GSH/GSSG增加[20]。而Wu等的研究结果显示,Si对Cd胁迫下大白菜的GSH-AsA循环并没有显著影响[39]。推测一方面是由于未施加Si前的非酶类抗氧化物质对Cd胁迫做出应答反应,施加Si后Cd胁迫下玉米植株体内主要靠抗氧化物质GSH而非抗氧化酶参与清除Cd胁迫诱导的H2O2含量;另一方面,Cd胁迫发生后GSH的含量会增加来螯合并作为载体转运Cd[40],并且有研究表明,在Cd胁迫早期,GSH的螯合能力高于其抗氧化能力[41],而在Cd胁迫发生后Si可能通过减少GSH的含量,降低对Cd的转运。
本试验结果表明,玉米对Cd胁迫有较高的耐受性,Cd胁迫下玉米的生长并未受到显著影响,但在Cd污染已经存在的情况下施加Si后依然可以显著降低玉米对Cd的吸收、转运和积累;在玉米已经受到Cd胁迫后,Si并不是通过激活抗氧化酶来缓解活性氧对玉米的伤害,而是通过非酶类抗氧化物质GSH来清除H2O2,减缓Cd对玉米生长的潜在危害。
参考文献:
[1]Antoniadis V,Levizou E,Shaheen S M,et al. Trace elements in the soil-plant interface:phytoavailability,translocation,and phytoremediation:a review[J]. Earth-Science Reviews,2017,171:621-645.
[2]El Rasafi T,Oukarroum A,Haddioui A,et al. Cadmium stress in plants:a critical review of the effects,mechanisms,and tolerance strategies[J]. Critical Reviews in Environmental Science and Technology,2022,52(5):675-726.
[3]Geng N,Wu Y C,Zhang M,et al. Bioaccumulation of potentially toxic elements by submerged plants and biofilms:a critical review[J]. Environment International,2019,131:105015.
[4]Kniuipyt[KG-*2]e· I,Dikaityt[KG-*2]e· A,Praspaliauskas M,et al. Oilseed rape (Brassica napus L.) potential to remediate Cd contaminated soil under different soil water content[J]. Journal of Environmental Management,2023,325:116627.
[5]Palansooriya K N,Shaheen S M,Chen S S,et al. Soil amendments for immobilization of potentially toxic elements in contaminated soils:a critical review[J]. Environment International,2020,134:105046.
[6]Fu T T,Zhao R Y,Hu B F,et al. Novel framework for modelling the cadmium balance and accumulation in farmland soil in Zhejiang Province,East China:sensitivity analysis,parameter optimisation,and forecast for 2050[J]. Journal of Cleaner Production,2021,279:123674.
[7]Ougier E ,Fiore K ,Rousselle C ,et al. Burden of osteoporosis and costs associated with human biomonitored cadmium exposure in three European countries:France,Spain and Belgium[J]. International Journal of Hygiene and Environmental Health,2021,234(2):113747.
[8]Wu C Y,Wong C S,Chung C J,et al. The association between plasma selenium and chronic kidney disease related to lead,cadmium and arsenic exposure in a Taiwanese population[J]. Journal of Hazardous Materials,2019,375:224-232.
[9]紀文贵,王 珂,蒙建波,等. 中国土壤重金属污染状况及其风险评价[J]. 农业研究与应用,2020,33(5):22-28.
[10]Rizwan M,Ali S,Adrees M,et al. A critical review on effects,tolerance mechanisms and management of cadmium in vegetables[J]. Chemosphere,2017,182:90-105.
[11]Bae J,Benoit D L,Watson A K.Effect of heavy metals on seed germination and seedling growth of common ragweed and roadside ground cover legumes[J]. Environmental Pollution,2016,213:112-118.
[12]Mani D,Sharma B,Kumar C,et al. Cadmium and lead bioaccumulation during growth stages alters sugar and vitamin C content in dietary vegetables[J]. Proceedings of the National Academy of Sciences,2012,82(4):477-488.
[13]Soudek P,Petrová ,Vaňková R,et al. Accumulation of heavy metals using Sorghum sp.[J]. Chemosphere,2014,104:15-24.
[14]刘彩凤,史刚荣,余如刚,等. 硅缓解植物镉毒害的生理生态机制[J]. 生态学报,2017,37(23):7799-7810.
[15]Chen D M,Chen D Q,Xue R R,et al. Effects of boron,silicon and their interactions on cadmium accumulation and toxicity in rice plants[J]. Journal of Hazardous Materials,2019,367:447-455.
[16]Ma J F.Role of silicon in enhancing the resistance of plants to biotic and abiotic stresses[J]. Soil Science and Plant Nutrition,2004,50(1):11-18.
[17]Ma J E,Cai H M,He C W,et al. A hemicellulose-bound form of silicon inhibits cadmium ion uptake in rice (Oryza sativa) cells[J]. New Phytologist,2015,206(3):1063-1074.
[18]Wu J W,Geilfus C M,Pitann B,et al. Silicon-enhanced oxalate exudation contributes to alleviation of cadmium toxicity in wheat[J]. Environmental and Experimental Botany,2016,131:10-18.
[19]Shi Z Y,Yang S Q,Han D,et al. Silicon alleviates cadmium toxicity in wheat seedlings (Triticum aestivum L.) by reducing cadmium ion uptake and enhancing antioxidative capacity[J]. Environmental Science and Pollution Research,2018,25(8):7638-7646.
[20]Swati S,Mohan P S,Shivesh S,et al. Silicon and nitric oxide-mediated mechanisms of cadmium toxicity alleviation in wheat seedlings[J]. Physiologia Plantarum,2020,174(5):e13065.
[21]胡玉超,谢 飞,张开京,等. 甜玉米抗非生物胁迫研究进展[J/OL]. 分子植物育种(2022-08-04)[2023-08-08]. http://kns.cnki.net/kcms/detail/46.1068.S.20220804.0858.002.html.
[22]An T,Gao Y M,Kuang Q Q,et al. Effect of silicon on morpho-physiological attributes,yield and cadmium accumulation in two maize genotypes with contrasting root system size and health risk assessment[J]. Plant and Soil,2022,477:117-134.
[23]Kollárová K,Kusá Z,Vatehová-Vivodová Z,et al. The response of maize protoplasts to cadmium stress mitigated by silicon[J]. Ecotoxicology and Environmental Safety,2019,170:488-494.
[24]Janeeshma E,Puthur J T,Ahmad P.Silicon distribution in leaves and roots of rice and maize in response to cadmium and zinc toxicity and the associated histological variations[J]. Physiologia Plantarum,2021,173(1):460-471.
[25]Lukacova Z,Liska D,Bokor B,et al. Silicon and cadmium interaction of maize (Zea mays L.) plants cultivated in vitro[J]. Biologia,2021,76(9):2721-2733.
[26]姜 瑛,魏 畅,焦秋娟,等. 外源硅对镉胁迫下玉米生理参数及根系构型分级的影响[J]. 草业学报,2022,31(9):139-154.
[27]曲梦雪,宋 杰,孙 菁,等. 镉胁迫对不同耐镉型玉米品种苗期根系生长的影响[J]. 作物学报,2022,48(11):2945-2952.
[28]Malcˇovská S M,Ducˇaiová Z,Maslaňáková I,et al. Effect of silicon on growth,photosynthesis,oxidative status and phenolic compounds of maize (Zea mays L.) grown in cadmium excess[J]. Water,Air,& Soil Pollution,2014,225(8):2056.
[29]He J L,Zhou J T,Wan H X,et al. Rootstock-scion interaction affects cadmium accumulation and tolerance of Malus[J]. Frontiers in Plant Science,2020,11:1264.
[30]Choppala G,Ullah S,Bolan N,et al. Cellular mechanisms in higher plants governing tolerance to cadmium toxicity[J]. Critical Reviews in Plant Sciences,2014,33(5):374-391.
[31]Shi Y,Zhang Y,Han W H,et al. Silicon enhances water stress tolerance by improving root hydraulic conductance in Solanum lycopersicum L.[J]. Frontiers in Plant Science,2016,7:196.
[32]El-Okkiah S A F,El-Tahan A M,Ibrahim O,et al. Under cadmium stress,silicon has a defensive effect on the morphology,physiology,and anatomy of pea (Pisum sativum L.) plants[J]. Frontiers in Plant Science,2022,13:997475.
[33]Azam S K,Karimi N,Souri Z,et al. Multiple effects of silicon on alleviation of arsenic and cadmium toxicity in hyperaccumulator Isatis cappadocica Desv.[J]. Plant Physiology and Biochemistry,2021,168:177-187.
[34]田國忠,李怀方,裘维蕃. 植物过氧化物酶研究进展[J]. 武汉植物学研究,2001,19(4):332-344.
[35]康育鑫,廖水兰,兰 婕,等. 镉胁迫对不同叶用莴苣品种生长及生理特性的影响[J]. 江苏农业科学,2021,49(7):149-154.
[36]Bela K,Riyazuddin R,Csiszár J. Plant glutathione peroxidases:non-heme peroxidases with large functional flexibility as a core component of ROS-processing mechanisms and signalling[J]. Antioxidants,2022,11(8):1624.
[37]Mahmoud A,AbdElgawad H,Hamed B A,et al. Differences in cadmium accumulation,detoxification and antioxidant defenses between contrasting maize cultivars implicate a role of superoxide dismutase in Cd tolerance[J]. Antioxidants,2021,10(11):1812.
[38]Jozefczak M,Remans T,Vangronsveld J,et al. Glutathione is a key player in metal-induced oxidative stress defenses[J]. International Journal of Molecular Sciences,2012,13(3):3145-3175.
[39]Wu Z C,Liu S,Zhao J,et al. Comparative responses to silicon and selenium in relation to antioxidant enzyme system and the glutathione-ascorbate cycle in flowering Chinese cabbage (Brassica campestris L. ssp. chinensis var. utilis) under cadmium stress[J]. Environmental and Experimental Botany,2017,133:1-11.
[40]Huang Y Y,Huang B F,Shen C,et al. Boron supplying alters cadmium retention in root cell walls and glutathione content in Capsicum annuum[J]. Journal of Hazardous Materials,2022,432:128713.
[41]Jana D,Sophie H,Els P,et al. Glutathione is required for the early alert response and subsequent acclimation in cadmium-exposed Arabidopsis thaliana plants[J]. Antioxidants,2021,11(1):6.
收稿日期:2022-12-28
基金項目:延安大学博士科研启动项目(编号:YDBK2019-17);延安大学科学研究专项(编号:YDY2019-27);陕西省大学生创新创业训练计划项目(编号:S202110719126)。
作者简介:卢 园(1999—),男,江西金溪人,硕士研究生,主要从事植物营养生理及分子机制研究。E-mail:1186112604@qq.com。
通信作者:吴佳文,博士,副教授,硕士生导师,主要从事植物营养与抗逆机制研究。E-mail:wujiawende@126.com。

