禾谷镰刀菌拮抗菌21-1的发酵条件及稳定性分析
张强 张艳茹 霍云凤 石红利


摘要:禾谷镰刀菌(Fusarium graminearum)作为一种重要的植物病原真菌,能够侵染小麦引起的赤霉病等病害的发生。为探究黄三素链霉菌(Streptomycetaceae flavotricini)21-1对禾谷镰刀菌的生防活性,采用单因素试验对菌株 21-1 的发酵条件进行分析,并对无菌发酵液的稳定性进行评价。结果表明,菌株21-1在发酵培养基中培养后可以产生较好的抑菌效果,并且发酵时间为5 d、起始pH值为中性及碱性、发酵温度为28~30 ℃、装液量为75~100 mL、转速为160~180 r/min的条件下抑菌活性最强。菌株21-1无菌发酵液对80 ℃以上的高温敏感,不受紫外线照射时间、酸碱度、胃蛋白酶、胰蛋白酶及蛋白酶K的影响。PCR检测发现,菌株21-1具有聚酮合酶pks-Ⅰ和pks-Ⅱ基因。此外,菌株21-1发酵液能够抑制禾谷镰刀菌对小麦胚芽鞘的侵染过程。综上所述,菌株21-1具有一定的应用和开发潜力。
关键词:禾谷镰刀菌;黄三素链霉菌;发酵条件;稳定性;赤霉病
中图分类号:S435.121.4+5文献标志码:A
文章编号:1002-1302(2023)20-0122-06
小麦赤霉病是我国小麦生产中的重要病害之一,主要由禾谷镰刀菌(Fusarium graminearum)侵染所致,该病害发生后不仅对小麦产量具有严重威胁,而且还能导致籽粒中毒素超标,进而又影响到人畜健康[1-3]。由于缺少高产优质的抗病品种,生产上主要采用化学药剂作为小麦赤霉病的主要防控措施,常用药剂包括多菌灵、氰烯菌酯等[3-4]。化学药剂的长期不合理使用,又加剧了生态环境污染以及农残超标问题。所以,为了满足我国小麦产业的绿色安全发展,对环境友好的生物防治措施日益受到人们的重视[5]。
目前,已有多种对禾谷镰刀菌具有良好生防活性的菌株被发现,如芽孢杆菌(Bacillus spp.)、假单胞菌(Pseudomonas spp.)及链霉菌(Streptomyces spp.)等多个类群[6-7]。刘悦等研究发现,解淀粉芽孢杆菌(B. amylolyticus)EA19发酵液可以抑制小麦赤霉病病菌的菌落生长和分生孢子萌发,而且对小麦赤霉病具有较好的防效[5]。解淀粉芽孢杆菌hzq1601不仅单独对小麦赤霉病具有防效,而且可以与50%多菌灵可湿性粉剂进行复配,从而实现减药增效作用[4]。虽然小麦赤霉病的生物防治研究已广泛开展,但依然缺少商业化产品的出现,我国只有枯草芽孢杆菌等少数产品登记用于小麦赤霉病的防治[8]。所以,筛选高效的生防菌株,并开展相关的应用研究对小麦赤霉病生防菌剂开发和利用具有重要作用[4]。
黄三素链霉菌(S. flavotricini)21-1是笔者所在实验室从蔬菜大棚土壤中分离获得的1株对禾谷镰刀菌具有良好拮抗能力的链霉菌菌株,但关于该菌株的发酵条件等内容未进行研究。因此,本研究主要围绕菌株21-1发酵条件和无菌发酵液稳定性等方面开展工作,以明确该菌株的应用潜力,为后期生防菌剂的开发和应用提供理论依据。
1 材料与方法
1.1 菌株
禾谷镰刀菌、黄三素链霉菌21-1,由河南科技学院资源与环境学院植物病理学实验室分离和保存。
1.2 培养基
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200.0 g、葡萄糖20.0 g、琼脂15.0 g、蒸馏水1 L,不加琼脂的为PDB培养基;高氏一号培养基:可溶性淀粉20.0 g、K2HPO4 0.5 g、NaCl 0.5 g、MgSO4·7H2O 0.5 g、KNO3 1.0 g、FeSO4·7H2O 0.01 g、琼脂15.0 g、蒸馏水1 L,不加琼脂的为高氏一号液体培养基;YG培养基:葡萄糖10.0 g、酵母提取物 10.0 g、蒸餾水1 L,pH值7.0;KMB培养基:蛋白胨20.0 g、甘油10 .0 g、K2HPO4 1.5 g、MgSO4·7H2O 1.5 g、蒸馏水1 L,pH值7.2;发酵培养基:葡萄糖25.0 g、蛋白胨25.0 g、酵母提取物5.0 g、MgSO4·7H2O 2.0 g、K2HPO4·3H2O 2.0 g、KH2PO4 2.0 g、CaCO3 5.0 g、蒸馏水1 L,pH值7.2。
1.3 不同发酵条件对菌株21-1无菌发酵液抑菌活性的影响
1.3.1 初始培养基 2022年3月于河南科技学院资源与环境学院植物病理学实验室开展相关试验,将2个1.0 cm大小的菌株21-1菌饼,分别置于 50 mL YG、高氏一号液体、PDB、KMB及发酵培养基中,28 ℃、180 r/min条件下培养5 d,得到菌株21-1的发酵液。将发酵液于12 000 r/min离心20 min,吸取上清液后,用0.22 μm微孔滤膜进行过滤,从而获得菌株21-1的无菌发酵液。将不同培养条件下获得的无菌发酵液,按照10%体积比与PDA培养基混合倒板,然后在平板中心接入0.5 cm禾谷镰刀菌菌饼。以加入无菌水的PDA培养基为对照,每个处理重复3次。25 ℃培养3 d,计算抑菌率,以确定最佳发酵初始培养基。抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.5 cm)×100%。
1.3.2 发酵时间 用发酵培养基对菌株21-1进行发酵培养,28 ℃、180 r/min条件下分别培养2、3、4、5、6、7 d,参考“1.3.1”节中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制效果,以确定最佳发酵时间。
1.3.3 发酵初始pH值 利用1 mol/L HCl和 1 mol/L NaOH分别将发酵培养基的pH值调整为3、5、7、9、11,然后用不同pH值的发酵培养基对菌株21-1进行培养,28 ℃、180 r/min条件下培养 5 d,参考“1.3.1”节中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制效果,以确定最佳发酵pH值。
1.3.4 发酵温度 用发酵培养基对菌株21-1进行发酵培养,分别在24、26、28、30、32 ℃,180 r/min条件下培养5 d,参考“1.3.1”节中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制效果,以确定最佳发酵温度。
1.3.5 装液量 在250 mL三角瓶中分别装入50、75、100、125、150 mL的发酵培养基,对菌株21-1进行发酵培养,28 ℃、180 r/min条件下培养5 d,参考“1.3.1”节中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制效果,以确定最佳装液量。
1.3.6 转速 用发酵培养基对菌株21-1进行发酵培养,分别在140、160、180、200、220 r/min,28 ℃条件下培养5 d,参考“1.3.1”节中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制效果,以确定最佳转速。
1.4 菌株21-1无菌发酵液的稳定性分析
1.4.1 热稳定性 将菌株21-1的无菌发酵液分别置于40、60、80、100 ℃条件下水浴30 min,冷却到室温后,参考“1.3.1”节中的方法分析不同无菌发酵液对禾谷镰刀菌的抑制效果。以未处理的无菌发酵液为对照,以不加无菌发酵液的PDA培养基为空白对照,计算不同无菌发酵液的相对抑菌率。相对抑菌率=(空白对照菌落直径-处理菌落直径)/(空白对照菌落直径-未处理菌落直径)×100%。
1.4.2 紫外线稳定性 将菌株21-1的无菌发酵液置于紫外灯下照射(功率40 W,距离30 cm),照射时间分别为30、60、120、240 min。以未处理的无菌发酵液为对照,以不加无菌发酵液的PDA培养基为空白对照,对相对抑菌率进行计算。
1.4.3 酸碱稳定性 将菌株21-1的无菌发酵液分别用1 mol/L HCl和1 mol/L NaOH调整pH值为3、5、7、9、11,室温静置4 h后,再将pH值调回7。以未处理的无菌发酵液为对照,以不加无菌发酵液的PDA培养基为空白对照,对相对抑菌率进行计算。
1.4.4 蛋白酶稳定性 在菌株21-1的无菌发酵液中分别加入1 mg/mL终浓度的胃蛋白酶、胰蛋白酶及蛋白酶K,37 ℃水浴2 h。以未处理的无菌发酵液为对照,以不加无菌发酵液的PDA培养基为空白对照,对相对抑菌率进行计算。
1.5 菌株21-1抗菌活性物质的PCR扩增
收集菌株21-1菌丝体,利用细菌基因组 DNA 提取试剂盒[天根生化科技(北京)有限公司]对基因组DNA进行提取,以基因组 DNA 为模板,利用通用引物K1(5′-TSAAGTCSAACATCGGBCA-3′)和M6R(5′-CGCAGGTTSCSGTACCAGTA-3′)、A(5′-TSGCSTGCTTGGAYGCSATC-3′)和B(5′-TGGAANCCGCCGAABCCGCT-3′)、A3F(5′-GCSTACSYSATSTACACSTCSGG-3′)和A7R(5′-SASGTCVCCSGTSCGGTAS-3′)分別对pks-Ⅰ、pks-Ⅱ及nrps基因进行扩增[9-10]。PCR反应体系为2×Taq PCR Mix 12.5 μL,上游引物和下游引物各 1.0 μL,DNA模板1.0 μL,ddH2O 9.5 μL。PCR反应条件为:95 ℃预变性3 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃ 延伸2 min,30个循环;72 ℃终延伸5 min。扩增产物利用1%浓度的琼脂糖凝胶电泳进行检测。
1.6 菌株21-1的防病效果分析
将小麦种子(百农307)无菌水清洗干净后置于铺有滤纸的培养皿内,25 ℃条件下保湿培养进行催芽,将出芽后的种子分别置于菌株21-1发酵液10倍、50倍及100倍稀释液中浸泡 12 h。处理后的种子用无菌刀片将小麦胚芽鞘尖端切除,再用脱脂棉蘸取1×106个/mL浓度的禾谷镰刀菌孢子悬浮液覆盖在芽鞘切口处。以无菌水浸种为对照,每个处理重复3次。25 ℃光暗交替(12 h—12 h)条件下培养,每天加入适量无菌水以使滤纸保持湿润,7 d后对胚芽鞘的发病情况进行观察。
2 结果与分析
2.1 不同发酵条件对菌株21-1无菌发酵液抑菌活性的影响
2.1.1 初始培养基对菌株21-1无菌发酵液抑菌活性的影响
菌株21-1在发酵培养基中培养后获得的无菌发酵液抑制作用最强,禾谷镰刀菌仅在菌饼上有少量菌丝生长,抑菌率达到100%;其次为PDB和KMB培养基,抑菌率分别为71.2%和70.3%;而高氏一号液体和YG所获无菌发酵液抑菌活性很低,抑菌率分别为10.9%和1.7%(图1)。从而说明,菌株21-1抑菌物质的产生与培养基组分有关,其中的发酵培养基可以更好地诱导该菌株产生抑菌物质。
进一步对发酵培养基所获得的无菌发酵液的抑菌效果进行分析,结果表明,无菌发酵液的体积比在1%时对禾谷镰刀菌的生长就具有明显的抑菌作用,抑菌率为57.0%;无菌发酵液体积比提高到2%时,抑菌率上升到72.1%;10%及20%体积比条件下,禾谷镰刀菌的菌丝生长完全受到抑制(图2)。
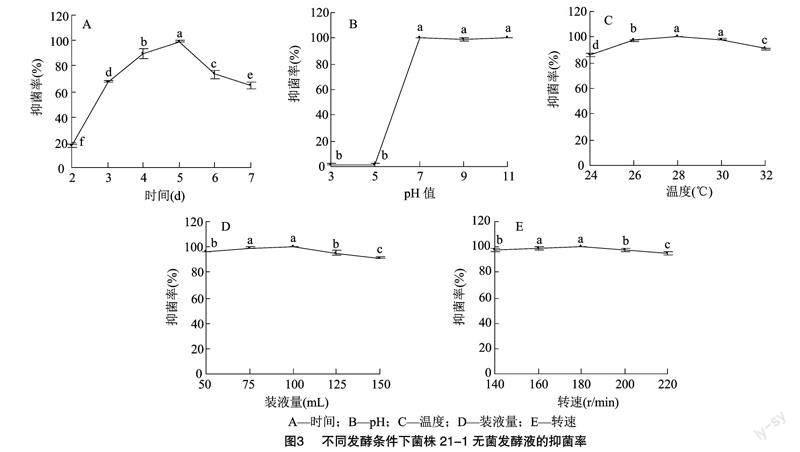
2.1.2 发酵时间对菌株21-1无菌发酵液抑菌活性的影响
菌株21-1在发酵培养基中培养2 d时,无菌发酵液对禾谷镰刀菌的抑菌效果较差,抑菌率仅为16.9%; 随着培养时间的延长 无菌发酵液的抑菌效果明显提高,5 d时达到最大;然后又出现下降,7 d时的抑菌率下降到64.5%(图3-A)。
2.1.3 发酵初始pH值对菌株21-1无菌发酵液抑菌活性的影响
在pH值为3、5的酸性条件下,菌株21-1在发酵培养基中的生长受到明显影响,并且无菌发酵液的抑菌率都不足2%;在中性及碱性条件下,无菌发酵液的抑菌效果不受影响,抑菌率都保持在100%左右(图3-B)。
2.1.4 发酵温度对菌株21-1无菌发酵液抑菌活性的影响
菌株21-1在24 ℃条件下培养时,无菌发酵液的抑菌率最低,为86.2%;随着培养温度的提高,无菌发酵液的抑菌率也有所上升,在28 ℃和30 ℃时,抑菌率都在98%以上;但温度为32 ℃时,抑菌率下降到91.2%(图3-C)。
2.1.5 装液量对菌株21-1无菌发酵液抑菌活性的影响
在装液量为50 mL时,菌株21-1无菌发酵液的抑菌率为96.0%;装液量提高到75、100 mL时,无菌发酵液的抑菌率最高,都在99%以上;但随着装液量的继续增多,抑菌率出现下降,150 mL 时的抑菌率只有91.3%(图3-D)。
2.1.6 转速对菌株21-1无菌发酵液抑菌活性的影响
在转速为140 r/min条件下,菌株21-1无菌发酵液的抑菌率为97.1%;转速提高到160、180 r/min 时,无菌发酵液的抑菌率都保持在99%以上;但随着转速的提高,抑菌率有所下降,220 r/min 时的抑菌率为94.8%(图3-E)。以上结果说明,菌株21-1发挥其抑菌活性的适合发酵时间为5 d,pH值为中性及碱性,温度为28~30 ℃,装液量为75~100 mL/250 mL,转速为160~180 r/min。
2.2 菌株21-1无菌发酵液的稳定性分析
菌株21-1无菌发酵液经40 ℃处理后,抑菌效果不受影响,但随着温度升高,相对抑菌率逐渐下降;100 ℃处理后,相对抑菌率下降到33.5%(图4-A)。利用紫外线对菌株21-1无菌发酵液进行照射,在30~240 min时间内,相对抑菌率都保持在90%左右(图4-B)。在pH值为3~9的条件下,菌株21-1无菌发酵液的抑菌效果不受影响,相对抑菌率保持在100%左右;但在pH值为11的强碱条件下,相对抑菌率有所下降,为95.1%(图 4-C)。菌株21-1无菌发酵液分别用胃蛋白酶、胰蛋白酶及蛋白酶K处理后,相对抑菌率都保持在98%左右(图4-D)。以上结果表明,菌株21-1无菌发酵液中的活性物质具有良好的稳定性。
2.3 菌株21-1抗菌活性物质的PCR检测
聚酮合成酶(polyketide synthase,简称PKS)和非核糖体多肽合成酶(non-ribosomal peptide synthetase 简称NRPS)是调控聚酮类物质和非核糖体多肽合成的关键酶[11]。PCR扩增后的电泳结果显示,菌株21-1中扩增到pks-Ⅰ和pks-Ⅱ基因,而nrps基因没有被扩增成功(图5),由此说明,菌株21-1具有聚酮合酶相关基因,并可能产生相应的抗菌活性物质。
2.4 菌株21-1的防病效果分析
小麦胚芽鞘接种结果表明,对照组的胚芽鞘出现明显的褐色病斑。而分别用菌株21-1发酵液10倍、50倍及100倍稀释液处理后的胚芽鞘仅在切口处出现变色,未见病斑的扩展(图6)。由此说明,菌株21-1对禾谷镰刀菌侵染小麥胚芽鞘的过程具有一定的抑制作用。
3 讨论与结论
由于放线菌活性物质数量和开发程度较高,从而被广泛用于植物病害的生物防治。生防菌活性物质产业化的基础为发酵,对发酵条件进行优化是提高生防菌抑菌效果的重要方式[12]。本研究以黄三素链霉菌21-1对禾谷镰刀菌的抑菌活性为指标,通过发酵初始培养基类型的筛选,明确了菌株21-1的最适培养基为发酵培养基。由于发酵培养基培养获得的菌株21-1无菌发酵液具有较好的抑菌能力,1%体积比条件下的抑菌率仍然可以达到57.0%,所以本试验未涉及碳源、氮源及无机盐的优化。由于培养基不同组分之间存在复杂的相互作用,而且也决定了发酵水平和经济成本[13]。所以后续还应开展相关物质种类及组成的优化试验。
研究表明,适合的发酵条件对菌体代谢物的产生具有重要作用,而且影响不同链霉菌抑菌活性物质产生的发酵条件各有不同[12,14]。例如直丝紫链霉菌(S. rectiviolaceus)A8最适发酵温度为28~31 ℃,发酵时间为8 d,初始pH值为7~8,装液量为100~200 mL[15。小串链霉菌(S. catenulae)XG40最佳发酵温度为28 ℃,发酵时间为6 d,起始pH值为7.0,装液量为100 mL[16]。本研究采用单因素试验发现,菌株21-1发挥最佳抑菌活性的适宜发酵时间为5 d,pH值为中性及碱性,温度为 28~30 ℃,装液量为75~100 mL,转速为160~180 r/min。其中,发酵时间及pH值对菌株21-1抑菌活性的影响较大,而温度、装液量及转速等发酵条件对抑菌活性的影响不大。牛倩云等发现,黄三素链霉菌A26发酵7 d时的无菌发酵液对谷瘟病菌抑菌效果最好[17]。同一种类的不同菌株在发酵条件方面存在差异,推测可能与菌株遗传特征和病原靶标抑菌活性评价不同有关。
抑菌活性物质是否具有稳定性对菌剂生产和制备十分重要,菌剂在田间使用时会受到光照、温湿度等多种环境因素的影响[18]。吕昂等研究发现,链霉菌3-10的发酵液和提取物对80 ℃以上的高温敏感,耐酸但不耐碱,也不耐受紫外线的长时间照射[18]。张雨阳等指出,黄三素链霉菌15-6发酵液经80 ℃以上的高温、酸性或碱性以及紫外光照射处理后,对芒果胶孢炭疽菌(Colletotrichum gloeosporioides)的抑菌效果会出现降低,但耐受蛋白酶及金属离子的处理[19]。在本研究中,菌株21-1无菌发酵液经80 ℃水浴处理后相对抑菌率下降到81.0%,但在pH值为3~11、紫外线照射时间及3种蛋白酶处理条件下的相对抑菌率几乎不受影响。推测稳定性存在差异可能与菌株来源、培养条件或处理方式不同有关。
研究表明,链霉菌能够通过聚酮合酶和非核糖体多肽合成酶途径合成抗菌活性物质[20]。欧洲疮痂链霉菌(S. europaeiscabiei)F5基因组中含有 pks-Ⅰ和NRPS基因,说明该菌株可能通过合成聚酮类和非核糖体肽类抗生素发挥其抑菌作用[11]。本研究通过PCR检测发现菌株21-1具有pks-Ⅰ和pks-Ⅱ基因,从而推测除该菌株具有合成相应物质的能力。但是菌株21-1也可能利用其他途径或抑菌机制实现其抑菌效果,所以,对于菌株21-1的活性物质及抑菌机制还有待于进一步分析。
参考文献:
[1]程顺和,张 勇,别同德,等. 中国小麦赤霉病的危害及抗性遗传改良[J]. 江苏农业学报,2012,28(5):938-942.
[2]廖 森,方正武,张春梅,等. 小麦抗赤霉病遗传与机理研究现状与展望[J]. 江苏农业科学,2021,49(19):51-56.
[3]陈 云,王建强,杨荣明,等. 小麦赤霉病发生危害形势及防控对策[J]. 植物保护,2017,43(5):11-17.
[4]张 震,邱海萍,柴荣耀,等. 一株小麦赤霉病生防菌的鉴定及其生防机制初探[J]. 中国生物防治学报,2022,38(3):673-680.
[5]刘 悦,曾凡松,龚双军,等. 解淀粉芽孢杆菌EA19菌株对小麦赤霉病的防治效果[J]. 植物保护学报,2020,47(6):1270-1276.
[6]Dweba C C,Figlan S,Shimelis H A,et al. Fusarium head blight of wheat:pathogenesis and control strategies[J]. Crop Protection,2017,91:114-122.
[7]陈文华,殷宪超,武德亮,等. 小麦赤霉病生物防治研究进展[J]. 江苏农业科学,2020,48(4):12-18.
[8]王 苹,吴佳文,张海波,等. 我国防治小麦赤霉病的药剂种类评析[J]. 中国植保导刊,2021,41(1):56,71-76.
[9]Ayuso-Sacido A,Genilloud O. New PCR primers for the screening of NRPS and PKS-I systems in actinomycetes:detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J]. Microbial Ecology,2005,49(1):10-24.
[10]关统伟,滕 芸,任 丹,等. 罗布泊盐湖可培养放线菌多样性及PKSⅡ功能基因筛选[J]. 生物技术,2014,24(5):67-71.
[11]郑文艺,韩海燕,崔海超,等. 欧洲疮痂链霉菌F5的鉴定及其抗菌活性[J]. 微生物学通报,2022,49(6):2111-2123.
[12]瞿 佳,孙晓宇,陈 锐,等. 核桃黑斑病拮抗放线菌WMF106发酵条件优化和抑菌物质稳定性[J]. 微生物学通报,2022,49(1):88-100.
[13]杨李玲,黄绵佳,张锡炎,等. 香蕉枯萎病生防链霉菌DJ15发酵条件的优化[J]. 热带生物学报,2016,7(3):343-347.
[14]Yang Y C,Guan Z B,Ding Y R,et al. Fermentation optimization,cloning and sequence analysis of the laccase gene from Shiraia sp. SUPER-H168[J]. Annals of Microbiology,2015,65(1):575-583.
[15]王明环,孙爱丽,赵联晶,等. 直丝紫链霉菌A8发酵条件优化、活性成分初步分析及对水稻纹枯病的防效研究[J]. 中国生物防治学报,2021,37(4):804-816.
[16]赖宝春,戴瑞卿,曾天宝,等. 小串链霉菌XG40菌株发酵条件优化及其次生代谢产物性质研究[J]. 中国生物防治学报,2022,38(5):1242-1251.
[17]牛倩云,刘丽青,孙 硕,等. 谷瘟病菌拮抗放线菌的筛选、鉴定及抑菌活性[J]. 山西农业科学,2017,45(9):1525-1529.
[18]吕 昂,吴明德,张 静,等. 链霉菌3-10发酵液及提取物的稳定性研究[J]. 中国生物防治学报,2022,38(1):250-257.
[19]張雨阳,魏有海,郭良芝,等. 黄三素链霉菌15-6发酵液的抑菌活性研究[J]. 湖南农业科学,2021(9):25-28,41.
[20]王 浩,刘 宁,黄 英. 放线菌模块型聚酮合酶的系统发育组学分析及其在聚酮类化合物筛选中的应用[J]. 微生物学报,2010,50(10):1293-1304.
收稿日期:2022-12-13
基金项目:河南省科技攻关项目(编号:222102110066)。
作者简介:张 强(1986—),男,甘肃陇西人,博士,讲师,主要从事植物病害生物防治研究。E-mail:zhangqiang4503@163.com。

