基于SVR和BP神经网络算法通过IOL Master 700测量数据来预测白内障术后CW弦
李 晨
0 引言
在屈光性白内障手术中,特别是使用焦深延展型(extended depth of focus,EDOF)或多焦点人工晶状体(IOL)时,较大的alpha角或kappa角都会对完美的视力预后产生负面影响。许多学者建议在白内障术前测量这些参数,以便评估患者的眼部条件并为植入合适的IOL提供参考[1-3]。在一个具有同轴对齐光学元件的模型眼中,光轴被定义为通过所有光学元件表面曲率中心的轴,它与所有光学元件的表面垂直相交。视轴被定义为当眼睛注视某一点时,光线由该固定点到眼内黄斑中心凹的连线。视线定义为光线自固定点经瞳孔中心至黄斑中心凹的连线[4]。alpha角是指在光轴和视轴之间形成的夹角;kappa角是指瞳孔轴和视轴之间的夹角。由于眼的光学元件在现实中并不是同轴排列的,且难以测量参考节点,光轴、视轴均无法真实测得,alpha角和kappa角在临床上很难明确。不同设备对alpha角和kappa角的定义及测量方法也不尽相同。2014年,Chang和Waring[4]建议提取角膜缘、瞳孔缘和浦肯野反射图像和瞳孔中心这些相对的位置,将受试者注视的同轴光反射作为眼部轴线的临床标记,从而确定了Chang-Waring弦(CW弦)的距离和方向,以此来替代alpha角和kappa角这两个令人困惑的术语。CW弦相比于传统的alpha角和kappa角的优势在于其大小并不受瞳孔直径和眼内晶状体形态的影响,且无需测量眼内参考节点[5]。目前临床上很多的眼部生物测量仪器或角膜地形图仪可以直接测得CW弦的数值[6-8]。然而,目前对于白内障手术前后CW弦的变化情况及如何在术前对术后CW弦进行评估的报道较少。本研究的目的在于分析CW弦在白内障手术前后的变化情况,通过IOL Master 700测量术前CW弦及其他眼部生物参数建立基于SVR和BP神经网络的预测模型,并对术后CW弦进行准确预测。为评估患者眼部条件及选择合适的IOL提供临床依据。
1 对象和方法
1.1对象回顾性研究。连续纳入2022-01/12来自苏州大学附属第一医院的白内障患者304例304眼,其中左眼159眼,右眼145眼。所有患者如双眼先后手术则只纳入1眼。纳入标准:年龄在50岁以上的Ⅱ~Ⅳ级核的白内障患者,术前及术后都能配合完成光学生物测量并获得研究所需的所有参数。排除标准包括斜视、弱视、眼球震颤等导致固视困难、眼部手术史、角膜异常、既往眼外伤史、青光眼、葡萄膜炎史、术前生物测量不可靠或无法检测以及不能及时随访的患者。手术前已获得每位患者的知情同意。所有的研究方法都符合《赫尔辛基宣言》的规定。本研究已在临床试验注册处注册,并已通过苏州大学附属第一医院伦理委员会审核[(2020)伦研批第038号]。
1.2方法
1.2.1数据的预处理所有患者的术前及术后3mo的测量数据通过IOL Master 700软件导出,提取我们分析所需的相关参数,包括:年龄、眼别、眼轴长度(AL)、角膜中央厚度(CCT)、前房深度(ACD)、晶状体厚度(LT)、白到白距离(WTW)、角膜中心相对于浦肯野反射I像(PI像)的位置(Ix/Iy),瞳孔中心相对于PI的位置(Px/Py),CW弦(CWx/CWy),角膜前表面曲率(K1、K2)。当测量质量检查中缺失数据或数据出现“失败”“警告”等,或者在散瞳情况下检测的数据,或者手术前后瞳孔直径变化大于1.5mm的数据予以排除。在检查成功测量后,将数据集传输到Metlab软件进行进一步处理。
角膜前表面屈光力通过角膜平均曲率(AvgK)(K1和K2的算术平均数)及角膜前表面散光的矢量值(KJ0和KJ45)来表示,根据Thibos散光向量分析法[9-10],Thibos法可将散光的屈光度转换为M、J0、J45、B 4个参数。根据以下公式:M=S+C/2;J0=(-C/2)×cos2α;J45=(-C/2)×sin2α;Overall blur vector(B)=(M2+J02+J452)1/2。其中J0和J45分别代表在轴向90°和180°以及在轴向45°和135°的散光值。M为等效球镜,S为球镜的屈光度,C为柱镜的屈光度,α为柱镜的轴向;B为估计屈光度异常引起视物模糊的指数。
为了预测右眼术后CW弦的2个矢量成分CWx和CWy值,本文分别采用BP神经网络和支持向量回归(SVR)两种模型进行预测和误差对比分析。两种模型的训练样本都采用10个特征参数:术前CWx、术前CWy、术前AvgK、术前KJ0、KJ45、术前AL、术前CCT、术前ACD、术前LT和术前WTW,训练样本数据集145个,测试样本数据集145个。两种预测模型都先使用训练数据集进行训练,然后使用测试数据集进行验证。
1.2.2建立SVR模型SVR模型的输入样本维度是145×10,输出样本维度为145×1,对训练、测试样本数据分别进行归一化预处理,将数据规整到[-1,1]。使用SVR模型分别建模对术后CWx和CWy的值进行预测。其中,模型的惩罚参数c、核参数g分别取值200、10,模型容忍误差取值0.01。
例 13 众人拾柴火焰高。 我们欢迎更多台湾同胞参与到推动两岸关系和平发展的行列中来,大家一起努力。[1]239
1.2.3建立BP神经网络模型BP神经网络的输入样本维度是145×10,输出样本维度是145×2,对训练、测试样本数据分别进行归一化预处理,将数据规整到[-1,1],通过BP神经网络模型同时对术后CWx和CWy的值进行预测。BP神经网络采用输入层、隐含层、输出层三层结构,其中隐含层有10个神经元,学习率0.01,训练目标最小误差0.01,网络使用Levenberg-Marquardt反向传播算法训练。
1.2.4验证过程将BP神经网络和SVR模型预测的术后CWx和CWy与IOL Master 700测量的实际术后CW弦值进行比较,并通过均值、标准差、中位数、5%分位数、95%分位数来定量对比SVR模型和BP神经网络的预测误差。
统计学分析:所有统计分析均采用SPSS软件21.0。为了评估总体的正态性,进行了Shapiro-Wilk正态性检验。采用Bland-Altman分析进行一致性分析。P<0.05为差异有统计学意义。
2 结果
2.1患者概况本研究纳入白内障患者304例304眼,其中女190例,男114例;左眼159眼,右眼145眼;平均年龄68.40±10.10岁。表1为所有患者白内障术前眼部参数,包括AvgK,散光矢量结果(KJ0,KJ45),AL,ACD,LT,CCT,WTW,瞳孔中心相对于PI的位置(Px/Py),角膜中心相对于PI的位置(Ix/Iy),以及目标变量CW弦(CWx/CWy)。对于这些描述性资料,表1提供了算术平均数、标准差、中位数及5%和95%可信区间水平。
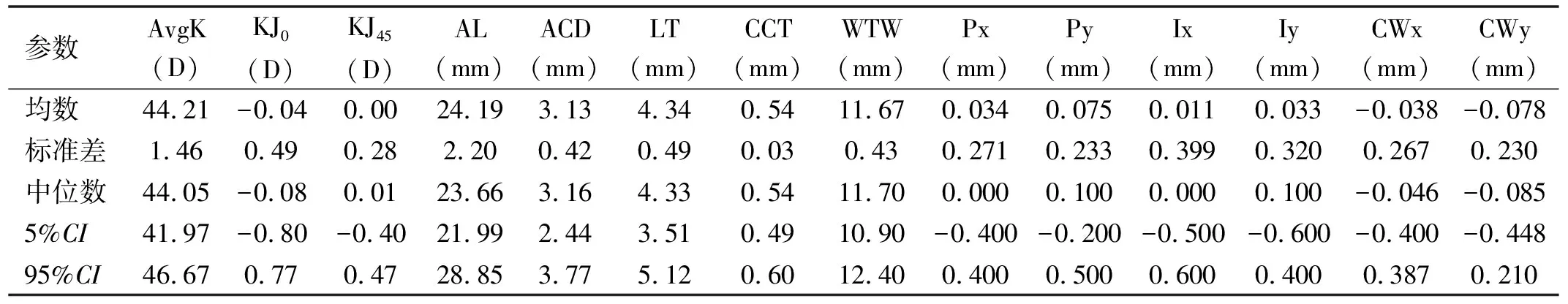
表1 白内障患者术前的眼部参数
2.2SVR和BP神经网络对于术后CW弦的预测性能的比较为了观察SVR和BP神经网络对于术后CW弦的预测性能。我们选择了所有右眼的数据进行进一步分析。表2显示了通过IOL Master 700测得的所有右眼的术后实际CW弦的数据以及由术前测量参数(包括AL,ACD,LT,CCT,WTW及术前CW弦)通过SVR和BP神经网络预测的数值,以及各自的预测误差。SVR算法对两个CW弦分量的预测误差分别为0.002和0.000,BP神经网络对两个CW弦分量的预测误差分别为0.001和0.001,与目标值相比,SVR和BP神经网络的预测结果都表现出良好的性能。其中,SVR相比于BP神经网络有更好的预测性能。
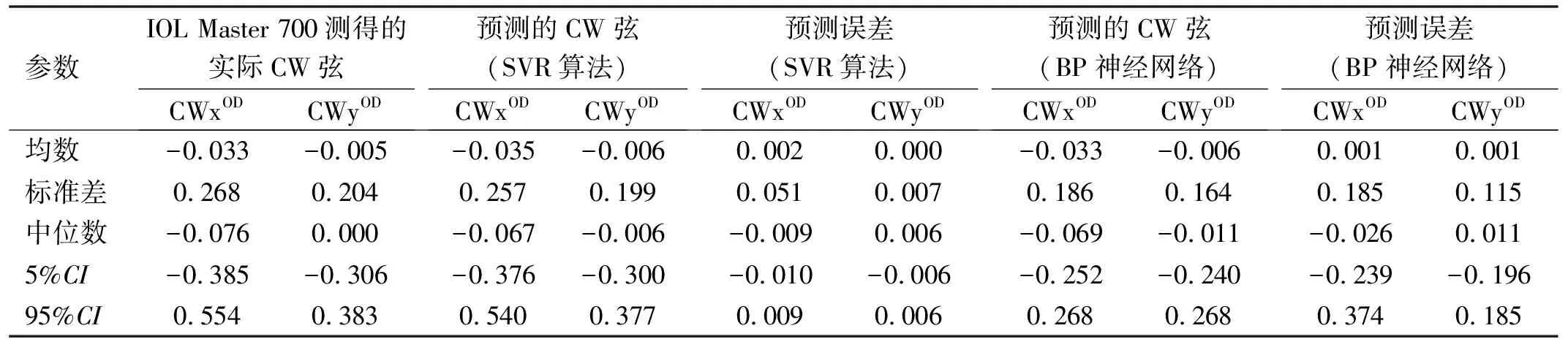
表2 IOL Master 700测得的所有右眼的实际CW弦和通过SVR和BP神经网络预测的CW弦以及各自的预测误差 mm
2.3白内障手术前后CW弦的变化图1为所有患者术前及术后CW弦的X分量和Y分量的散点和分布情况。X分量分布显示,左眼(红色实线:术前;蓝色实线:术后)和右眼(绿色虚线:术前;紫色虚线:术后)之间存在有一些差异;在术前,大多数左眼CW弦X分量为正值,大多数右眼CW弦X分量为负值。术后与术前相比,左右眼的数值更接近于0,表明在术后PI更接近于瞳孔中心。且术后CW弦X分量的分布更集中,说明术后X分量的变化较术前更小。Y分量分布显示,左右眼之间的差异较小,左眼(红色实线:术前;蓝色实线:术后)大多数值为负值,右眼(绿色虚线:术前;紫色虚线:术后)数值更接近于0,左右眼在术前及术后的变化也相对较小。
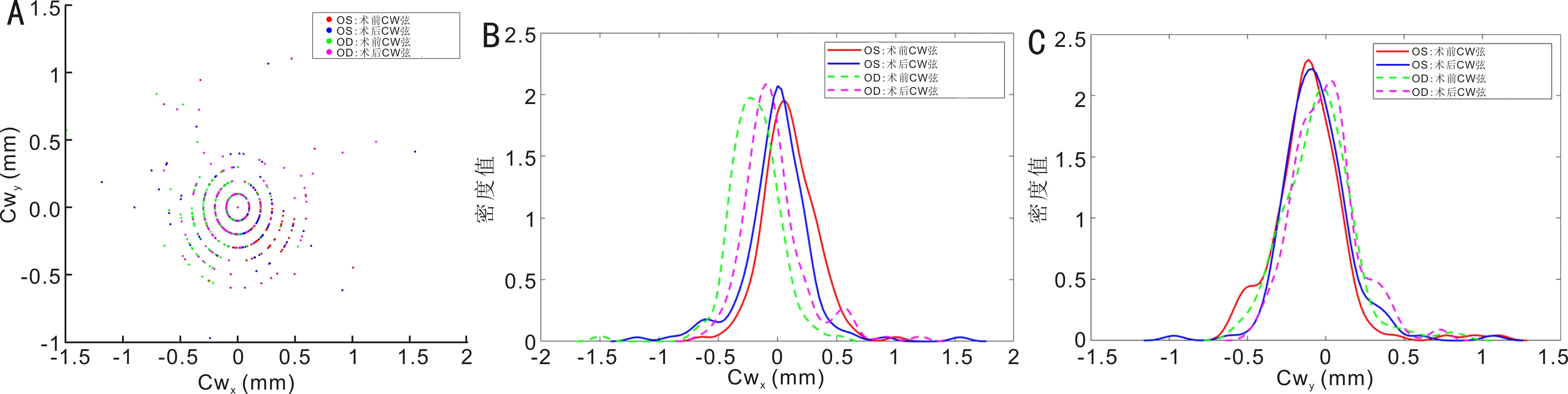
图1 IOL Master 700测量的白内障患者左右眼及术前、术后CW弦
为了更好地观察手术前后CW弦的变化情况,我们收集了所有右眼的数据进行分析。图2显示术后(黄点)的数值的分布比术前(蓝点)更接近于0,表明在白内障术后PI更接近于瞳孔中心。术前较术后情况下的置信度椭圆的纵横比更小(术前:蓝色椭圆:纵轴0.57mm,横轴0.52mm,纵横比:1.10;术后:绿色椭圆:纵轴0.67mm,横轴0.48mm,纵横比:1.40)。
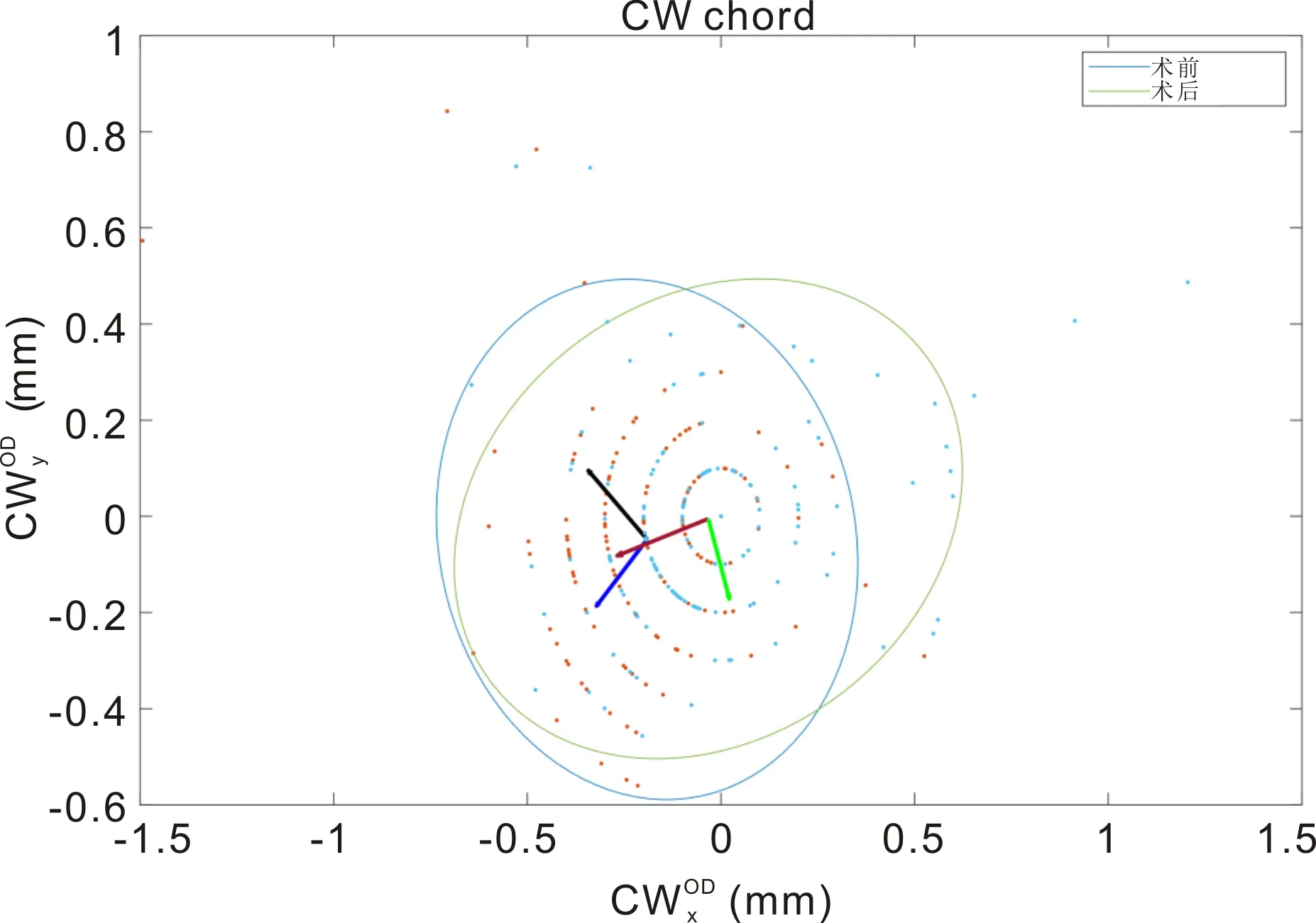
图2 IOL Master 700测量的白内障患者右眼的术前及术后CW弦
2.4SVR和BP神经网络对CW弦预测值与实际值的比较我们进一步通过术前CW弦和其他眼部生物参数,应用SVR算法和BP神经网络预测术后CW弦的结果,不管是X分量(图3A)还是Y分量(图3B),BP神经网络预测系统低估了IOL Master 700术后测量的CW弦,蓝色椭圆长轴的方向比紫色参考线更平坦。X分量和Y分量的椭圆分别为:(1)X分量:BP神经网络:椭圆纵轴0.76mm,横轴0.28mm,纵横比2.71;SVR预测模型:椭圆纵轴0.90mm,横轴0.09mm,纵横比10.00。(2)Y分量:BP神经网络:椭圆纵轴0.63mm,横轴0.17mm,纵横比3.71;SVR预测模型:椭圆纵轴0.70mm,横轴0.01mm,纵横比70.00。图4通过术后实际CW弦的数值与预测值的比较可以看出应用SVR算法相比与BP神经网络,能够更好的对术后CW弦进行预测。图5通过Bland-Altman分析显示了相较于BP神经网络,SVR算法预测的结果与实际值具有更好的一致性。
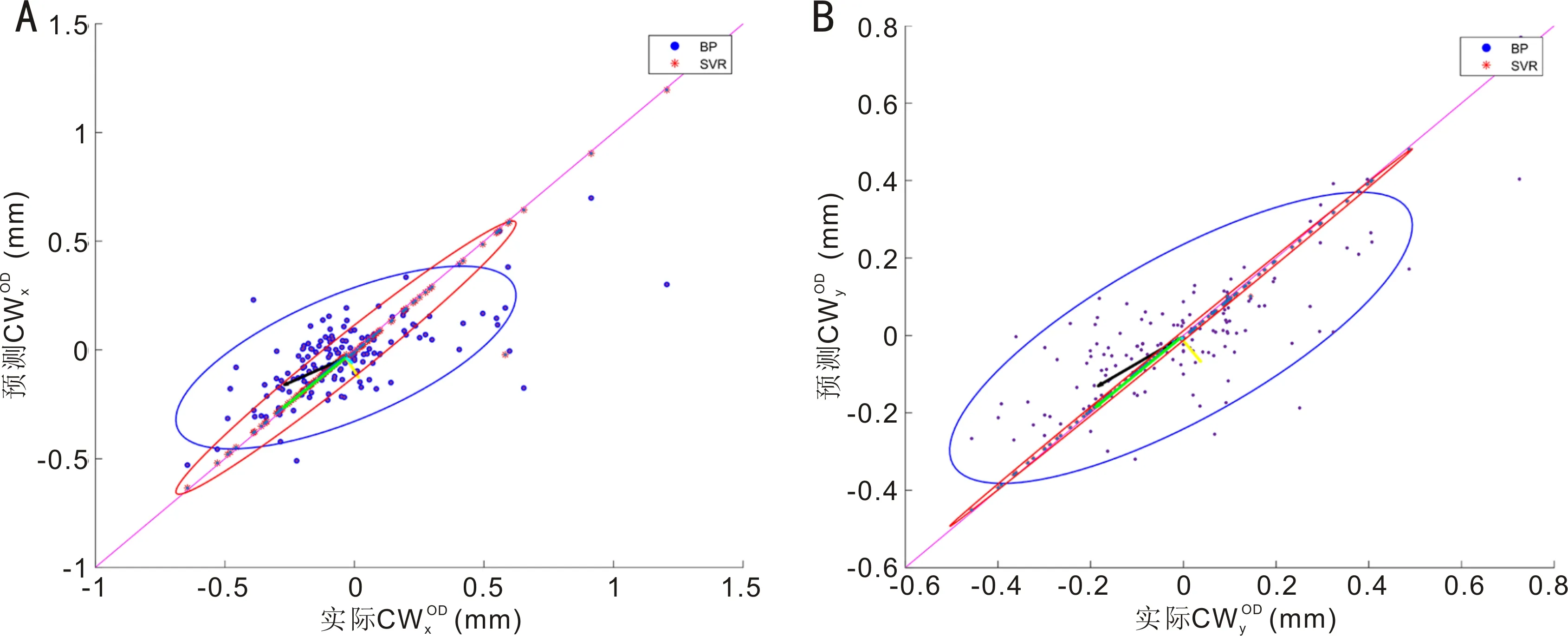
图3 预测的术后CW弦与术后实际CW弦的X分量和Y分量的比较
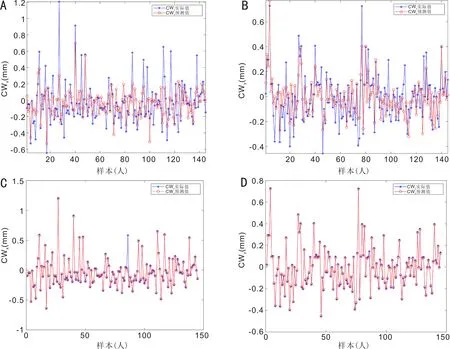
图4 预测的CW弦与术后实际CW弦的比较
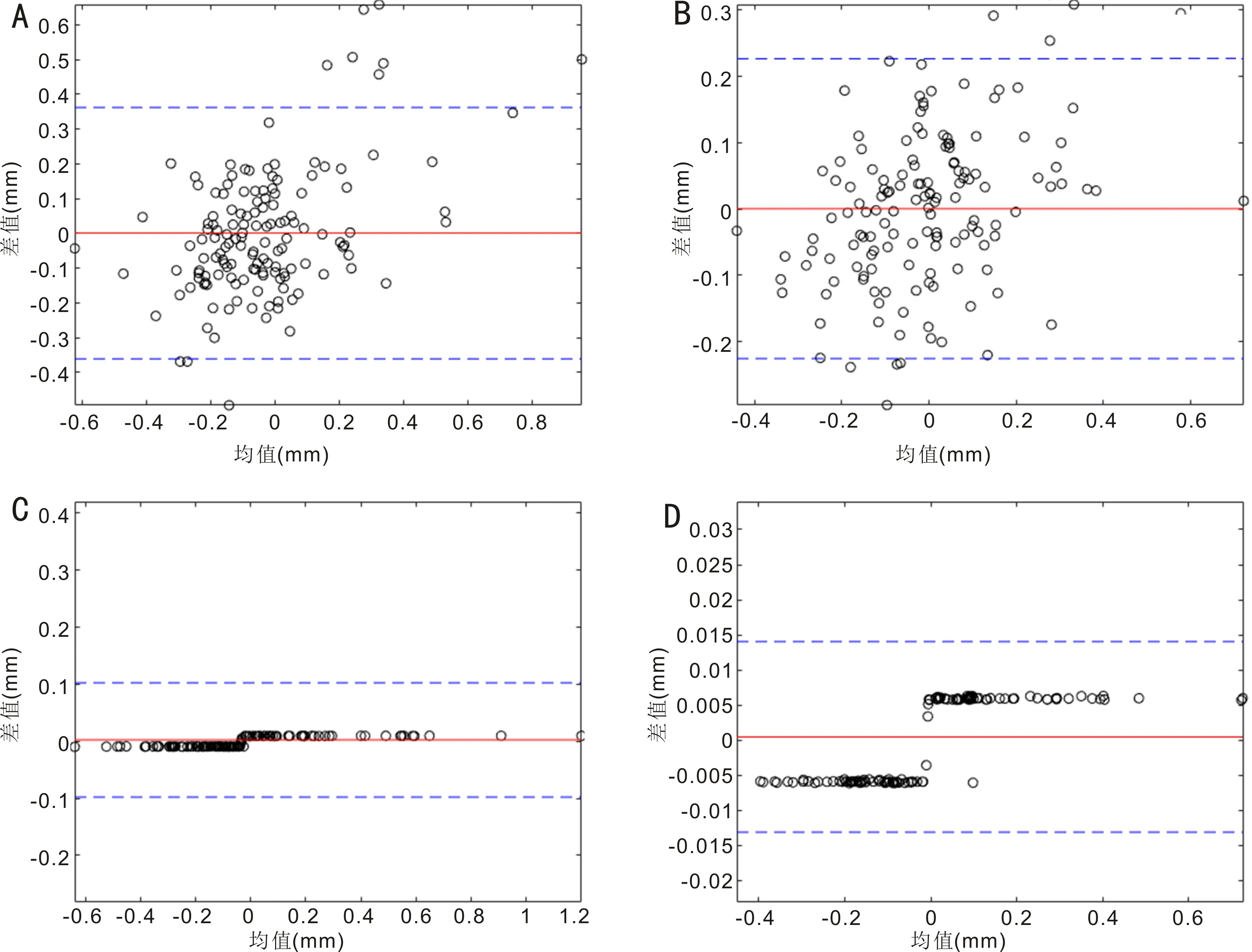
图5 采用BP神经网络和SVR算法预测的CW弦与术后实际CW弦一致性的比较
3 讨论
以往很多文献讨论了关于alpha角和kappa角对白内障手术预后的影响[1-2,11-14],但对这些角度的定义常常令人困惑。在非同轴光学系统中,光轴和视轴都很难真实测得,由于没有明确的参考轴,这些角度往往难以评估。且不同的测量仪器测量这些角度原理不一样,正常值范围也往往存在差异。Chang和Warring[4]在2014年发表的文章中建议使用距离来反映PI相对于瞳孔中心的位置,该距离可以通过基于同轴固定光测量的光学测量仪器直接获得,被命名为CW弦。与传统的alpha角和kappa角相比,CW弦的优点是只要使用远距离的同轴光源,测量结果与使用何种测量设备并没有太大的关系。且多数的角膜地形图仪、断层摄像设备或光学生物测量设备都可以测量患者固视下的距离和角膜曲率,因此,可以通过处理瞳孔轮廓及源自角膜前表面的PI像直接从测量的数据中提取CW弦。
浦肯野光反射PI像并不是在角膜的前表面形成的,而是在无限远的同轴光源与角膜交点处及角膜前表面曲率中心之间的距离的一半(大约是角膜前表面后3.85mm)处形成的。因此,CW弦不能直接转换为alpha角或kappa角。根据以往研究报道,1mm CW弦长约为7.5°的kappa角[15]。CW弦的标准值为0.34±0.16mm,我们观察到的术前平均CW弦为0.32±0.21mm,术后平均CW弦为0.29±0.21mm。术前CW弦与以往的报道差别不大,术后CW弦较术前相对减小,提示手术可能对CW弦的数值产生影响。
在之前的研究中发现,多焦点IOL术后满意度差的原因之一与kappa角有关。2011年Prakash等发现较大的kappa角会增加多焦点IOL植入后的光干扰的程度[11]。大角度的kappa角可能与彗差相关,彗差本身会加重光干扰的程度[16]。目前推荐在植入多焦点IOL之前对kappa角进行评估,一些较大kappa角(>0.6mm或大于IOL中央衍射部分半径)应谨慎植入多焦点IOL[17]。目前尚不清楚是什么原因导致kappa角的变化。可能的原因包括:手术本身(超声能量或药物毒性)可能会对虹膜造成一定损伤,从而导致瞳孔的形状、位置和直径发生变化;当术前白内障为皮质型或局部后囊下型时,由于晶状体的不均匀混浊,术前和术后的视轴发生较明显的改变,从而引起kappa角的变化。然而,目前对于CW弦在白内障术前术后变化的报道较少,Langenbucher等[18]报道白内障术后与术前相比,CW弦显示出向上和向鼻侧的位移变化。在本文中,我们采集了白内障患者术前、术后的生物参数及CW弦,我们发现相比于白内障手术前,手术后左、右眼CW弦X分量向颞侧有轻微偏移;Y分量变化不大。PI在术后与术前相比更靠近瞳孔中心。
鉴于CW弦在白内障手术尤其是植入高端IOL时的重要性,我们试图从白内障术前测量获得的一些常规生物参数(角膜曲率、散光值、AL、ACD、LT、CCT和WTW)和术前CW弦预测出白内障术后CW弦的数值。2021年Langenbucher等[18]采用多元线性回归法和前馈神经网络的方法通过术前CW弦及眼部生物参数对术后CW弦进行预测,但并没有获得满意的预测结果。本文中,我们采用了SVR算法和BP神经网络,其预测精度较既往文献大大提高,两者均显示了较好的预测结果,相比于BP神经网络,SVR算法显示出更好的预测精度。CW弦X分量的预测误差值SVR算法为0.002±0.051mm;BP神经网络为0.001±0.185mm,Y分量的预测误差的方差值SVR算法为0.000±0.007mm;BP神经网络为0.001±0.115mm。
总之,CW弦的数值可以通过在同轴固定光源的光学生物测量仪、角膜地形图仪或断层摄像仪获取。在白内障术后CW弦会发生变化。在白内障术前,我们可以通过测量术前CW弦和其他生物学参数,应用人工智能的方法如SVR算法来预测术后CW弦的大小。

