积雪草苷多功能型水凝胶支架制备及对细胞黏附和三维培养的应用价值
王田田,贺 钢,何 茹,文誉龙,严 晨,胡佳欣,杨朝鲜
西南医科大学基础医学院(泸州 646000)
水凝胶是高度水溶胀的分子网络,具有良好的生物相容性和可降解性,是创建组织模拟物的理想平台。此外,生物相容性良好的特性能把引起组织炎症反应的可能性降到最低[1]。到目前为止,已有海藻酸钠作为支架材料进入临床试验,在创伤修复方面已取得较大进展[2-4]。但传统制得的海藻酸钠水凝胶缺乏强度,容易发生永久性断裂,而且它们内部的结构简单,缺乏特殊的功能,这很大程度上导致海藻酸钠在组织工程中的应用停留在细胞及动物实验阶段[5-7]。
为满足临床实际需求,开发生物相容性良好、无副作用的功能型水凝胶是本领域需求的重点[8-11]。研究发现,海藻酸钠能和光敏感基团发生交联凝胶化,形成强粘附多功能混合水凝胶[12]。而对于海藻酸钠水凝胶强度较低的问题,中药单体可以提高水凝胶的物理特性,获得多功能型水凝胶[13-16]。在这一凝胶体系中,中药单体既是药效分子,又能充当递送载体,表现出良好的自缓释性和生物相容性[17]。
积雪草苷是从伞形科积雪草的全草中提取出来的中药单体。积雪草苷的研究揭示这种中药单体除了治愈皮肤损伤,在伤口愈合过程中还起到修复因炎症堆积引起的皮肤老化和增强皮肤弹性的作用[18]。此类天然药物小分子不需要任何修饰,通过交联剂和海藻酸钠形成水凝胶,提高其机械特性的同时,对传统支架材料的生物相容性也有促进作用[19]。基于此,本研究以甲基丙烯酸酐化海藻酸钠为支架材料、N-乙烯基吡咯烷酮(N-Vinyl-2-pyrrolidone,NVP)和积雪草苷为造孔剂,制备负载中药单体的海藻酸钠水凝胶,表征其基本理化性质,并从机械特性、生物相容性、细胞共培养等方面评价其性能,制备积雪草苷多功能型水凝胶支架。这是首次利用积雪草苷中药单体与甲基丙烯酸酐化海藻酸钠发生交联共聚反应,通过反复冷冻-解冻法把这种交联共聚固定下来,形成稳定的网络状水凝胶,从而改善凝胶成胶后的稳定性及机械强度。
1 实验与方法
1.1 材料、试剂与仪器
海藻酸钠,盐酸,NVP,氢氧化钠,甲基丙烯酸酐(均为分析纯,天津市科密欧化学试剂有限公司);Dulbecco's Modified Eagle Medium(DMEM)培养基,胎牛血清(fetal bovine serum,FBS)等均购自笛柏生物科技有限公司。
1.2 水凝胶的制备
在参考相关文献[20]和前期实验的基础上已确定海藻酸钠、甲基丙烯酸酐、NVP的最佳比例。现确定积雪草苷的最佳浓度,分别制备0、2、4、6、8 mg/mL积雪草苷复合水凝胶。观察积雪草苷浓度对成胶的影响,确定到最适浓度。具体方法如表1。
本实验共制备6个样品,按表1配的不同浓度水凝胶。以甲基丙烯酸酐化海藻酸钠水凝胶为实验对照组,记Gel-1,加入NVP 和积雪草苷的水凝胶记Gel-2。以反复冷冻-解冻法制备水凝胶,具体过程为将配制的水凝胶EP 管放入-20℃的冰箱中冷冻24 h 后于4℃自然解冻,循环3 次。确保交联彻底完成。
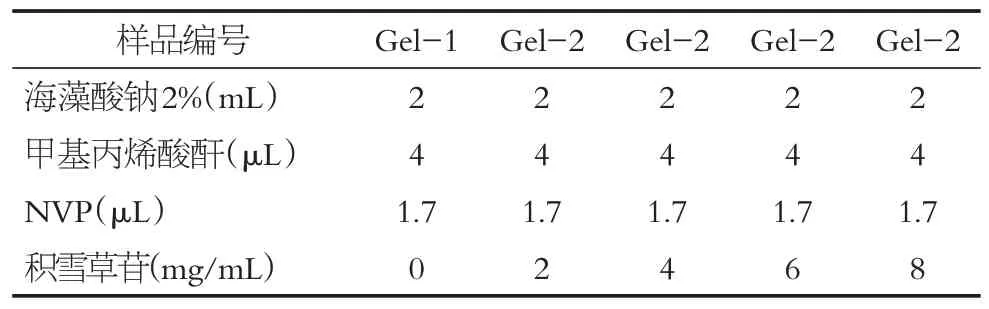
表1 水凝胶的组成(单位:mL)Table 1 Composition of the hydrogel(unit:mL)
1.3 测试与表征
1.3.1 成胶及pH的测定 采用试管倾斜法比较各水凝胶的成胶状态。用试管量取2 mL各组水凝胶,温度条件为37 ℃。将试管倒置,观察水凝胶的流动性能,若不流动,则成胶稳定。测定各组水凝胶液态pH。重复3次,取平均值。
1.3.2 水凝胶溶胀率 在室温条件下,称取适量水凝胶,放入一定量的蒸馏水中,静置一段时间后取出,去除水凝胶表面多余的水分,称量得到溶胀水凝胶的质量[21]。计算水凝胶的溶胀率(Equilibrium Swelling Ratio,ESR):
式中:ms——溶胀后水凝胶的质量,g;md——溶胀前水凝胶的质量,g。
1.3.3 水凝胶形貌观察 将成胶完全的复合水凝胶固定在96 孔板样品台上,用LM-4XC 型倒置电子显微镜观察复合水凝胶表面及内部多孔结构,纵切面孔隙大小及均匀程度。观测不同浓度积雪草苷对水凝胶三维结构的影响。
1.3.4 细胞共培养与体外细胞毒性测试 大鼠肾小管上皮细胞52E 原代培养,将处于对数生长期的细胞用于评价水凝胶的细胞毒性。将52E细胞和复合水凝胶共培养1 d,3 d,5 d,移除旧培养基,添加WST-8、应用于细胞增殖和细胞毒性的快速、高灵敏度检测试剂(Cell Counting Kit-8,CCK-8)。两小时后,用酶标仪测定在450 nm处的吸光度值。以完全培养基作为阳性对照,根据细胞在复合水凝胶和完全培养基中的比值计算不同天数后细胞的存活率。
1.3.5 细胞活力的测定 以2 000 个/孔的接种量,将细胞接种在96 孔板中,用一系列浓度的药物处理12 h。然后,向每个孔中加入10µLMTT试剂(5 mg/mL),并孵育4 h。之后,去除上清液。接下来,添加150 µL DMSO以溶解蓝紫色结晶甲臜。用酶标仪测量540 nm处的吸光度值。
2 结果
2.1 水凝胶的成胶效果
试管倾斜法测试结果表明甲基化海藻酸钠溶液与NVP、不同积雪草苷浓度溶液间均能通过反复冷冻-解冻形成凝胶。但稳定性各不相同,当积雪草苷含量为6 mg/mL时,Gel-2最稳定,随着体系中积雪草苷含量增多,成胶稳定性下降。图1展示了Gel-1和不同积雪草苷浓度Gel-2的成胶效果。pH测试结果显示各组水凝胶样品之间pH值没有明显差异。
2.2 水凝胶的表观形貌
随着积雪草苷含量增加,水凝胶的表面变得不平整,出现凹陷。从图2放大图片可以看出,当体系中积雪草苷含量增加到6 mg/mL,水凝胶内部的交联越来越密集。进一步分析得出,随着积雪草苷含量的增加,水凝胶内部孔隙直径增大,孔壁变薄,交联程度提高,形成了致密的三维网状结构,表观为稳定不可逆凝胶体。

图1 复合水凝胶成胶图Figure 1 Composite hydrogel formation diagram

图2 不同积雪草苷含量复合水凝胶的倒置显微镜图Figure 2 Inverted micrographs of composite hydrogels with different Centella asiatica glycosides content
2.3 水凝胶的溶胀和体外降解性能
由图3 可知,浸润起始阶段(1~2 d),水凝胶的溶胀率成对数增加,显示与浸润时间密切有关。但2 d后,随着浸润时间增加,溶胀率稳定,几乎成一条直线。此时水凝胶支架容纳的水已经达到极限,溶胀率与时间无关。其次积雪草苷和交联剂促使凝胶支架氢键网络的形成,强化了组织间隙的强度,是不同溶胀率的结构基础。当积雪草苷质量范围为6 mg/mL时,溶胀率最高达到45%。
图4 降解实验结果显示,降解起始阶段(1~6 d),降解速率最快,各组水凝胶的质量损失逐渐增大,但质量损失率相差不大。降解第二阶段(7~12 d),降解速率变缓,质量损失率差异开始显现。降解第三阶段(13 d后),各组质量损失率变化不明显,Gel-1凝胶较Gel-2 凝胶降解多,质量损失率最高分别达65.7%、61.5%,说明积雪草苷对凝胶的降解有明显的影响。但不同中药单体含量,质量损失率没有明显差异。

图3 复合水凝胶在不同浸润时间的溶胀率Figure 3 Swelling rate of hydrogels at different wetting time
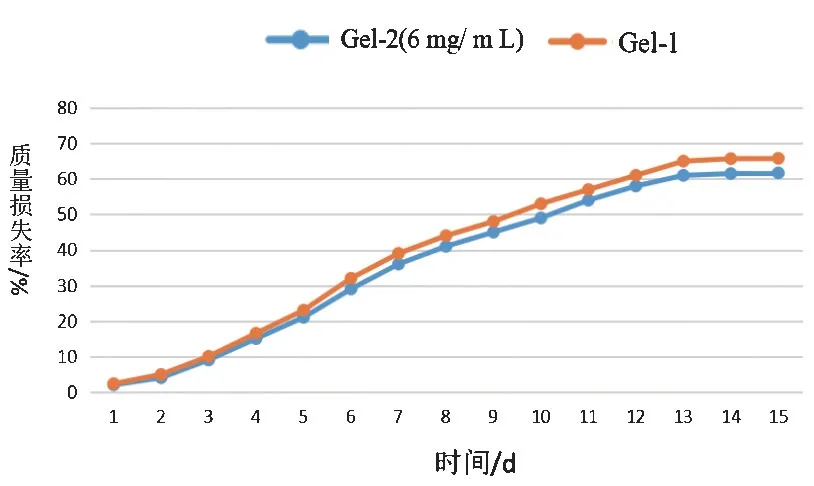
图4 复合水凝胶的降解性能Figure 4 Degradation properties of hydrogels
2.4 细胞相容性分析
为了实现定量比较,利用CCK-8 法对Gel-1 和Gel-2 水凝胶进行了毒性测试和细胞共培养。选取肾小管上皮52E细胞作为细胞模型。由图5可见,细胞和凝胶支架共培养1 d,3 d和5 d后的细胞存活率均接近甚至超过95%。当积雪草苷含量为6 mg/mL时,细胞存活率最高,证明制备的复合水凝胶具有优良的细胞相容性。
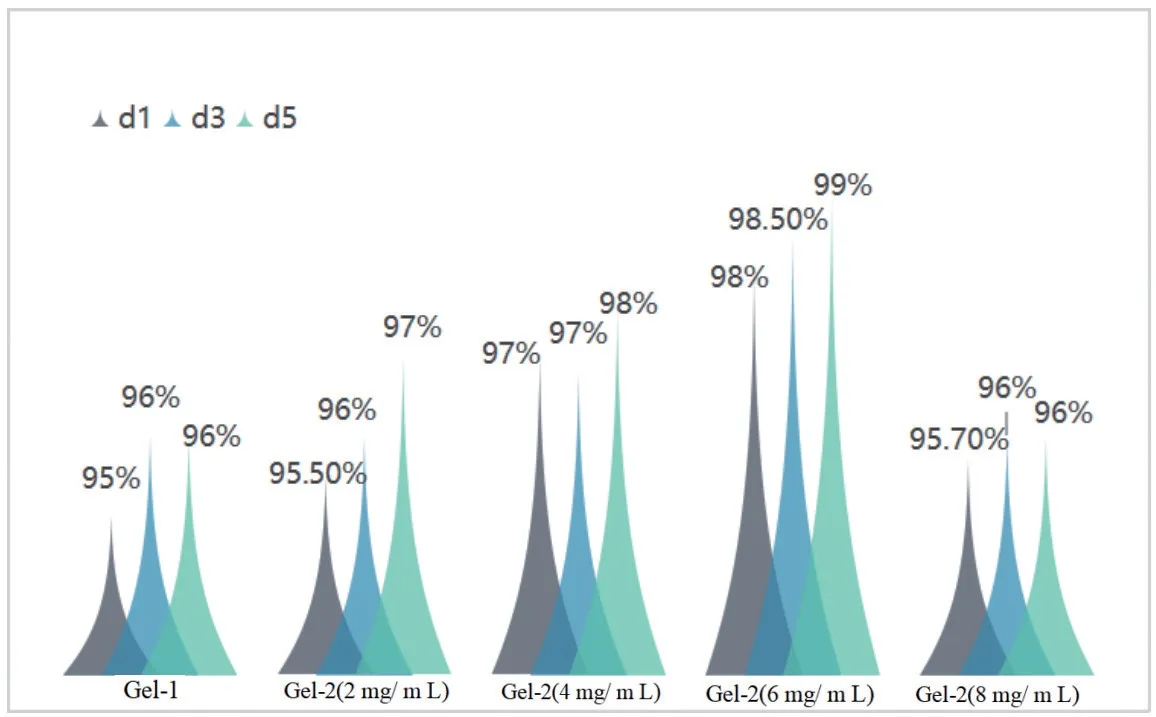
图5 52E细胞和水凝胶共培养1d,3d和5 d后的细胞存活率Figure 5 52E cell viability of hydrogel microsphere after coculturing for 1,3 and 5 d
为了实现水凝胶表面细胞的附着,经过杀菌处理,将水凝胶铺于96孔板中并加入等量培养基,然后分别加入同等数量的52E细胞使其黏附到水凝胶表面进行生长。由图6 可见,培养1、3、7 d 后,通过共聚焦显微镜的不同通道观察,可以明确看到52E 细胞在水凝胶表面进行了黏附,且细胞相容性好。培养1、3、7 d 后,细胞数量持续增加,说明细胞在复合水凝胶表面不仅能黏附,而且可以长时间保持足够的活性,实现增殖。通过添加NVP 和积雪草苷进行交联共聚反应,就可以实现细胞在3D水凝胶载体表面黏附和增殖。
通过与空白对照和实验对照比较可看出,积雪草苷含量为6 mg/mL 时,其内部细胞增值速率最高,最适合细胞生长。共培养1 d后,通过倒置相差显微镜观察发现,镜下细胞形态清楚,呈鹅卵石样,细胞衔接紧密,透明度及折光度良好;培养3 d后,细胞呈指数性生长,形态为多边形或短梭形,体积较大,衔接紧密;黏附于表面的细胞呈取向性生长,形成单细胞层,水凝胶支架内的细胞呈三维生长,但Gel-1和Gel-2各组细胞的增殖状态、形态存在差异(图6);培养7 d后,其生长周期、细胞形态及镜下折光性变化不大(图6)。
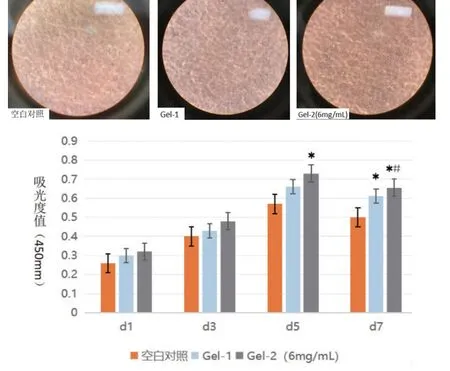
图6 CCK-8法检测不同培养组中52E的增殖活性Figure 6 Proliferative activity of 52E in different culture groups by CCK-8
如图6 所示,在相同的培养时间条件下,实验组(积雪草苷6 mg/mL)在第5 d 的细胞增殖活性最佳,且高于空白对照组和条件对照组(F=3.187,P<0.05),空白对照组和条件对照组没有明显区别。第7 d时,实验组细胞增殖活性比条件对照组高(F=15.240,P <0.05),且条件对照组明显高于空白对照组(P<0.05),表明水凝胶中积雪草苷的含量对52E细胞增殖具有促进作用。
通过倒置显微镜对细胞形态数据进行统计发现,各组水凝胶表面52E细胞铺展的水平明显不同。同一培养阶段,积雪草苷浓度为6 mg/mL,梭形细胞数量增加,生长并连接成片,细胞铺展面积增大,细胞圆度显著增加。这些研究结果表明,一定浓度的积雪草苷能够增强细胞的扩散行为[图7(A1)~(A3)]。从[图7(B1)~(B3)]高倍照片看出52E 细胞上出现的几根丝状伪足。伪足的形成起着关键作用,其有利于细胞在材料表面附着,沿着锚定的丝状伪足引导延伸。贯通的孔道结构使接种在表明的细胞呈现向凝胶内部迁移的趋势,这是能促进细胞迁移的重要前提。由此可见,含有积雪草苷三维网状支架表面有利于细胞在其上进行附着、联系及增殖,且良好的细胞相容性。
3 讨论

图7 52E细胞在复合水凝胶上的黏附、增殖Figure 7 Adhesion and proliferation of 52E cells on composite hydrogel observed
海藻酸钠是具有三维网络亲水性的软材料,可以在水或生物流体中膨胀。具有较好的保水性能,可以吸收伤口渗出物,从而促进真皮和表皮细胞的浸润,使伤口重新上皮化。到目前为止,不同类型的水凝胶,如壳聚糖、海藻酸钠已被开发为医用材料。但仅用交联剂形成的海藻酸钠水凝胶机械强度差,水溶性低,其在临床应用受到很大限制。因此,迫切需要找到一种机械强度好,具有稳定网络结构,细胞相容性好的新型水凝胶。
据报道,小分子来自食品或草药,如大黄素含有蒽醌结构,葛根素含有苯环和羟基,可以自发地组装成3D 水凝胶[22-23]。这些超分子水凝胶具有自愈特性,高稳定性和环境响应性(温度和pH 敏感性)对促进伤口愈合具有较好的效果[24]。类似地,富含邻苯二酚或邻苯三酚(包括单宁酸和没食子酸(gallic acid,GA))的植物多酚已被广泛报道通过使用酶的自聚合,紫外线(ultraviolet,UV)照射或使用弱碱性溶液形成纳米涂层或纳米颗粒[25]。这些酚类生物材料使载体具有出色的抗菌和抗炎活性,证明了它们在药物递送和生物成像应用中的潜力。酚类化合物也被接枝到壳聚糖或甲壳素等其他聚合物上,形成增强其机械和生物特性的水凝胶。然而,据我们所知,没有报告显示积雪草苷在现有情况下可以形成具有稳定三维网络水凝胶。最近,我们发现积雪草苷与甲基丙烯酸酐化海藻酸钠发生交联共聚反应,在反复冷冻-解冻处理下组装成多功能复合水凝胶,进一步改善凝胶成胶后的稳定性及机械强度。
水凝胶成交过程中先以甲基丙烯酸酐对海藻酸钠中的羧基进行修饰,有利于交联,这种交联方法虽然可以改善凝胶成胶后的稳定性及机械强度,但成胶后吸水能力降低。再加入NVP和积雪草苷发生交联共聚反应,然后通过反复冷冻-解冻作用把这种交联共聚固定下来,形成稳定的网络状水凝胶。研究表明随着中药单体的增加,当积雪草苷含量为6 mg/mL水凝胶孔隙尺寸最大,孔壁较薄,达的孔隙结构为细胞提供高效物质交换通道,为细胞增殖提供更多空间。如将此复合凝胶用于伤口愈合,该网络因吸水膨胀而填充组织缺损部位并为细胞提供支架[26],对伤口的愈合作用及机制还需要进一步研究。此外还发现在一定的范围内,复合水凝胶支架的交联度随着积雪草苷含量的增加而增大,促使凝胶支架网络的形成,是不同溶胀率的结构基础。当积雪草苷浓度为6 mg/mL 时,溶胀率最大达到45%。此稳定性致密三维网状水凝胶,可进一步作为强化组织间隙强度的功能型水凝胶[27]。
水凝胶的表观形貌显示,积雪草苷对凝胶的内部交联结构有显著的影响。细胞相容性和增殖实验结果也表明通过添加中药单体进行交联共聚反应,形成稳定网络状水凝胶,使细胞在复合水凝胶载体表面黏附和增殖,促进细胞迁移。此研究通过自组装形式设计的水凝胶与传统中药活性成分结合,将中药成分引入水凝胶体系,这些优势都使水凝胶可作为出众的伤口敷料候选者[28]。为海藻酸钠向智能化、仿生化方向发展提供基础理论研究,对加快天然支架材料在组织工程领域的实际应用具有极其重要的研究意义。此外,将中药天然产物分子直接组装成绿色凝胶的理念具有诸多理论优势,期待为中药现代化建设奠定基础。
4 结论
本试验以甲基丙烯酸酐化海藻酸钠为水凝胶支架,添加NVP和积雪草苷制备出三维网状复合水凝胶。结果表明:在甲基丙烯酸酐化海藻酸钠、NVP最佳比例前提下,积雪草苷浓度为6 mg/mL 时,水凝胶支架凝胶时间最短、最稳定,复合水凝胶的孔隙尺寸增大。由于中药单体与甲基丙烯化海藻酸钠通过交联形成了三维多孔结构,不同含量的积雪草苷对孔隙形态特点具有明显的影响作用。
细胞相容性研究发现,该复合水凝胶支架无细胞毒性,可实现肾小管上皮细胞的增殖。黏附于表面的细胞呈取向性生长,形成单细胞层;水凝胶支架内的细胞呈三维生长。由于类似多细胞层结构常见于血管、神经等组织,结合中药单体所制备的复合水凝胶有望在上述组织的修复中得到应用。良好的材料生物相容性和温和的操作过程能够保障黏附后的52E细胞在凝胶表面正常铺展与增殖,显示了在3D大规模培养细胞方面的应用潜力。

