西格列汀通过上调TTF-1/SP-B通路对LPS诱导小鼠急性肺损伤的保护作用
王小川,杜发旺,姚 宇,李 丽,何高燕,王汉超,王 勤,熊 伟,朱 涛,3
1.遂宁市中心医院呼吸与危重症医学科(遂宁 629000);2.重庆医科大学附属第二医院呼吸与危重症医学科(重庆 400010);3.遂宁市中心医院基础实验室(遂宁 629000)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是最常见的非心源性急性肺水肿,临床上主要表现为呼吸窘迫与顽固性低氧血症[1-2]。急性肺损伤(acute lung injury,ALI)和ARDS 是同一个疾病连续的两个不同阶段[3-5]。目前研究表明肺表面活性物质(pulmonary surfactant,PS)减少、肺顺应性下降和通气/血流失调是ALI/ARDS 最主要的病理生理特征[5-6]。PS是一种主要由Ⅱ型肺泡上皮细胞(type Ⅱalveolar epithelial cell,AEC Ⅱ)合成和分泌的大分子聚合物,其主要的生物学作用包括维持肺泡顺应性、肺泡内外液体平衡、调控肺组织固有免疫等[7-8]。研究发现促进PS 的蛋白成分(如SP-A 和SP-B 等)表达或外源性给予PS 可有效改善ARDS 患者的氧合水平,促进肺水肿液的吸收[9-10]。我们前期研究证实在小鼠ALI 模型中,胰高血糖素肽-1(glucagon-like peptide-1,GLP-1)的拟似物利拉鲁肽(liraglutide)可通过上调甲状腺转录因子-1(thyroid transcription factor,TTF-1)信号通路改善肺损伤,减轻肺组织炎症[11]。同时,研究证实在肠道细胞中二肽基肽酶4(dipeptidyl peptidase 4,DPP4;又称CD26)是GLP-1代谢的关键酶。DPP4抑制剂(如西格列汀和沙格列汀等)可有效降低DPP4 活性,从而抑制GLP-1 的分解,增加组织中GLP-1 浓度和存留时间[12-13]。因此,本研究的目的是探讨DPP4抑制剂西格列汀对小鼠ALI的保护作用以及潜在的分子机制和信号通路,为临床治疗ARDS提供新线索和治疗靶点。
1 材料与方法
1.1 主要材料
实验动物SPF级雄性BALB/C小鼠,由四川大学实验动物中心提供。DPP4 抑制剂西格列汀购于美国默沙东制药公司(捷诺维,国药准字J20140095)。内毒素(LPS)购于美国Sigma公司。聚合酶链反应(PCR)引物由上海生物工程技术服务有限公司合成。总RNA 抽提试剂盒购自北京百泰克生物技术有限公司。第一链cDNA 合成试剂盒和PCR 试剂盒购于Takara 公司。小鼠TTF-1 抗体、SP-B 抗体和β-actin 抗体购于美国Santa Cruz公司。
1.2 小鼠模型的建立
按照随机数字表法将32只雄性BALB/C 小鼠分为对照组、DPP4抑制剂西格列汀组(DPP4I组)、内毒素组(LPS组)和LPS+DPP4I组,每组8只。根据我们的前期研究方案,LPS 组和LPS+DPP4I 组小鼠通过气道内注射LPS(10µg LPS 溶于50µL 生理盐水)诱导建立ALI模型[14-15]。LPS 干预72 h 后处死小鼠获取标本。干预开始7 d前,灌喂DPP4I组和LPS+DPP4I组小鼠西格列汀(100 mg/kg,1 次/d),直到处死小鼠获取标本,共10次[16-17]。对照组给予生理盐水代替LPS。动物实验方案经遂宁市中心医院动物伦理委员会审核批准。
1.3 HE染色观察病理变化并进行肺损伤评分
取左肺下叶,根据我们前期研究,采用HE 染色观察肺组织病理改变[18],对肺损伤程度进行评分[3-4,11]。
1.4 肺泡灌洗液炎症细胞分类计数
根据前期研究方案,收集小鼠肺泡灌洗液(BALF),采用Diff-Quik 染色,使用血细胞计数器(hemocytometer)对BALF的细胞总数、中性粒细胞、巨噬细胞和淋巴细胞进行计数[19-20]。
1.5 肺组织湿/干比测定
根据前期研究方案,小鼠处死后取出肺组织,将小鼠右中肺置于80 ℃烤箱24 h至恒重后,记录前后肺组织重量,计算肺组织湿/干比(W/D)值[3,11]。
1.6 qPCR法检测TTF-1、SP-B表达
取右肺上叶组织,按照试剂盒说明书提取总RNA。以总RNA为模板,用Oligo(dT)18作为引物,按照试剂盒说明书介绍要求合成cDNA第1链。TTF-1:正义5'-AACAGC GGCCATGCAG CAGCAC-3',反义5'-CCATG TTCTTGC TCACGTCC-3';SP-B:正义5'-CCAAGTGCT TGATGTCTACC-3',反义5'-CTGGATTCTGTTCTGGCT TA-3';β-actin引物:正义:5'-GATTA CTGCTCTGGCT CCTAGC-3',反义:5'-ACTCAT CGTACTCC TGC TTGC T-3'。使用β-actin 作为内参基因,采用2-△△CT公式计算目标基因肺组织TTF-1 和SP-B 的相对表达量,ΔΔCt=(Cttarget-Ctβ-actin)干预组-(Cttarget-Ctβ-actin)对照组[20-21]。
1.7 Western blotting法检测肺组织蛋白表达
按照试剂盒操作要求,首先提取右肺下叶组织总蛋白,并进行聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1 h,放入兔抗鼠单克隆抗体磷酸化TTF-1(1∶800)和β-actin(1∶2 000)稀释溶液中4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶1 000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.8 统计学方法
计量资料以均数±标准差描述。采用SPSS 25.0软件进行单因素方差分析,两样本均数多重比较采用SNK法,P<0.05为差异有统计学意义。
2 结果
2.1 肺组织损伤水平
对照组与DPP4I 组小鼠肺组织未见明显病理变化。LPS组:肺泡间隔明显增宽、肺泡内大量炎症细胞浸润和水肿液聚集,并见较多红细胞,肺泡中有透明膜形成。LPS+DPP4I组:肺泡间隔增宽、肺泡内炎症细胞浸润和水肿液聚集程度均较LPS 组更轻,肺泡内见少量透明膜形成。与LPS 组相比较,LPS+DPP4I 组的肺损伤评分更低,差异有统计学意义(P <0.05),见图1和图2。

图1 肺组织HE染色(×200)Figure 1 HE staining of lung tissue(×200)

图2 肺损伤评分Figure 2 Lung injury scores
2.2 BALF中炎症细胞水平
LPS 干预72 h 后,小鼠BALF 中细胞总数、中性粒细胞数、巨噬细胞数和淋巴细胞数均显著升高(P <0.05)。与LPS组相比,LPS+DPP4I组小鼠BALF中各种炎症细胞数均明显更低,差异有统计学意义(P <0.05),见图3。
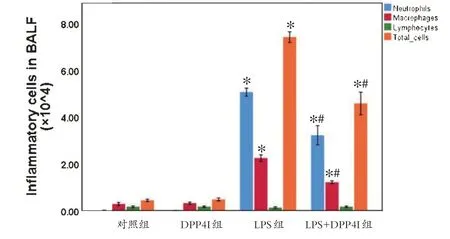
图3 BALF中炎症细胞Figure 3 Inflammatory cells in BALF
2.3 肺组织W/D比值
W/D 比值是评估小鼠ALI 模型肺水肿严重程度的常用指标[3,11]。LPS干预72 h后,小鼠肺组织W/D比值显著增加(P<0.05)。与LPS 组相比,LPS+DPP4I 组小鼠肺组织W/D比值明显降低(P<0.05),见图4。
2.4 肺组织TTF-1和SP-B的表达水平
与对照组相比,LPS 干预后小鼠肺组织TTF-1 和SP-B mRNA 和蛋白表达水平均明显下降(P <0.05)。与LPS组相比,LPS+DPP4I组小鼠肺组织TTF-1和SPB更高(P<0.05),见图5和图6。
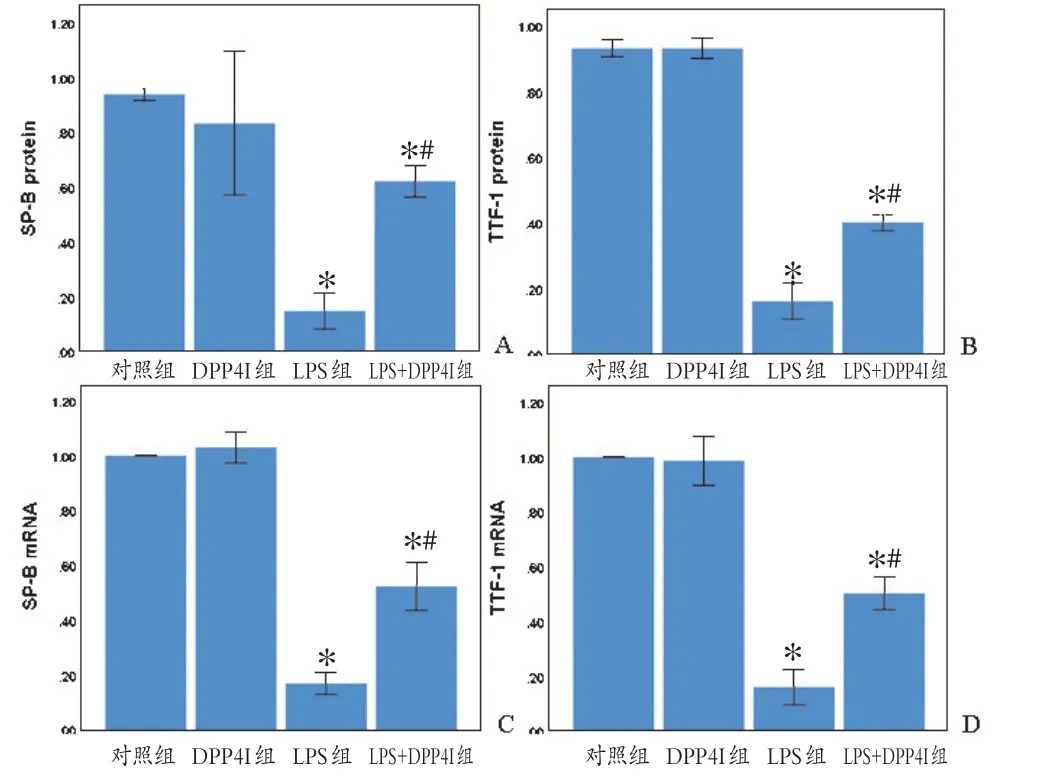
图5 肺组织TTF-1和SP-B mRNA和蛋白表达水平Figure 5 The mRNA and protein expression of TTF-1 and SP-B in the lung tissue
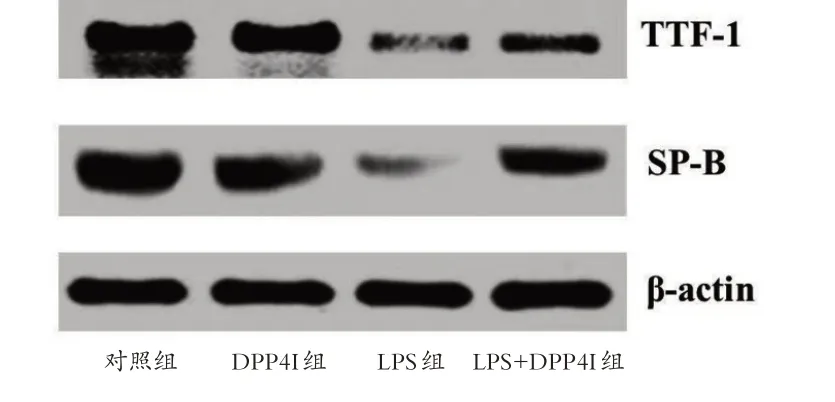
图6 肺组织TTF-1与SP-B的western blotting结果Figure 6 The western blotting results of TTF-1 and SP-B
3 讨论
ARDS 一直是呼吸与危重症医学研究的重点及难点,目前研究显示其死亡率高达30%~70%[1],主要的病理生理特征包括肺容积减少、肺泡塌陷、肺组织顺应性下降、高通透性肺水肿、氧合功能障碍和肺循环障碍等,临床以呼吸窘迫、顽固性低氧血症和非心源性肺水肿为主要表现[3,14,22]。
GLP-1 是肠道内分泌细胞L 细胞(L cells)和K 细胞(K cells)分泌的一种脑肠肽,是重要的胰岛素促分泌剂,GLP-1对于糖脂代谢具有关键调控作用,生理状态下高脂肪和高碳水化合物食物是促进GLP-1合成与分泌的主要调节因素[23-25]。二肽基肽酶4(DPP4)(即CD26)是一种抗原酶,在多个器官的细胞表面以II型跨膜蛋白的形式表达,是GLP-1代谢的关键酶[26]。因此,DPP4 抑制剂可延长肠促胰岛素激素如GLP-1 和胃抑制多肽等的生物活性,从而改善机体的葡萄糖耐量[26]。目前GLP-1 拟似物与DPP4 抑制剂均已被广泛用于II型糖尿病的治疗。我们前期研究发现GLP-1拟似物利拉鲁肽可有效减轻LPS 诱导的小鼠ALI 模型肺组织炎症反应及肺水肿水平[11]。同时,多个研究表明DPP4抑制剂对于多种因素导致的肺部炎症反应具有调控作用[16,27]。KONG等[16]研究发现DPP4抑制剂西格列汀可以有效减轻重症胰腺炎(severe acute pancreatitis,SAP)诱导的ALI 模型小鼠的肺组织损伤、肺水肿和氧化应激水平。ZHANG 等[27]研究显示高选择性DPP4抑制剂阿拉格列汀(anagliptin)对于LPS 诱导的人肺微血管内皮细胞(human pulmonary microvascular endothelial cell,HPMVEC)炎症反应和氧化应激损伤有显著的保护作用。在本研究中,我们发现与LPS 组相比,LPS+DPP4I组小鼠的肺组织病理改变程度、肺损伤评分、肺水肿程度指标W/D 比值及BALF 中各炎症细胞水平均明显更低。该结果表明西格列汀可以有效缓解LPS 诱导的ALI小鼠模型肺损伤和肺水肿程度及炎症反应水平。
PS成分主要包括磷脂和蛋白两部分,其中SP-A和SP-B 是PS 最主要的蛋白组分[11,28]。PS 具有降低气液界面的表面张力维持肺泡顺应性、调控肺内液体平衡和肺组织固有免疫反应等生理学作用[11,28]。研究显示ARDS 患者的肺组织和血中SP-A 和SP-B 水平均明显降低,其水平与ARDS的严重程度呈负相关[29-30]。YANG等[29]的研究发现ARDS 患者血清中SP-A 和SP-B 水平较健康体检者明显下降,同时ARDS关键炎症因子IL-8 的水平与SP-A 和SP-B 水平呈显著负相关。我们前期研究发现在ARDS 存活组患者的氧合指数与BALF中SP-A 水平均较死亡组明显更高[30]。进一步进行相关性分析后发现两者之间的决定系数(R2)为0.531,因此BALF中SP-A水平与ARDS严重程度具有显著正相关性,该指标是ARDS 严重程度的潜在标志物。外源性给予包含SP-B的肺表面活性物质对ALI/ARDS肺损伤具有保护作用。BEZERRA 等[31]研究证明包含SP-B和SP-C的外源性PS药物CUROSURF 可有效缓解高浓度氧诱导的ALI 小鼠模型肺组织损伤、炎症及氧化应激水平,提示CUROSURF 对于ARDS 具有良好的治疗前景。在本研究中我们也发现LPS 诱导的ALI 肺组织SP-B 明显降低,但西格列汀可有效改善LPS 诱导ALI小鼠肺组织中SP-B的下降。
TTF-1属于NKX2同源结构域转录因子家族,是调控肺组织发育、分化及肺表面活性物质合成的关键转录因子[11]。TTF-1 敲除小鼠由于肺组织、甲状腺和脑组织发育严重障碍在出生后迅速死亡[32]。研究显示SP-A和SP-B基因转录区存在TTF-1结合序列,TTF-1对于SP-A 和SP-B 的合成与分泌具有关键调控作用[33]。我们前期通过动物和细胞模型试验证实GLP-1拟似物利拉鲁肽主要是通过上调AEC II细胞TTF-1信号通路促进SP-A的分泌与合成减轻了ALI肺损伤、肺水肿及炎症反应[11]。基于此,我们在本研究中发现DPP4抑制剂西格列汀亦可有效上调LPS诱导的ALI模型小鼠肺组织TTF-1 mRNA 和蛋白的表达水平。因此,我们推测西格列汀对于LPS诱导ALI小鼠肺组织的保护作用可能主要是通过上调TTF-1 促进SP-B 合成实现的。
4 结论与展望
本实验结果发现,在LPS 诱导的小鼠ALI 模型中DPP4 抑制剂西格列汀可以通过上调肺组织TTF-1 表达,促进SP-B合成,有效减轻肺损伤、炎症反应和肺水肿。下一步我们将在体外研究中继续探讨DPP4 抑制剂对于ARDS 状态下II 型肺泡上皮细胞的保护作用及潜在的分子机制。该系列研究有望为DPP4 抑制剂及GLP-1拟似物应用于ARDS临床治疗提供理论依据,并为后续的临床研究奠定基础。

