疏肝利胆颗粒提取工艺优选及药效学实验研究
张玉春,靳永文,王利军,张国强,张 帆,魏玉辉
兰州大学第一医院药剂科(兰州 730000)
胆汁淤积性肝损伤是一种常见的肝病,发病率较高,全球约10%~ 20%的人受胆汁淤积症的困扰[1-2]。胆汁淤积(cholestasis)是由胆汁合成缺陷和/或排泌异常造成胆酸盐在肝脏中蓄积,长期蓄积可对肝细胞造成损伤,导致肝炎、肝纤维化、肝硬化甚至肝癌[3]。目前,美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于治疗胆汁淤积的药物仅有熊去氧胆酸(ursodeoxycholic acid,UDCA)和奥贝胆酸(obeticholic acid,OCA)[4-6],但其疗效不尽如人意[7-8]。因此,面对胆汁淤积症治疗药物疗效欠佳的问题,仍需寻找更加安全有效的治疗药物。
中医药在胆汁淤积性肝损伤的治疗中疗效显著[9],其主要方法为清热燥湿、保肝利胆[10]。消炎利胆丸方是兰州大学第一医院院内中药制剂,经40 年临床验证,在治疗胆石症、胆囊炎和胆汁淤积方面疗效明确、毒副作用小且患者认可度高。该方由柴胡、木香、炒枳实、青皮等8味中药组成。然而,消炎利胆丸为大蜜丸剂,吞咽困难者或儿童服用不便,且限制了糖尿病患者的使用。为了促进消炎利胆丸由院内制剂走向市场,让更多胆石症、胆囊炎和胆汁淤积患者受益,有必要将其进一步开发为不含糖、便于服用、携带方便的医院制剂。本课题组为了将消炎利胆丸剂改进为疏肝利胆颗粒剂,采用正交设计结合药效学实验评价并优选疏肝利胆颗粒的提取工艺,为疏肝利胆颗粒的开发提供科学实验依据。
1 材料和方法
1.1 仪器
Agilent1260 型高效液相色谱仪;LT-224S 电子天平(Sartorios 公司,BS 400S);Varioskan Flash 多功能酶标仪(美国Thermo公司);脱水机(TP1020型,德国莱卡公司);石蜡包埋机(HBM~200LF 型,上海寰熙医疗器械有限公司);全自动生化仪(AU400 型,日本Olympus公司生产);高速离心机(3K15型,德国Sgima离心机公司);核酸蛋白定量仪(Nano Vue 型,美国通用电器医疗);PCR 热循环仪(Pro Flex 96-well PCR system 型,美国ABI公司);荧光定量PCR仪(480-480Ⅱ型,罗氏)。
1.2 试药与试剂
柴胡、枳实(炒)、木香、菜菔子、青皮、山楂、大黄、芒硝均购自甘肃冠兰中药饮片有限公司,药品生产许可证号:甘20160006,药品GMP证书:GS0140122,均符合《中国药典》2020 年版规定;大黄素对照品,批号110756-200110,质量分数98%,中国药品生物制品检定所;大黄酚对照品,批号110796-200716,质量分数98%,中国药品生物制品检定所;RNA 提取试剂盒,批号DP431,天根生化科技有限公司;快速反转录试剂盒,批号KR116-02,天根生化科技有限公司;荧光定量试剂,批号32597600,罗氏公司;BCA 试剂盒,批号SL260217,Thermo;α -异硫氰酸萘酚 (alphanaphthylisothiocyanate,ANIT),N106389,质量分数98%;消炎利胆丸剂由兰州大学第一医院药剂科提供;丙氨酸氨基转移酶(ALT)测定试剂盒、碱性磷酸酶(ALP)测定试剂盒、谷草转氨酶(AST)测定试剂盒和总胆酸盐(TBAs)测定试剂盒购自南京建成生物工程研究所;色谱级乙腈和甲醇均购自阿拉丁试剂(上海)有限公司;分析纯水为兰州大学第一医院自制,其他试剂均为国产分析纯;去离子水(兰州大学第一医院自制)。
1.3 实验动物
SPF 级雄性C57BL/6J 小鼠(5~ 7 周龄,体重20~25 g)由中国农业科学院兰州畜牧与兽药研究所提供[许可证编号:SCXK(甘)2015-0021],于室温20℃~25℃及湿度40%~60%的条件下饲养1周后开始实验。本研究遵守动物实验伦理要求,并经兰州大学第一医院伦理委员会审核批准(审批号:LDYYLL2023-227)。
1.4 方法
1.4.1 大黄素和大黄酚含量的测定 色谱条件:Ulitmate XB-C18 色谱柱,乙腈-甲醇-0.1%磷酸(42∶23∶35)为流动相,流速1 mL/min,检测波长为254 nm。对照品溶液的制备:称取一定量的大黄素和大黄酚对照品,精密
称定,加甲醇溶解,得质量浓度为0.1 mg/mL 的储备溶液;供试品溶液的制备:称取水提物干膏(过四号筛)约0.1g,精密称定,置50 mL 量瓶中,加甲醇适量,超声40 min,放冷,再加甲醇定容。取供试品溶液,过滤,精密量取续滤液10 mL,置烧瓶中,加30 mL 的1 mol/L 盐酸溶液,20 mL 的三氯甲烷,加热回流1 h,冷却后分取三氯甲烷,水层再加三氯甲烷提取3次,每次10 mL,合并提取液,蒸干,加入甲醇复溶,转入10 mL容量瓶中,定溶;阴性对照样品溶液的制备:按处方比例称取各味药材(不含大黄),按制剂提取方法提取,称取干膏适量,按“供试品溶液的制备”方法制得阴性对照样品溶液。
1.4.2 大黄素和大黄酚测定方法学评价 吸取对照品溶液、供试品溶液和阴性对照样品溶液10µL 进样分析;标准曲线的制备:取“1.4.1”项对照品溶液梯度稀释为0.08、0.16、0.31、0.63、1.25、2.50、5.00、10.00 µg/mL,测定;精密度试验:取“1.4.1”项对照品溶液,稀释至0.16µg/mL,重复测定6 次;稳定性试验:取供试品溶液分别于0、2、4、6、8、12、24 h 测定;重复性试验:称量水提干膏粉末6份,精密称定,按照“1.4.1”项方法制备供试品溶液,测定;加样回收率试验:称量水提干膏粉末6份,精密称定,分别对照品溶液(0.16µg/mL)10 mL,按照“1.4.1”项方法制备供试品溶液,测定并记录大黄素和大黄酚的峰面积,并计算RSD 值。
1.4.3 水提工艺优选 水提工艺单因素考察:根据文献报道[11]对水提工艺影响较大的主要因素为加水量、提取时间、提取次数。提取时间:选择提取时间0.5、1.0、1.5 h 进行正交试验;加水量:选取加水量为10、8、6 倍量进行正交试验;提取次数:选取提取次数为1、2、3 次进行正交试验;正交试验筛选最佳水提工艺:以得膏率、大黄素和大黄酚转移率为评价指标,以提取时间(A)、加水量(B)和提取次数(C)为考察因素,应用L9(34)表进行正交试验,筛选出最佳的提取工艺;并进行3 次重复验证试验。
1.4.4 药效学实验验证 消炎利胆方水提物制备:以上8 味药,称取柴胡36 g,枳实(炒)30 g,木香30 g,菜菔子30 g,青皮30 g,山楂36 g,大黄30 g,芒硝24 g(后下),按照最优水提工艺制备消炎利胆丸方水提物,置4℃冰箱备用;动物分组与给药:小鼠饲养1 周后,采用随机分组法将小鼠分为6 组,每组10 只,对照组灌胃给予溶媒(纯化水);模型组灌胃给予溶媒(纯化水);低剂量组灌胃给予水提物0.22 g·kg-1·d-1;中剂量组灌胃给予水提物0.45 g·kg-1·d-1;高剂量组灌胃给予水提物0.90 g·kg-1·d-1;丸剂组灌胃给予中剂量消炎利胆丸2.0 g·kg-1·d-1,每天两次,连续7 d;给药第5 d,模型组和给药组小鼠单次灌胃给予ANIT 50 mg/kg,对照组给于等体积的植物油;末次给药后,禁食4 h,摘眼球采血,二氧化碳致死,观察胆囊充盈状态,采集肝脏组织,部分组织储存于-80℃中,部分组织固定于10%甲醛溶液,用于肝脏组织病理学考察。试剂盒测定血清中谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine transaminase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)和总胆汁酸(total bile acid,TBAs)的水平;按照TIANGEN RNA prep Pure 动物总RNA 提取试剂盒的方法测定小鼠肝脏炎症因子mRNA 水平;采用离心柱法对小鼠肝脏进行裂解提取总RNA,并进行RNA 反转录和RNA 扩增;以GAPDH 作为内参基因计算各基因的mRNA 表达量。
1.5 统计学分析
采用SPSS 13.0 进行统计学分析,计量资料数据用均数±标准差()表示,两组均数差异比较采用ttest双尾检验法,P<0.05 和P<0.01 为有统计学意义。
2 结果
2.1 大黄素和大黄酚测定方法学评价
方法学考察结果显示大黄素保留时间为17.16 min,大黄酚保留时间为26.61 min,且与供试品其他组分分离度良好(R >1.5),阴性对照品无干扰(见图1)。以色谱峰面积为纵坐标(Y),对照品溶液质量浓度为横坐标(X),绘制标准曲线,得大黄素和大黄酚线性回归方程分别为Y=272287 X -19675,r2=0.9987 和Y=447222 X -36583,r2=0.9982,大黄素和大黄酚在0.08~10.00µg/mL 线性关系良好。精密度考察结果表明,大黄素和大黄酚RSD 分别为0.18%和0.31%;稳定性考察结果表明,大黄素和大黄酚RSD 分别为1.16%和2.24%;重复性试验结果表明,干膏中大黄素和大黄酚平均质量分数分别为1.67 mg/g 和0.83 mg/g,RSD 分别为1.09%和2.16%;加样回收率试验结果大黄素和大黄酚的平均回收率分别为98.77%和101.41%,RSD分别为1.33%和2.19%。
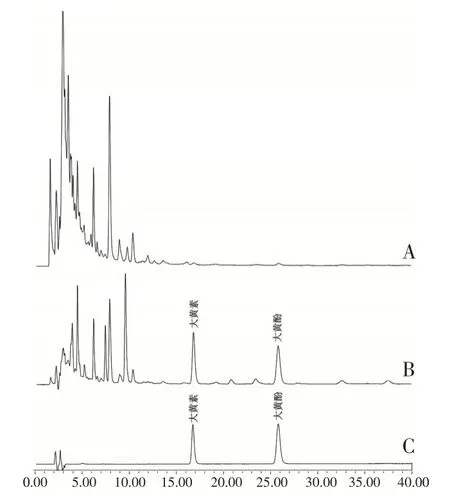
图1 大黄素和大黄酚色谱图Figure 1 HPLC of emodin and chrysophanol
2.2 正交试验与重复实验验证
由正交试验直观分析表明,各因素不同水平影响由大到小分别为A3>A2>A1、B1>B2>B3、C3>C2>C1。综合评分表明最佳水提工艺为A3B1C3(结果见表1、表2),即称取处方量药物,加入10倍量水煎煮3 次,每次1.5 h。重复实验测得得膏率平均值为25.44%,RSD 为1.41%;大黄素和大黄酚转移率平均值分别为11.56%和12.03%,RSD 分别为1.18%和0.95%。结果显示验证试验结果和正交试验筛选的提取工艺评分最大值相近,说明疏肝利胆颗粒水提工艺稳定、可靠(见表3)。
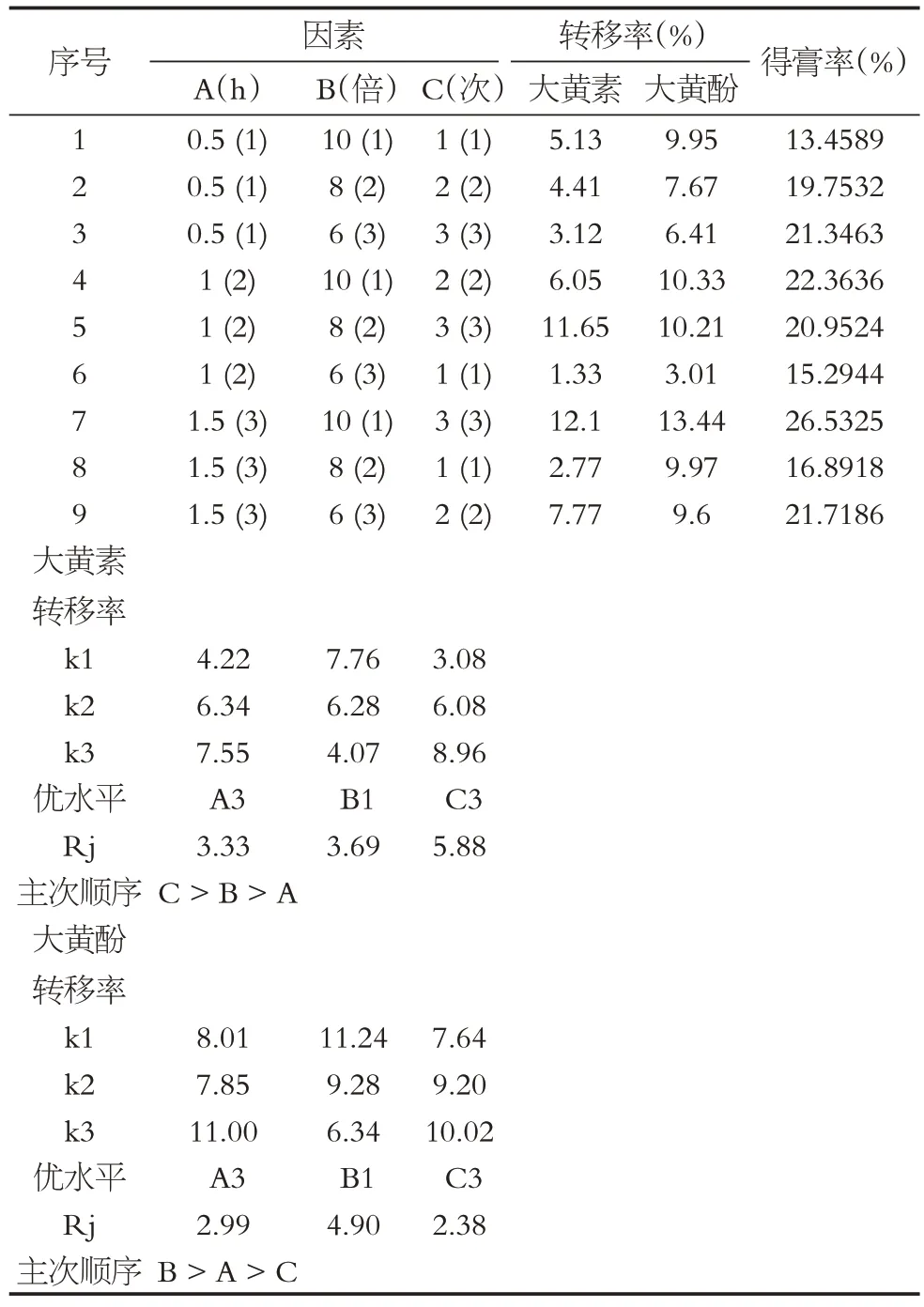
表1 水提工艺正交试验结果Table 1 Orthogonal experiment result of water extraction technologies
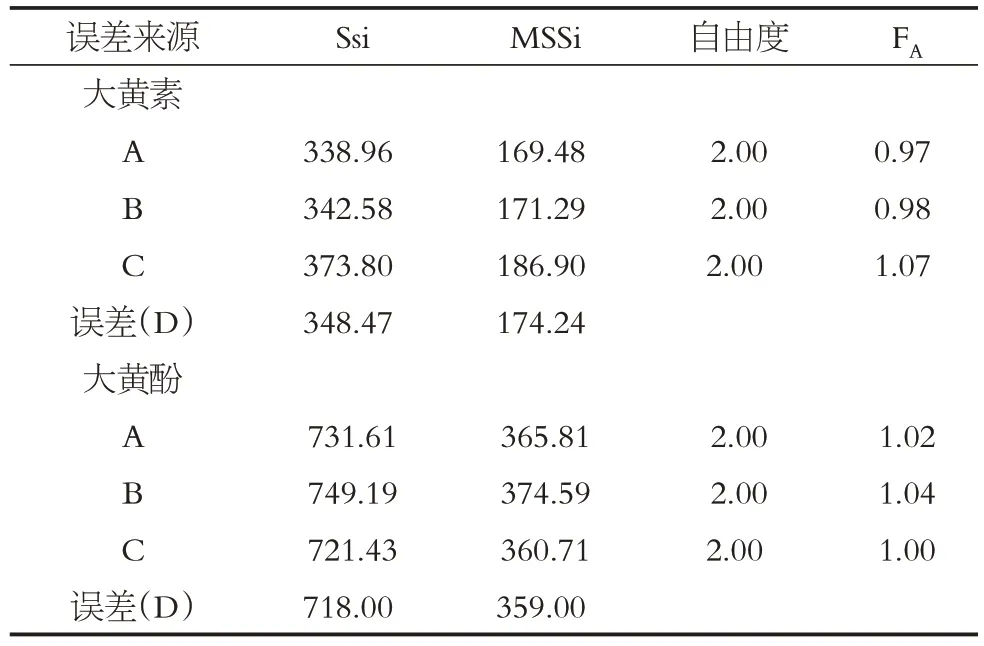
表2 水提工艺方差分析Table 2 Variance analysis of water extraction technologies

表3 水提工艺验证试验结果Table 3 Verification test of water extraction technologies
2.3 对小鼠胆囊的形态学评估
如图2 所示,相较于对照组,模型组小鼠胆囊膨大,且胆汁呈墨绿色;与模型组相比,给予水提物低、中、高剂量和消炎利胆丸干预7 d 后,小鼠胆囊明显缩小,胆汁颜色转变为浅黄色。

图2 小鼠胆囊形态学的变化情况Figure 2 Effects on gallbladder morphology in mice
2.4 对血清生化指标水平的影响
结果如图3所示,与模型组相比,水提物低剂量组小鼠血清中ALT 水平显著降低(P<0.05),其中TBA、ALP、AST 和ALT 水平分别下降了30%、28%、38%和46%;水提物中剂量组小鼠血清中TBA、AST 和ALT水平显著降低(P<0.05),其中TBA、ALP、AST 和ALT分别下降了51%、43%、31%和13%;水提物高剂量组小鼠血清中ALP、AST 和ALT 水平显著降低(P<0.05),其中TBA、ALP、AST 和ALT 分别下降了40%、44%、36%和48%。与模型组相比,消炎利胆丸剂中剂量组小鼠血清中TBA、AST 和ALT 水平显著降低(P <0.05),其中TBA、ALP、AST 和ALT 分别下降了54%、42%、56%和59%,水提物中剂量和水提物高剂量与消炎利胆丸剂中剂量对胆汁淤积小鼠血清生化指标水平的影响作用相近。
2.5 对小鼠肝脏组织病理学的影响
如图4 所示,肝脏组织病理学表明对照组肝脏组织结构及肝细胞形态清晰,模型组肝脏组织可见明显的肝细胞嗜酸变、炎症浸润和肝窦扩张。与模型组相比,水提物低、中和高剂量组的炎症浸润、肝窦扩张程度明显减轻,其中以中剂量组效果最明显;消炎利胆丸剂组肝组织炎症浸润、肝窦扩张程度减轻。
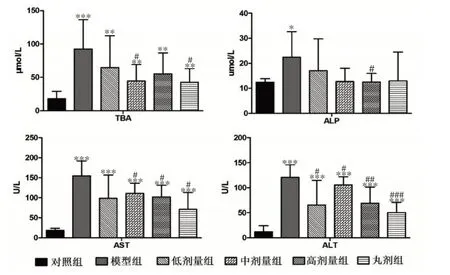
图3 小鼠血清生化指标变化情况(,n=10)Figure 3 Effect on biochemical index in serum of mice(,n=10)
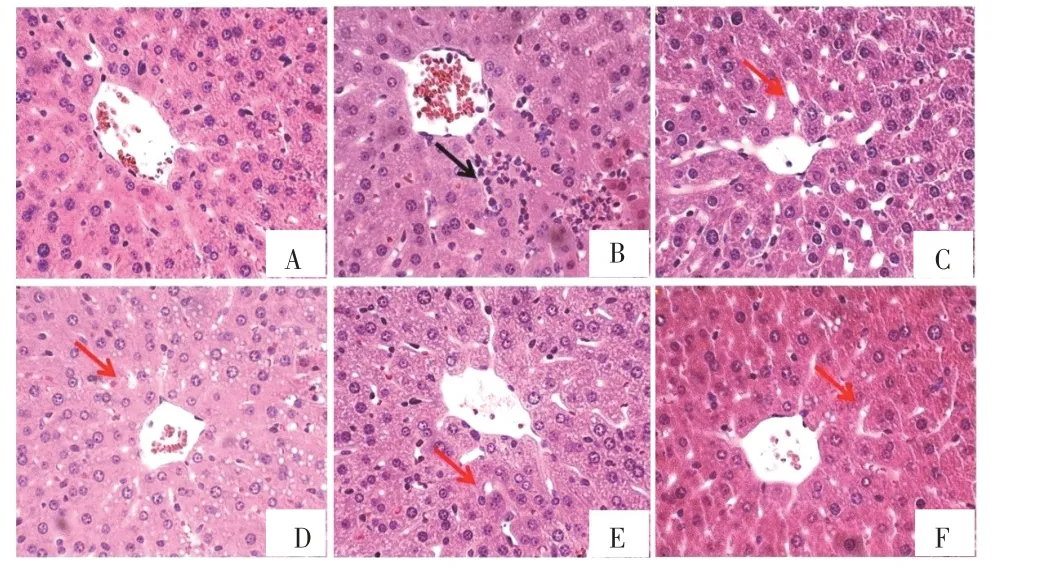
图4 肝脏组织病理学图片(40×)Figure 4 Effects on gallbladder morphology in mice(40×)
2.6 对炎症因子mRNA表达水平的影响
RT-PCR反应所需引物序列如表4所示,结果如图5 所示,与正常组相比,模型组肝脏组织中的肿瘤坏死因子α(tumor necrosis factor α,TNFα)、白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6、(interleukin-6,IL-6)、白细胞介素10、(interleukin-10,IL-10)-和一氧化氮合成酶(inductible nitric oxide synthase,iNOS)mRNA水平显著升高(P<0.001);与模型组相比,经水提物低剂量治疗后,肝脏组织中IL-6 的mRNA 水平显著降低(P<0.05),IL-1β和iNOS mRNA水平降低但无显著差异;经水提物中剂量治疗后,肝脏组织中TNFα、IL-1β和iNOS的mRNA水平显著降低(P<0.05),IL-6的mRNA 水平降低但无显著差异;经水提取物高剂量治疗后,肝脏组织中IL-1β 和iNOS 的mRNA 水平显著降低(P<0.05),TNFα 和IL-6 mRNA 水平降低但无显著差异;经消炎利胆丸中剂量治疗后,肝脏组织中IL-1β 和iNOS 的mRNA 水平显著降低(P<0.05),IL-6 的mRNA 水平降低但无显著差异,水提物中剂量和水提物高剂量与消炎利胆丸剂中剂量对胆汁淤积小鼠肝脏组织炎症因子的基因表达水平影响作用相近。
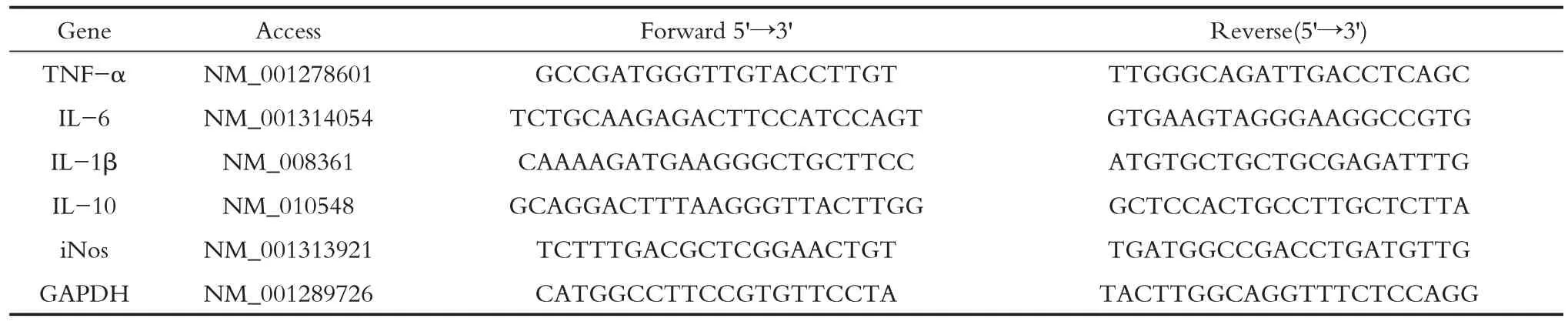
表4 RT-PCR反应所需引物序列Table 4 Primer sequences in real-time PCR analysis
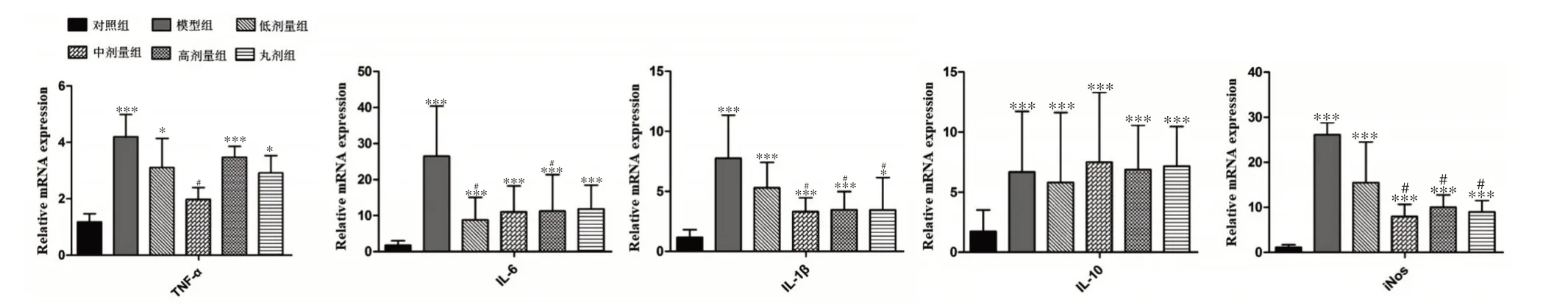
图5 小鼠肝脏组织中炎症因子mRNA表达水平(,n=3)Figure 5 The mRNA expression levels of inflammatory factors in mouse liver tissue(,n=3)
3 讨论
中药复方制剂成分复杂,需要选择合理、客观、科学的指标反映复方制剂提取工艺的优劣,一般以有效成分及干膏得率作为提取工艺评价指标[12]。本研究选用水提法作为提取方法主要基于中药水提物更能体现传统中医药特色,且能保障制剂的安全性和有效性。应用正交实验优选水提工艺,大黄素和大黄酚转移率越高,提取效率越高,可作为考察提取工艺的主要评价指标,同时,以干膏得率为次要指标,通过正交实验对中药组方水提工艺进行了优化筛选,综合评价了实验结果和方法的可行性,并通过重复性的验证实验最终确定了最佳水提取工艺为用10 倍药材量水提取3 次,每次1.5 h,该工艺稳定。以往制剂工艺研究中,主要考察提取物中某一个或几个化学成分和得膏率的变化对提取工艺进行优化[13-14],中药复方制剂成分复杂,应用单个或某几个化学成分为主要评价指标,有可能会导致评价结果的局限性,因此,本实验采取指标成分结合药效学实验对疏肝利胆颗粒的提取工艺进行优选。
胆汁淤积症是由于胆汁久滞、湿热炽盛所致[15]。胆汁淤积可激活巨噬细胞产生促炎介质,如TNF-α、IL-1β、IL-6 等细胞因子,加重肝脏炎症和损伤[16]。ANIT 是一种化学性肝毒性药物,其诱导的小鼠肝内胆汁淤性肝损伤与药物引起的人胆汁淤积性肝损伤发病机制相似[17]。血清AST、ALT、ALP 和TBA 水平是评价胆汁淤积肝损伤的常规指标[18]。ANIT 可引起小鼠血清ALT、AST 和ALP 水平显著增高[19]。本研究结果表明,与空白组相比,模型组血清中TBAs、ALP、AST 和ALT 水平显著升高,肝脏组织中TNFα、IL-1β、IL-6、IL-10 和iNOS 基因表达水平显著升高,肝脏病理学结果显示,肝组织灶性区域肝窦扩张淤血和肝小叶内可见桥接状坏死,表明此时小鼠胆汁淤积型肝损伤模型建立成功。胆汁淤积的中药治疗主要以行气开郁、疏肝利胆、清热化湿为主。消炎利胆丸方中柴胡具有疏散风热,疏肝解郁,升举阳气,其主要成分柴胡皂能通过降低炎症因子水平和转氨酶水平发挥保肝作用[20-21]。青皮具有调节奥狄氏括约肌,加快胆汁排泄的作用[22]。大黄具有泻下利胆、抗菌抗炎和保肝的功效[23]。木香具有明显的利胆和抗炎作用[24]。芒硝可泻下通便、清火消肿,适用于胃肠道疾病[25]。本实验采用ANIT 诱导小鼠胆汁淤积模型进一步明确消炎利胆丸方水提物在缓解胆汁淤积性肝损伤中的作用。研究结果显示,与模型组相比,给予不同剂量水提物和消炎利胆丸中剂量干预7 d后,小鼠血清生化指标水平和肝组织炎症因子mRNA 水平显著降低,肝组织病理学结果表明水提物可明显减轻肝组织病理学损伤程度,表明采用正交实验筛选的水提工艺获得的消炎利胆丸方水提物对ANIT 诱导的小鼠胆汁淤积性肝损伤具有明显保护作用,其机制可能是通过促进胆汁酸外排,减轻肝内胆汁酸负荷,恢复肝内胆汁酸稳态有关。此外,本研究结果还显示出通过抑制肝脏TNFα、IL-1β、IL-6、IL-10和iNOS基因表达能减轻炎症反应。
4 结论
本研究通过正交实验筛选出的水提工艺可作为消炎利胆丸方的最优水提工艺,且获得的水提物对ANIT诱导的小鼠胆汁淤积性肝损伤具有明显保护作用。消炎利胆丸方剂水提工艺的优化有利于疏肝利胆颗粒的开发,并为胆汁淤积的临床治疗提供了更优的治疗药物选择。

