基于“传统+分子生物学”联用技术鉴定 云南华宁产四数九里香药材
周永福,姚如杰,黎学明
(1.重庆工业职业技术学院 应用技术推广中心,重庆 401120;2.重庆紫光化工股份 有限公司 技术中心,重庆 401121;3.重庆大学 化学化工学院,重庆 400044)
民族药“一物多名”“同名异物”“一药多原”现象突出。四数九里香(MurrayatetrameraHuang)为芸香科(Rutaceae)九里香属(Murraya)植物,主要分布于云南、广西、广东、湖南;药用记载始于《文山中草药》,后作为民族药收载于《中国民族药志要》[1]中,民族药名为千只眼。《云南省中药材标准》记载:“本品为芸香科植物千只眼MurrayatetrameraHuang的干燥叶和带叶嫩枝;夏、秋季采集,阴干;性辛,温;归肺、肝经。”有祛风解表、行气止痛、活血散瘀的功效,用于治疗感冒发热、咳嗽、目赤涩痛、皮肤瘙痒、湿疹、风湿麻木、筋骨疼痛、瘀血肿痛。近期研究表明,四数九里香具有良好的药理活性及较高的药用价值[2],目前,因其富含生物碱且具有多种药理作用,有希望成为抗肿瘤新药[3]而备受关注。
然而,关于四数九里香的分类学长期存在争议[4]。原因有以下几点:一是四数九里香别名多,如满山香、满天香、过山香、千只眼、四数花九里香、臭漆、透光草、穿花针,存在与其他种共用别名现象;二是部分处方所用药为替代品,如中成药“三九胃泰”的主药之一,有文献报道的是九里香[5],学名为Murrayaexotica(L.),有的报道是四数九里香[6-7],学名为MurrayatetrameraC.C.Huang;三是四数九里香学名不统一,如有MurrayatetrameraC.C.Huang[8]、MurrayatetrameraHuang in Acta Phytotax.Sin[9]、MurrayatetrameraHuang[10];四是学名一致,但因挥发油成分不一,导致对四数九里香的分类存在争议[11-13]。
近年来,由于PCR技术的快速发展,使得分子鉴定技术正逐渐成为中药鉴定的主要手段[14-15]。DNA条形码作为分子鉴定技术的一种方法,早在2003年由加拿大生物学家Paul Hebert教授提出,因其具有种内变异小、种间变异大及变异区两端序列高度保守等特点,被用于物种的鉴定和识别[16-18]。ITS2序列作为DNA条形码具有独特优势:通用性强,种间变异高于种内变异,扩增片段长度适宜,扩增效率高[19]。陈士林[20]对6 000余份药用植物样本进行DNA条形码序列探索和研究,结果表明ITS2序列的鉴定能力优于国际条形码协会植物工作组提出的matK和rbcL组合,故首次提出将ITS2作为药用植物鉴定的通用条形码序列。
本文为有效解决四数九里香分类学存在的问题,课题组结合现代生物学技术,提出采用“传统+分子生物学”技术联用鉴定云南华宁产四数九里香的方法,从植物来源、外观评价、显微鉴定、理化鉴定、薄层色谱鉴定、分子生物学6个方面系统鉴定本地四数九里香植物,以期为该民族药分类学研究提供参考。
1 实验材料
药材来源于芸香科(Rutaceae)九里香属(Murraya)四数九里香M.tetrameraHuang的干燥叶,2016年2月采自于云南省华宁县。鉴定彝药千只眼所涉及到的实验材料见表1。序列的Genbank登录号见表2。

表1 千只眼分子生物学鉴定仪器及材料
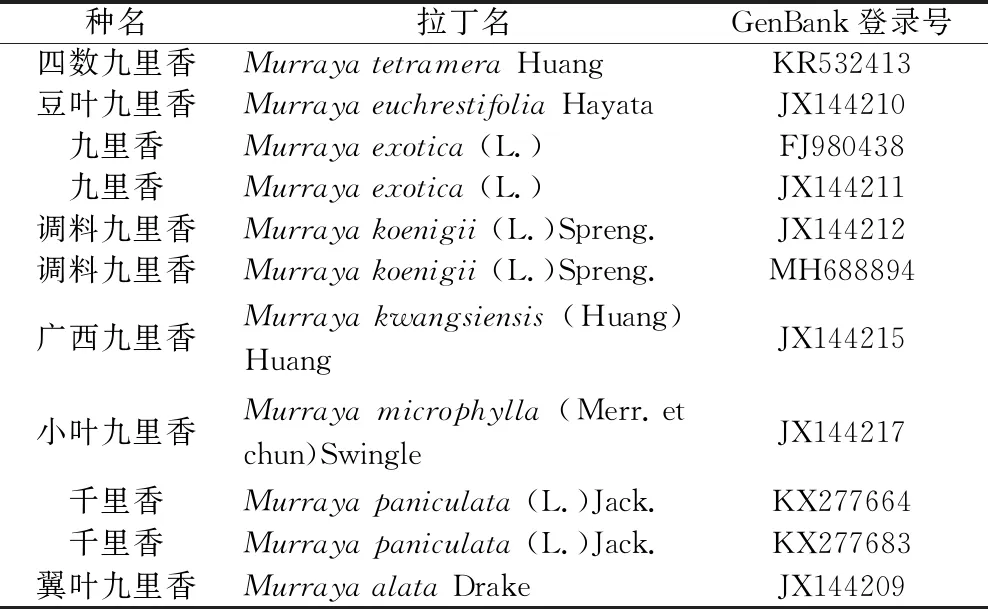
表2 NCBI数据库中的九里香属植物ITS2序列 及GenBank登录号信息
2 实验方法
2.1 传统鉴定方法
采用传统的鉴定方法(植物来源、外观鉴别、显微鉴别、理化鉴别、薄层色谱鉴别)对四数九里香药材进行鉴定。
2.2 分子鉴定方法
2.2.1 RNA提取方法 四数九里香叶片总RNA的提取步骤及方法按北京天根生化科技(北京)有限公司植物基因组试剂盒提取。四数九里香叶片组织经过无水乙醇清洗干净后,取植物组织(干重)约30mg,加入液氮、碾磨;将研磨好的粉末迅速转移到预先装有700μL,65℃预热缓冲液GP1的离心管中(实验前在预热的GP1加入巯基乙醇使其终浓度为1%),迅速颠倒混匀后,将离心管放于65℃水浴20min,水浴过程中颠倒离心管以混合样品数次;加入700μL氯仿,充分混匀,12 000rpm (~13 400×g) 离心5min;小心地将上一步所得上层水相转入一个新的离心管中,加入700μL缓冲液GP2,充分混匀;将混匀的液体转入吸附柱CB3中,12 000rpm (~13 400×g) 离心30sec,弃掉废液;向吸附柱CB3中加入500μL缓冲液GD(使用前请先检查是否已加入无水乙醇),12 000rpm(~13 400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中;向吸附柱CB3中 加入600μL漂洗液PW(使用前请先检查是否已加入无水乙醇),12 000rpm(~13 400×g)离心30sec,倒掉废液,将吸附柱CB3放入收集管中;将吸附柱CB3放回收集管中,12 000rpm(~13 400×g)离心2min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200μL洗脱缓冲液TE,室温放置2~5min,12 000rpm(~13 400×g)离心2min,将溶液收集到离心管中。
2.2.2 PCR扩增方法 根据GenBank登录的九里香属ITS2序列保守区域设计一对扩增引物,引物序列见表3,由成都擎科伟业有限公司提供。PCR反应体系及扩增条件见表4、表5。

表3 四数九里香ITS2基因的扩增引物

表4 扩增引物反应体系

表5 PCR 扩增仪扩增条件
根据计算,按照一定比例配制足量的PCR反应体系,体系包括ddH2O8.5μL,正反向引物各1.0μL,I-5TM2x High-Fidelity Master Mix 12.5μL,模板DNA 2μL,为25μL。
扩增程序:预变性:98℃、2min;循环:98℃、10s;退火:55℃、30s;延伸:72℃、30s;循环35次;末次延伸为72℃、5min,4℃,5min。PCR反应设置不含DNA模板的溶液作为空白对照。
2.2.3 凝胶电泳方法 取0.2g的琼脂糖粉末,置于150mL锥形瓶中,加入适量的电泳缓冲溶液TBE,制得1.5%琼脂糖凝胶液,冷却、制得支持物,根据扩增产物的位点,用相应的酶切。取PCR扩增产物通过1.5%琼脂凝胶电泳检测,在150V、100mA的电场强度下,通过分子筛效应筛选20min,观察溴酚蓝带的移动现象,待电泳分离后,于紫外透视仪观察图谱,获得符合理论的双向测序片段。
2.2.4 系统进化树构建 将测序所得的文件用软件对测序结果校对和拼接,直接将四数九里香的ITS2基因核苷酸序列(450bp),拼接结果与表2(序列的GenBank登录号)进行Blast比对,计算K2P遗传距离,再构建系统进化树。
3 实验结果
3.1 药材来源
2016年2月,课题组在云南苗岭山莊药业股份有限责任公司专家周玉忠(苗药专家)的指导和带领下,亲赴云南省华宁县青龙镇马鹿塘村委会马鞍山村(民族村)的河谷(当地叫喜黑山谷)采样。四数九里香被当地民族(苗族)称为“蒙鼻诸第日”,而贵州松桃地区苗人称为“Ndutjeub”。样品后经成都中医药大学陈新教授鉴定为芸香科(Rutaceae)九里香属(Murraya)四数九里香M.tetrameraHuang植物。目前,标本保存于重庆工业职业技术学院药物化学研究所,见图1。

注:该图为2016年2月周永福摄于云南华宁。
经采样现场勘查,该植物群落生长在伴有石灰岩的斜坡环境中,植株根系发达,个体高、叶茂盛;该植物群落大、棚数多,占地面积达20公顷,生产年限久远。课题组在采样后,样品经当地居民使用骡马驮运至机动车能到达处。
3.2 外观鉴别
该植物生长于伴有石灰岩的斜坡中,喜温湿气候,高1~7m;叶片呈披针形或卵形,单数羽状复叶,小叶5~9片,长0.8~2.5cm,宽0.8~2.0cm,先端钝尖,基部楔形,见图2、图3、图4,新鲜叶为深绿色,气味浓,表面有色泽,干燥后呈暗绿色。

图2 四数九里香干燥叶外观性状

图3 四数九里香生境(二)

图4 四数九里香茎外观性状
3.3 显微鉴别
四数九里香叶粉末呈现绿褐色,表皮细胞呈不规则形,气孔多数不定式;非腺毛单细胞长30~100μm,壁厚;叶肉组织成晶纤维;栅栏组织细胞排列成行,含草酸钙方晶;油室直径60~120μm,呈圆形,有的内含黄色油滴。
3.4 理化鉴别
取四数九里香粗粉2g(20目),加乙醇20mL,回流提取30min,冷却、滤过;取滤液5mL,蒸干,残渣加乙酸乙酯2mL溶解,置试管中,加新制的7%盐酸羟胺-甲醇溶液与10%氢氧化钾-甲醇溶液各2~3滴,摇匀,微热,放冷,加稀盐酸调节pH值至3~4,加1% TeCl3-CH3CH2OH溶液,反应现象为紫红色。
3.5 色谱鉴别
取四数九里香粗粉2g(20目),加乙醇20mL,回流提取30min,冷却、滤过、蒸干,残渣加甲醇2mL溶解,置样品瓶中,用毛细管取样、点板,在展开槽中进行展开,展开剂为丙酮比二氯甲烷=1∶1,在254nm波长处观察,存在斑点。
3.6 分子鉴定结果
3.6.1 样品总RNA提取 按照北京天根生化科技(北京)有限公司植物基因组试剂盒提取步骤及方法提取四数九里香叶片总RNA,结果显示,提取的总RNA质量好,条带清晰,无明显降解。
3.6.2 PCR扩增结果 利用所设计的成熟酶K基因扩增引物F1/R2对四数九里香叶的cDNA进行PCR扩增,经扩增之后,采用琼脂糖凝胶电泳分析方法在150V、100mA 的条件下分析20min,四数九里香的PCR电泳结果显示亮条带,得长度约为450bp的扩增片段,PCR产物双向测序结果见图5、图6。测序结果表明该基因为四数九里香的ITS2基因序列。经过NCBI序列相似性比对(Blastn),发现该植物基因核苷酸序列与GenBank中的Murraya tetramera(登录号:KR532413)的matK基因核苷酸序列一致。
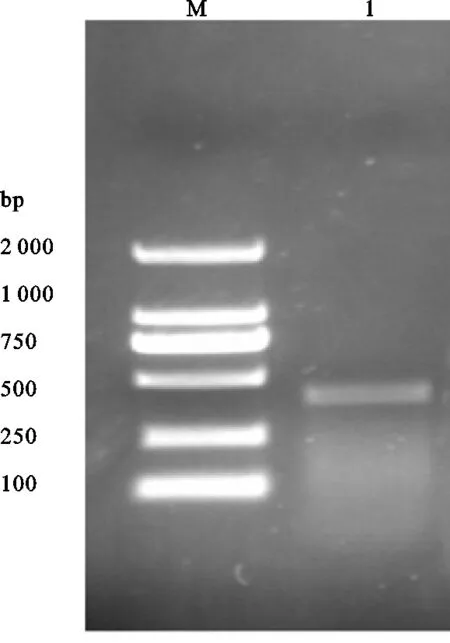
注:M为DL2000 Marker,I为样本扩增电泳结果。
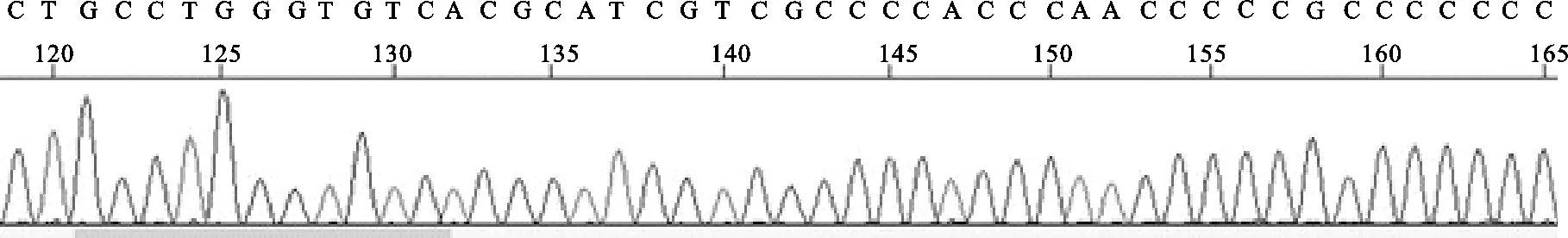
图6 样本测序峰图(部分)
3.6.3 Matk拼接结果 经过软件拼接之后,获得完整的四数九里香高质量DNA序列图谱;结果为GAAGTAAATATTTGACTCGATACAAACTCTTTT TTGTTGAAGATCCGCTGTAATAATGAGAAAGA TTTCTGCATATACGCACAAATCGGTCGATAAGA TGAGAATCAGAGAAATCGGCCCAGGTCGACTT ACTGATGGGATGCCCTAATGCGTTACAAAACCG CGCCTTAGTCAATGATCCAATCAGATGAATAAT GGGAACGGTCGTATCGACCTTCTTCCTAGAATT ACCTATTAGAAATGAATTTTCTAGCATTTGACT CCGTACCAACAAAGAATTGAGTCGCACACCGG AAAGATAGCCCAGAAAGTTAATAGCGTACTTGC CTAAATATAAGTGGTTTAGCTGAACCCTTCCTGGTCGAGAAGACACGTGAAAATGCCATTGCCATA AACCGACAAGGTAATATTTCCATTTATTCATCAG AAGAGGCGTATCCTTTGAAGCCAAAATGGATTT TCCTTGATATCTAACATAATGCATGAAAGGATCC TTGAACAACCCTAAGATGTCCGGAAAATCTTTA GCAACATCTTCGACAAGATGTTCGACTTTTCCA TAGAAATACATTCGCTCAACGAGGACTCGAGAG GATGTTGATTGTAAATGAGATGCTTGGTTACAG AGAAAAAAGAGGATGGATTCATATTCATATACAT GAGAATTATATAGAAACAATAACAATCTTGGATT ACTTTTTAAAAAAACAGAAATAGAGTTCTTTG GAGTAATAAGACTGTTCGAATTAAAATACTCGT GGAGAAAGAACCGTAATAAATGTAAAGAAGAG GCATCCTTTACCCAGTCGCGAAGGGTTTGAAC CAGGATTTCGGGACAAGTGGGGTGGGGTATTC GTACATCTAACACATAATTTAAATGGGACAATT TATCC。该研究结果为云南华宁产四数九里香提供分子生物学鉴定依据。
3.6.4 系统发育树构建 对四数九里香的ITS2基因进行测序获得其高质量的DNA序列,利用MEGA6.0软件与GenBank中下载的九里香属植物ITS2序列邻接、构建聚类系统发育树,见表6、图7。从构建的NJ树可以看出,所分析样品与GenBank中的四数九里香聚为一支,说明可以将所分析的样品与四数九里香归为一个种,因此,ITS2序列作为条形码可以快速准确鉴别民族药四数九里香及其同属植物,这一结论与外观评价一致,为外观评价准确性提供分子证据。
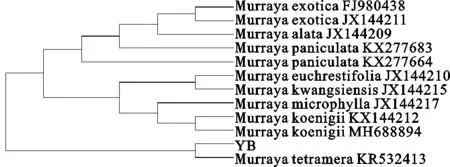
注:*YB为四数九里香植物样本,下同。
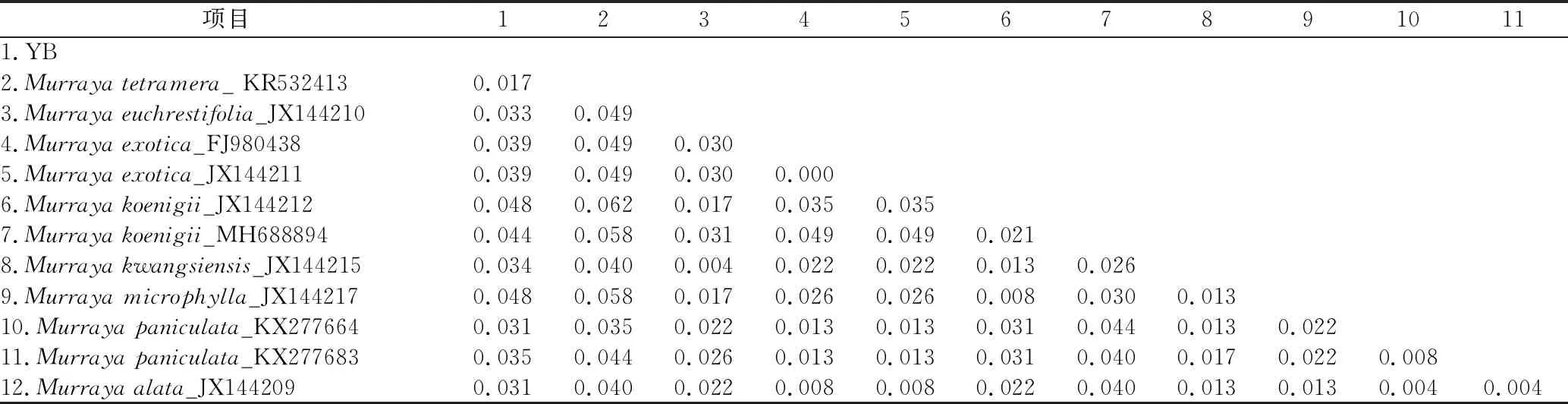
表6 九里香属植物ITS2序列遗传距离分析
3.6.5 遗传距离 将各序列用Mega 6.0软件进行样本序列比对之后,与NCBI数据库中九里香属植物ITS2序列的K2P遗传距离进行对比,结果见表6,发现样本与九里香属植物的K2P遗传距离介于0.017~0.048之间,其中与四数九里香(M.tetramera)K2P的遗传距离最小为0.017,与小叶九里香(M.microphylla)和调料九里香(M.koenigii)K2P遗传距离最大均为0.048。
4 讨论与结论
近年来,关于民族药四数九里香的研究和报道主要集中在化学成分及其药理作用方面,而针对于其物种鉴别鲜有报道。随着PCR技术的快速发展,分子鉴定技术已经成为中草药鉴定的主要手段,本文从药材来源、外观评价、显微鉴别、理化鉴别、薄层色谱鉴定、分子生物学鉴定六个层面系统地对民族药四数九里香进行鉴定研究。采用Mega 6.0软件计算检测四数九里香DNA序列与NCBI数据库中九里香属植物ITS2序列的K2P遗传距离,并进行了比对,发现民族药四数九里香与数据库中的K2P遗传距离最小,为0.017;同时采用邻接法构建系统发育进化树发现检测样本与四数九里香聚为一致;此结果为民族药四数九里香在基原及品种鉴定上提供了依据。

