外源线粒体移植减轻紫外线刺激下皮肤成纤维细胞的凋亡
石晋 张文慧 陈怡成 齐开 宁小娜 丁明超 路子涵 刘富伟
颌面部皮肤裸露在外,长期或高强度的暴露于紫外线刺激下,将出现皮肤光老化,表现为受累皮肤干燥、粗糙、皱纹、过角化,甚至诱发皮肤癌[1-2]。
线粒体作为细胞的能量转化和信号转导中心,紫外线刺激会造成皮肤成纤维细胞内线粒体结构与功能损害,从而导致活性氧(reactive oxygen species,ROS)等毒素堆积,破坏细胞功能,是皮肤成纤维细胞凋亡或死亡的关键。目前解决该问题的主要策略有两种,一是应用SOD、CoQ10等ROS清除药物;二是通过促进线粒体自噬等方式清除已经受损的线粒体,维持细胞内环境稳态。然而上述方法并不能补充已损失的线粒体,整体功能依旧处于受损状态[3-6]。
线粒体移植(mitochondrial transplantation,MTP)是将具备呼吸能力的健康线粒体注射到受损器官中,直接补充细胞内线粒体。分离纯化到的线粒体与细胞共培养,外源线粒体通过肌动蛋白依赖性内吞作用或胞饮进入细胞,形成内体或巨饮小体,通过MFN1/2和OPA1蛋白介导与内源线粒体融合。一小部分外源线粒体与溶酶体结合并被降解;大量外源线粒体从核内体、大蛋白酶体或溶酶体中逃逸出来。线粒体移植已被证明可快速恢复心肌、神经、骨等细胞的功能,并开展了部分临床实验,从而在线粒体异常相关疾病的治疗中备受关注[7]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)线粒体含量较高,增殖能力强,且具有分化为皮肤成纤维细胞潜能,是理想的供体细胞。本研究将基于紫外线刺激皮肤成纤维细胞的皮肤光老化体外模型,明确移植BMMSCs来源的线粒体是否可以恢复细胞内整体线粒体功能,从而减轻紫外线刺激引起的细胞凋亡,为治疗皮肤光老化等相关问题提供新思路。
1 材料与方法
1.1 主要材料、试剂与仪器
MEM-α培养基(Gibco公司,美国);DMEM/F-12、胎牛血清(Cytiva公司,美国);磷酸盐缓冲液(PBS)、胰蛋白酶-EDTA消化液(PCM公司,法国);二甲基亚砜(DMSO)(Sigma-Aldrich公司,德国);荧光染料JC-1、细胞线粒体提取试剂盒、碘化丙啶(PI)、CCK-8(上海碧云天)。紫外UVA固化灯、UVA辐照剂量检测计(台湾泰玛斯公司);CO2培养箱(Thermo公司,美国);倒置显微镜、流式细胞仪、激光共聚焦显微镜(Olympus公司,日本);离心机(eppendorf公司,德国)。
1.2 试验方法
1.2.1 BMMSCs线粒体提取 体外稳定扩增的BMMSCs按2 000 万的比例加入1 mL线粒体分离试剂,轻悬细胞后冰浴静置15 min,随后将细胞悬液转移至玻璃匀浆器中,匀浆15 次左右后进行台盼蓝染色,当阳性比例超过50%时将细胞匀浆在600 g,4 ℃离心10 min。小心将上清转移至新的EP管中,11 000 g,4 ℃离心10 min。弃去上清,沉淀即为分离得到的BMMSCs线粒体。
1.2.2 细胞模型的建立 选用小鼠成纤维细胞NIH/3T3,购自上海酶研生物科技。当细胞融合度约60%时,PBS缓冲液清洗1 次,加入1%的H2O2稀释液覆盖成纤维细胞进行预处理,置于紫外光源正下方10 cm处进行辐照,使用流式细胞仪检测细胞存活,细胞存活率到50%(辐照强度:10 mW/cm2,辐照时间:10 min,累计辐照剂量:6 J/cm2。辐照剂量=辐照强度×辐照时间)。辐照结束后,弃废液,依据实验分组,加入DMEM/F-12(紫外刺激组)或DMEM/F-12稀释的外源性线粒体(线粒体治疗组)置于细胞孵育箱进行培养[8]。
1.2.3 线粒体数量及膜电位检测 线粒体处理组分别设置3 个共培养时间(6、12和24 h)和3 个线粒体质量浓度1×、5×、10×(1.56、7.8、15.6 mg/mL)进行检测。在1.5 J/cm2低辐照下处理细胞后进行实验。按照50 μL JC-1(200×)加入8 mL超纯水的比例稀释。充分溶解混合之后加入2 mL JC-1染色缓冲液(5×)得到JC-1染色工作液。待检测成纤维细胞先用PBS清洗1 遍,分别加入1 mL JC-1染色工作液,充分混匀后细胞培养箱中37 ℃孵育20 min。在孵育期间,按照每1 mL JC-1染色缓冲液(5×)加入4 mL蒸馏水的比例,配制适量的JC-1染色缓冲液(1×),并放置于冰浴。37 ℃孵育结束后,吸除上清,用JC-1染色缓冲液(1×)洗涤2 次。随后加入2 mL细胞培养液,在激光共聚焦显微镜下观察,每组选择3 个视野,每个视野拍摄3 次,并通过image J软件计算分析线粒体数量及膜电位。首先分离出单独红色荧光通道。其次通过Threshold调整阈值,清除背景,该实验中后续分析平均荧光强度时均用此阈值。分析绿色荧光通道的平均荧光强度方法同上。
1.2.4 流式细胞仪检测细胞凋亡 依据模拟环境针对性设计分组,增加未经紫外刺激的正常细胞为空白对照组。对于普通刺激,线粒体处理组设置3 个质量浓度,1×、5×、10×(1.56、7.8、15.6 mg/mL),时间为12 h;对于极端刺激,提高线粒体处理组质量浓度为2.81、14.0、28.1 mg/mL,并增加处理时间为36 h。每个分组设置3 个重复孔。对各组细胞,取对数生长期细胞消化后接种至10 mm小皿中,待细胞铺板率达到60%时进行紫外处理以及外源性线粒体移植治疗。将提取的BMMSCs来源线粒体用DMEM/F-12稀释成所需质量浓度,并分别加入紫外处理后的成纤维细胞中。给药完成后将培养皿放置在37 ℃、体积分数5%CO2的培养箱中培养。细胞孵育培养至检测时间点后弃掉上清,收集细胞并用PBS清洗1 次,加入PI染料剂使用流式细胞仪进行凋亡检测。
1.2.5 CCK-8(Cell Counting Kit-8)检测细胞存活
设计分组为未经紫外刺激的空白对照组,经过紫外刺激的阴性对照组以及不同质量浓度的线粒体处理组1×、5×、10×。将制备好的细胞悬液计数后接种于96孔板上,加入100 μl细胞悬液,每组设置3 个复孔。将培养板置于培养箱中预培养(37 ℃,5%CO2)使细胞贴壁。每孔加入10 μL CCK-8试剂后将培养板放入培养箱中孵育1 h。酶标仪测定共培养6 h,12 h和24 h后450 nm处的吸光度A值。
1.3 统计学分析
采用GraphPad Prism8.3.0统计软件进行单因素方差分析,检验水平P<0.05差异具有统计学意义。
2 结 果
2.1 紫外刺激对皮肤成纤维细胞存活率的影响
采用流式细胞仪对不同紫外照射剂量后的皮肤成纤维细胞进行了细胞凋亡测试。如图1,在10 mW/cm2光照条件下,随着光照时间的增加,0~5 min(辐照剂量为1.5 J/cm2)细胞存活率由96.3%到88.5%(P<0.01),下降缓慢。5~15 min(辐照剂量为6 J/cm2),细胞存活率下降速度增加,由88.5%到25.8%(P<0.000 1)。15~30 min(辐照剂量为9 J/cm2),细胞存活率趋于平缓(P>0.05)。由此可知,细胞在低剂量辐照条件下损伤程度较轻,随着时间的增加,细胞损伤逐渐严重并且速度加快。但是超过15 min后细胞损伤趋于平缓,故辐照剂量为9 J/cm2,细胞基本坏死。根据文献[9],本研究将选择1.5 J /cm2作为低辐照剂量代表平原紫外线强度,6 J/cm2作为高辐照剂量代表高原紫外线强度展开后续试验。
2.2 线粒体浓度、时间对细胞内移植效率的影响
为了阐明皮肤成纤维细胞对外源性线粒体的接受程度,在1.5 J/cm2低辐照下处理细胞后,使用JC-1染料检测线粒体膜电位的变化。单体JC-1显示绿色荧光,在膜电位高,即线粒体功能正常时,聚集显示红色荧光。故JC-1染色后线粒体的颜色差异可以用来评估移植线粒体对细胞内最终线粒体的影响。
如图2,在同样的共培养治疗时间下,激光共聚焦显微镜观察外源性线粒体质量浓度对细胞内最终线粒体的影响。与紫外刺激组相比,在1×(1.56 mg/mL)线粒体浓度下,绿色荧光稍弱,但难以发现红色荧光(P>0.05)。随着外源性线粒体浓度的增加,绿色荧光强度先减弱后增强(P>0.05)。其原因可能是随着外源性线粒体浓度增加,部分线粒体膜电位降低,导致绿色荧光增强,但是红绿荧光强度比值整体呈上升趋势(P<0.05)。而红色荧光强度明显增强(P<0.05),并且红色荧光集落形成单位面积增加。因此,在同样的共培养治疗时间下,加入的BMMSCs外源性线粒体质量浓度越大,细胞摄取的外源性线粒体越多,且能逆转原有细胞内降低的线粒体膜电位,改善线粒体功能。
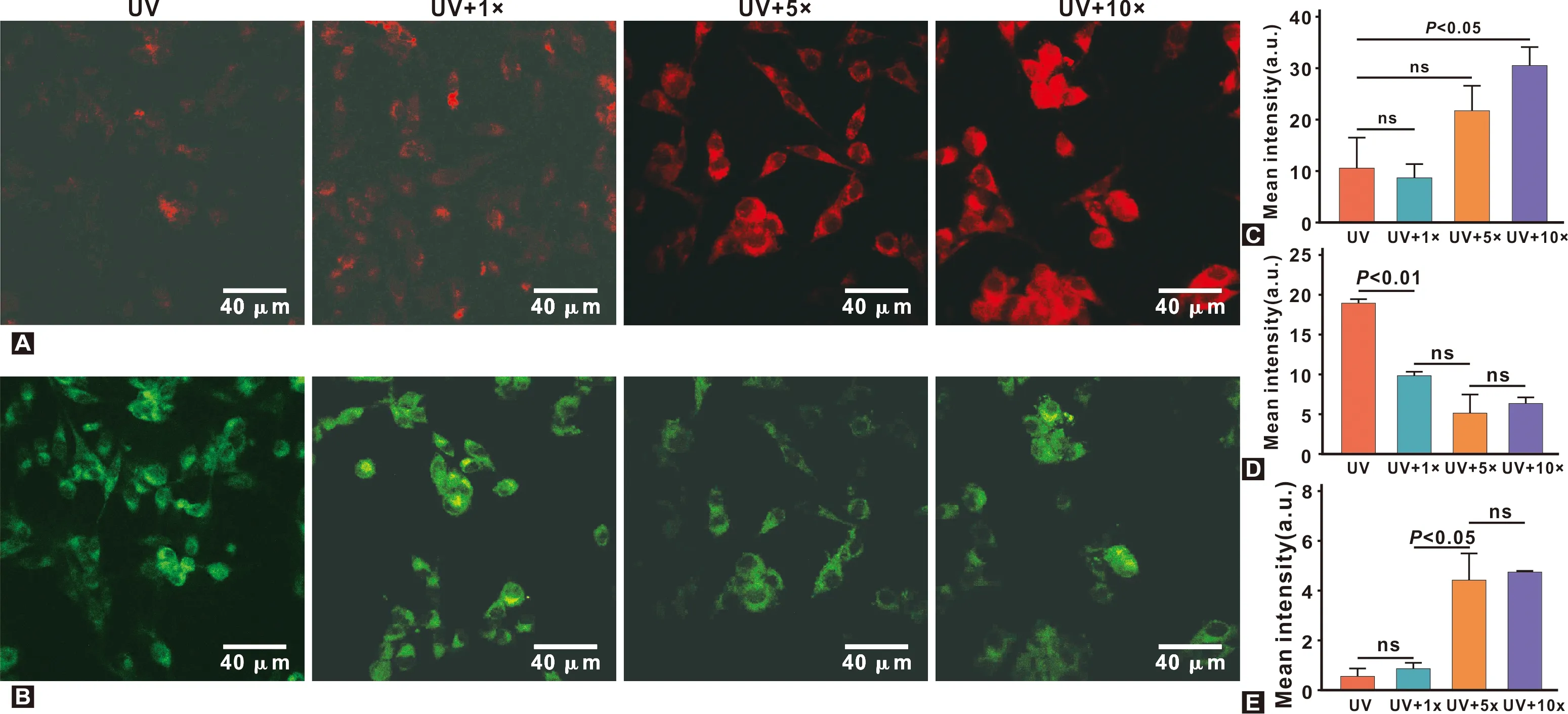
图2 移植线粒体浓度对细胞内移植效率的影响
如图3,在加入同等质量分数的外源性线粒体后,与紫外刺激组相比,红色荧光强度随着时间的增加明显增强(P<0.05),绿色荧光强度减弱(P<0.01),表明此时线粒体膜电位处于较高的水平。并且红色荧光集落形成单位面积增加,在孵育24 h后达到50%。故说明在移植外源性线粒体之后,共培养处理时间越长,皮肤成纤维细胞接受外源性线粒体程度越高。
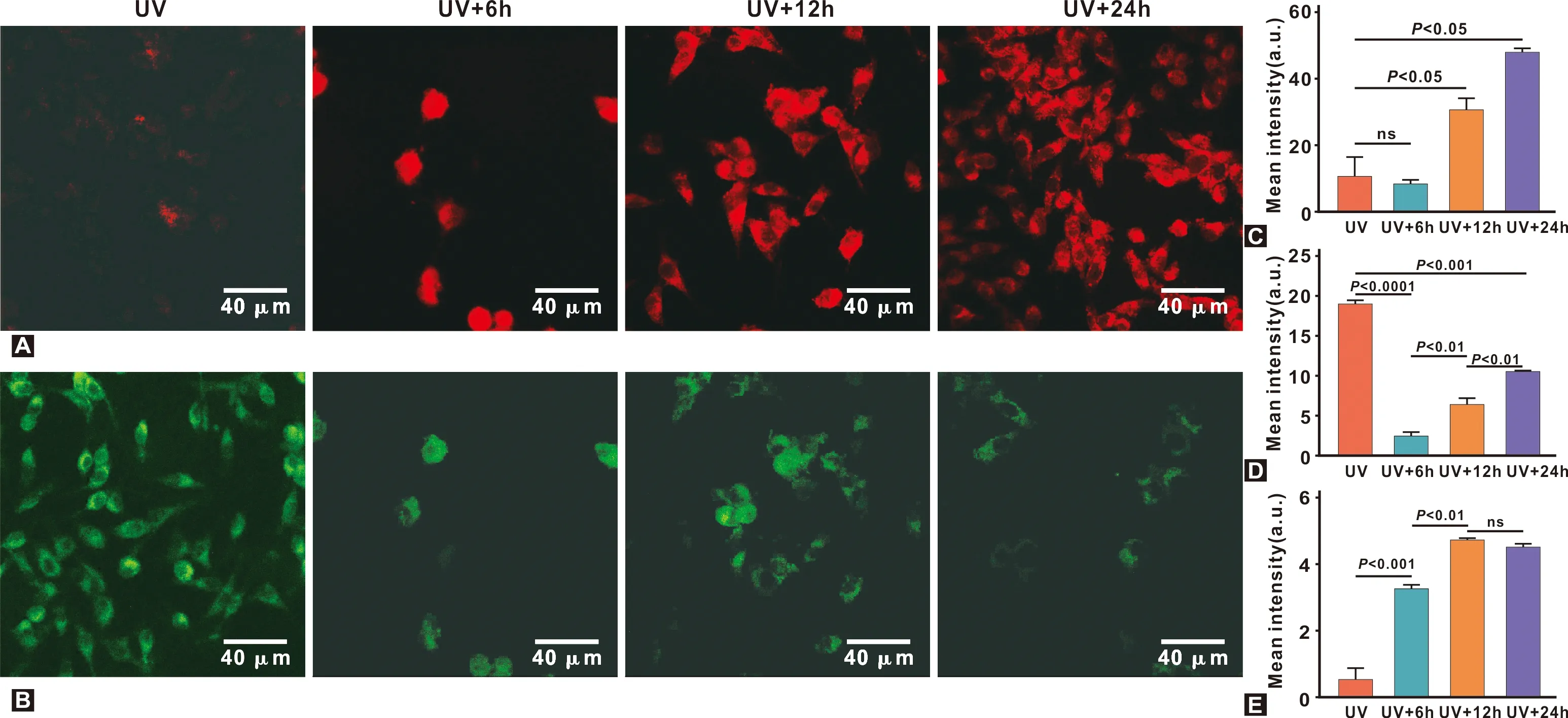
图3 移植线粒体时间对细胞内移植效率的影响
2.3 线粒体移植对普通和极端紫外线刺激下细胞凋亡的影响
采用低辐照剂量:1.5 J/cm2,以模拟普通紫外辐照强度。用流式细胞仪检测细胞凋亡情况。如图4A,紫外刺激组与空白组相比,细胞存活率由97.9%减少到87.5%(P<0.000 1),并且晚期凋亡细胞率由1.5%上升至7%(P<0.000 1),说明该条件下,紫外对细胞有一定的损伤作用。在移植不同质量分数的外源性线粒体进行治疗后,3 组实验组相比,坏死细胞和晚期凋亡细胞数量未发生明显变化,但存活细胞比例随着移植线粒体质量浓度增加,10×(1.56 mg/mL)浓度的外源性线粒体存活率较于1×的外源性线粒体存活率由83.2%增至89.4%(P<0.001),并且,早期凋亡的细胞由11.6%降至5.6%(P<0.001),呈现剂量依赖特点。随着加入的外源性线粒体的浓度的增加,存活细胞增加以及早期凋亡细胞比例成倍减少。这说明在低辐照情况下,外源性的线粒体治疗可以增强细胞活性,减缓细胞凋亡和坏死。
高辐照剂量:6 J/cm2,模拟极端紫外辐照强度。如图4B,紫外刺激组相比于空白组细胞存活率显著减低,由96.1%减少至48.7%(P<0.0001),坏死细胞、早期凋亡和晚期凋亡细胞比例均大幅度增加,其中晚期凋亡的细胞由3.1%增长至37.1%(P<0.0001),由此说明高剂量紫外辐照对细胞的损伤巨大。在加入不同剂量的线粒体治疗之后,3 组实验组相比,坏死细胞、早期凋亡和晚期凋亡比例均有明显减少。其中,10×外源性线粒体细胞晚期凋亡率较于1×外源性线粒体相比,晚期凋亡率由11.6%减少至4.5%(P<0.0001),坏死细胞与早期凋亡率分别由1.1%和3.9%减少至0.3%和2.7%(P>0.05)。实验组中随着加入的线粒体浓度的增加,细胞存活率由83.4%增长至92.6%(P<0.0001),已基本恢复至正常。由此可见,高紫外辐照后的皮肤成纤维细胞在经过外源性线粒体治疗之后不仅可以减缓细胞凋亡,而且有望恢复正常的细胞代谢功能。
2.4 线粒体移植对紫外刺激的细胞存活CCK-8验证
为了验证线粒体移植对细胞的存活率的影响,采用紫外(1.5 J/cm2)辐照刺激成纤维细胞,利用CCK-8试剂盒进行检测。如图5,与线粒体共培养6 h后,与空白对照组相比,紫外刺激组的归一化细胞存活率急剧减少,在加入不同浓度的外源性线粒体之后,细胞存活率有所上升。成纤维细胞与外源性线粒体共培养12 h和24 h之后,紫外刺激组的细胞活性均有所恢复。相比于紫外刺激组,不同浓度外源性线粒体组的细胞存活率呈上升趋势,且在10×的浓度的恢复效果更好。随着成纤维细胞与外源性线粒体共培养时间越长,以及外源性线粒体浓度越高,受损成纤维细胞的恢复能力越强。在培养24 h后,添加10×外源性线粒体的细胞存活率达到85%(P<0.01),已几乎接近正常细胞。由此得出,紫外辐照后的皮肤成纤维细胞在经过外源性线粒体治疗后可以促进细胞存活,表明外源性的线粒体对受损的成纤维细胞有积极作用。
3 讨 论
皮肤受到紫外线辐射后会引起皮肤细胞的光损伤,加速皮肤的衰老,严重的甚至会诱发皮肤癌。线粒体作为生物体的立命之本,通过氧化呼吸链反应为细胞持续供能。然而,长时间或高强度的紫外刺激会造成线粒体结构与功能损害,从而导致ROS等毒素堆积,严重影响细胞状态,诱发细胞凋亡或死亡[10-11]。因此,逆转线粒体损伤从而减轻细胞凋亡成为治疗皮肤光老化的重要方式。
结果显示:BMMSCs来源线粒体可移植进入皮肤成纤维细胞中,并成功治疗紫外线刺激造成的线粒体膜电位下降,治疗效果具有时间、浓度依赖性。尤其在极端刺激环境中,该方法可全面减轻细胞死亡、晚期与早期凋亡,恢复存活细胞数量。从而证实外源性线粒体移植可显著减轻紫外线刺激引起的细胞凋亡,为其在皮肤光老化治疗中的应用提供实验依据。
首先,线粒体移植直接补充了受损线粒体的空缺,高效恢复细胞功能。目前,针对紫外线造成的皮肤光老化,除应用氧化锌、二氧化钛等高反光材料进行遮挡预防外,主要采用两种策略:一是应用SOD、CoQ10等ROS清除药物,减少毒素影响。CoQ10作为呼吸链复合物I/II和III之间的电子穿梭者,研究表明局部应用CoQ10可以防止紫外线引起的皮肤损伤,并增加胶原密度和成纤维细胞的数量。但是CoQ10的分离提取方法较难,产率不高[12-14]。同时,更为关键的是,此类方法对已发生的ROS累积所致病变效果有限,因此多提前应用与预防。近年来,多款植物提取物与中药成分,如从甘草根部提取的Licochalcone A成分,从橄榄果实中提取的羟基酪醇等,也被证实有清除ROS能力,促进胶原蛋白产生,具有预防光老化可能,在皮肤美容领域应用广泛;二是通过促进线粒体自噬等方式清除已经受损的线粒体,改善受损细胞内的线粒体质量[15]。也可通过药物直接刺激线粒体功能,如甲状腺激素,能显著增强线粒体活性。然而上述方法并不能补充已损失的线粒体,细胞的整体功能依旧处于受损状态。而线粒体移植则直接将健康线粒体补充到受损细胞中,恢复受损细胞的功能,这为逆转正在发生的病变提供可能。研究结果显示,通过线粒体移植,不但膜电位正常的线粒体增多,紫外损伤造成的膜电位降低的线粒体也逐渐减少,并最终使细胞由凋亡过程逆转回存活细胞状态。
从物种演化角度,线粒体高度保守,免疫原性低,应用安全性高。Ramirez-Barbieri等[16]通过观察小鼠自体和同种异体的线粒体移植产生的免疫排斥反应发现,自体细胞或异体细胞来源及注射方式,均未引起血清炎性标志物表达的明显变化。虽然平均每个BMMSCs细胞内有300~400 个线粒体,更活跃的细胞如肌肉、心脏、肝等细胞有成百上千的线粒体,约占细胞质的40%,但上述细胞难以提取或连续传代,而BMMSCs线粒体含量较高,增殖能力强,且具有分化为皮肤成纤维细胞潜能,是理想的供体细胞。
局部注射进行线粒体移植简单、安全、方便,更易临床转化。越来越多的证据表明,机体内存在线粒体在细胞间的主动转运,如脂肪细胞内线粒体可主动转运至巨噬细胞中,从而调节局部免疫微环境[17-18]。该研究中,通过体外共孵育模拟单纯局部注射线粒体的情况,线粒体可转运至细胞内部起到治疗作用,甚至在极端刺激环境中,该方法几乎恢复了紫外照射前的存活细胞数量。目前,线粒体移植在改善心、肝、肺等方面的缺血再灌注损伤、以及癌症方面已经取得不错的治疗效果[19-21]。McCully组研究了线粒体移植在不同时间点对肝脏缺血再灌注损伤的治疗效果,在缺血前或灌注后2 h注射含线粒体载体可以改善引起肝脏缺血再灌注损伤的心肌梗死[22]。Chien等[23]研究表明,用从大鼠皮质神经元新提取的线粒体补充受损的海马神经元可促进神经突再生并在受伤神经元中重新建立膜电位。因此,局部注射进行线粒体移植有望满足临床需要,无需增加囊泡等递送形式。
本研究为外源性线粒体移植在皮肤光老化治疗中的应用提供了实验依据。进一步研究将探讨线粒体移植后的功能变化,逆转衰老等问题,拓展其应用领域。

