猪肉及猪肝中四环素类药物残留量测定的高效液相色谱法
牛 蓉,秦丽波*,李远恒,周兰兰, 孙志文
(1.河南宏信检测技术有限公司农产食品检测中心,河南南阳 473000;2.牧原食品股份有限公司,河南南阳 473000;3.北京市农产品质量安全中心,北京 100000)
四环素类属于广谱抗生素,对革兰氏阳性和阴性细菌、立克次氏体等均有抑菌作用[1-2],其作用机制主要是和30S核糖体亚基的末端结合,从而干扰细菌蛋白质的合成[3]。常用的四环素类主要有四环素、金霉素、土霉素、多西环素等,该类药物在畜禽养殖过程中被广泛作为药物添加剂使用,用于防止肠道感染和促生长[4],但长期使用甚至滥用则会导致药物在动物体内滞留或蓄积,并以残留的方式进入人体及生态环境,从而危害人体健康及生态环境[5]。因此四环素类药物的残留监控尤为重要。目前,四环素类药物的残留分析的资料较多[6-8],主要有液相色谱-串联质谱法、高效液相色谱法、酶联免疫法等[9-10]。本研究参考《GB 31658.6-2021 食品安全国家标准 动物性食品中四环素类药物残留量的测定 高效液相色谱法》中四环素类药物的测定方法[11],并在其基础上进行了改进优化,拟建立猪肉及猪肝中的四环素、土霉素、金霉素及多西环素这四种药物残留量测定的高效液相色谱法,为国家兽药残留监控体系提供更为可靠的技术支撑。
1 材料与方法
1.1 仪器及设备 高效液相色谱仪:E2695,配2489紫外检测器,美国沃特世公司;电子天平:MS105DU,感量0.01 mg,德国梅特勒托利多公司;电子天平:HZF-A200,感量0.01 g,福州志华电子有限公司;多管混匀仪:UMV-2,北京优晟联合科技有限公司;高速冷冻离心机:CH160R,湖南湘仪离心机仪器有限公司;氮吹仪:NGB-1024,莱谱(北京)科技有限公司;固相萃取装置:24位,上海安谱实验科技股份有限公司。
1.2 药品及材料 盐酸四环素:含量98.00%,批号5352101,坛墨质检;土霉素盐酸盐:含量89.62%,批号G1125763, 德国Dr.Ehrenstorfer公司;金霉素盐酸盐:含量92.90%,批号1112164,德国Dr.Ehrenstorfer公司;盐酸多西环素:含量98.00%,批号1116543,德国Dr.Ehrenstorfer公司;甲醇、乙腈:色谱级,美国天地有限公司;三氟乙酸、乙二胺四乙酸二钠、柠檬酸、磷酸氢二钠、草酸、硫酸、钨酸钠:分析级,国药集团化学技术有限公司;HLB固相萃取柱:规格500 mg/6 mL,上海安谱实验科技股份有限公司;LCX固相萃取柱:规格500 mg/6 mL,天津博纳艾杰尔科技有限公司。
1.3 溶液配制
1.3.1 标准储备溶液 精密称定盐酸四环素、土霉素盐酸盐、金霉素盐酸盐、盐酸多西环素标准品适量(相当于四环素、土霉素、金霉素、多西环素各10 mg),用甲醇溶解并稀释定容至不同10 mL容量瓶内,配制成浓度为1 mg/mL的标准储备溶液。-18 ℃以下保存,有效期为1个月。
1.3.2 混合标准中间液 精密量取土霉素、四环素、金霉素和多西环素标准储备液各0.1 mL, 于10 mL容量瓶中,用甲醇稀释至刻度,配制成浓度为10 μg/mL的混合标准中间液。2~8 ℃保存。现用现配。
1.3.3 柠檬酸溶液 取柠檬酸21.01 g,用水溶解并稀释至1000 mL。
1.3.4 磷酸氢二钠溶液 取无水磷酸氢二钠71.63 g,用水溶解并稀释至1000 mL。
1.3.5 Mcllvaine缓冲溶液(pH 4.0) 取柠檬酸溶液1000 mL、无水磷酸氢二钠溶液625 mL, 混匀,用盐酸或氢氧化钠溶液调pH至4.0±0.05。
1.3.6 Na2EDTA-Mcllvaine缓冲溶液 取乙二胺四乙酸二钠60.5 g,加Mcllvaine缓冲溶液1625 mL,溶解,混匀。
1.3.7 草酸溶液(0.01 mol/L) 取草酸1.26 g,用水溶解并稀释至1000 mL。
1.3.8 三氟乙酸溶液(0.01 mol/L) 取三氟乙酸0.8 mL,用水溶解并稀释至1000 mL。
1.3.9 硫酸溶液 取硫酸1.85 mL,用水溶解并稀释至100 mL。
1.3.10 钨酸钠溶液 取钨酸钠7 g,用水溶解并稀释至100 mL。
1.3.11 草酸溶液(1 mol/L) 取草酸12.6 g,用水溶解并稀释至100 mL。
1.3.12 草酸-乙腈溶液 取草酸溶液(1 mol/L)20 mL,用乙腈溶解并稀释至100 mL。
1.3.13 磷酸二氢钠溶液(8 mmol/L) 取磷酸二氢钠96 mg,用水溶解并稀释至100 mL,pH为5.0。
1.4 实验方法
1.4.1 提取 称取试料5 g(准确至±0.02 g),加Na2EDTA-Mcllvaine缓冲溶液20 mL,涡旋1 min,振荡10 min,加硫酸溶液5 mL、钨酸钠溶液5 mL, 涡旋1 min,-5 ℃下8500 r/min离心5 min,取上清液。残渣用Na2EDTA-Mcllvaine缓冲溶液20 mL、10 mL各提取1次,合并上清液,中性滤纸过滤,备用。
1.4.2 净化 HLB柱依次用甲醇、水和Na2EDTA-Mcllvaine缓冲溶液各5 mL活化。备用液过柱,待全部备用液流出后,依次用水、5%甲醇溶液各10 mL淋洗,抽干30 s,用甲醇6 mL洗脱,收集洗脱液于刻度试管中,加2 mL 8 mmol/L磷酸二氢钠溶液(pH 5.0),混匀,过甲醇5 mL、水5 mL活化的LCX柱,待全部液体流出后,用水、甲醇各5 mL淋洗,抽干1 min,草酸-乙腈溶液6 mL洗脱,收集洗脱液,于40 ℃水浴氮气吹至0.5~1.0 mL,用草酸溶液(0.01 mol/L)稀释至2.0 mL,微孔滤膜过滤,高效液相色谱测定(上机溶液应在24 h内完成测定)。
1.4.3 液相色谱条件 色谱柱:安捷伦ZORBAX-Extend-C18柱(250 mm× 4.6 mm,5 μm);柱温:30 ℃;检测波长:340 nm;流动相:A为0.01 mol/L三氟乙酸溶液,B为乙腈(梯度洗脱程序见表1);流速:1.0 mL/min;进样量:50 μL。
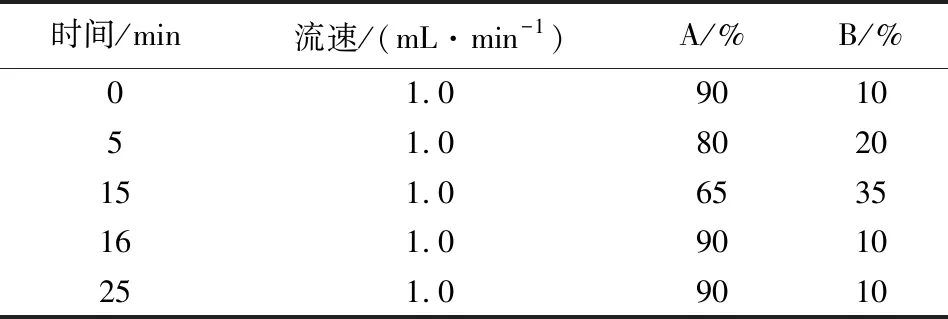
表1 流动相梯度洗脱程序
1.4.4 标准曲线绘制 精密量取混合标准中间液适量,用草酸溶液(0.01 mol/L)稀释成浓度为0.05、0.1、0.2、0.5、1、2、5 μg/mL的系列混合标准液,供高效液相色谱测定。以测得的峰面积为纵坐标,对应的标准溶液浓度为横坐标,绘制标准曲线,求回归方程和决定系数。
1.4.5 检测限及定量限 分别称取猪肉及猪肝空白样品各5 g,准确加入一定体积的混合标准中间液,按照1.4项对应实验条件进行样品前处理并上机测定,按3倍信噪比(S/N=3)和10倍信噪比(S/N=10)计算方法的检测限和定量限。
1.4.6 回收率及精密度 取空白猪肉及猪肝样品各54份,分为3批,每批18份,参照GB/T 27404-2008,以定量限和最高残留限量为标准,添加3个不同浓度,每个浓度点6个平行样品,按照1.4项对应实验条件进行样品前处理并上机测定,计算回收率及相对标准偏差,其中采用同批内相同添加浓度的6个平行样品回收率数据计算日内相对标准偏差,采用3批平均回收率数据计算日间相对标准偏差。
2 结果与分析
2.1 净化条件优化 选择6份空白猪肉,分A组和B组,每组3份样品,进行100 μg/kg的加标,按照1.4.1项和1.4.2项中HLB小柱净化过程操作,A组经HLB净化后的甲醇洗脱液直接过LCX小柱,B组经HLB净化后的甲醇洗脱液用磷酸二氢钠溶液调节pH后过LCX小柱,将两组经LCX小柱净化后的样品氮吹复溶后上机测定,比对四环素类药物的平均回收率。结果显示,B组平均回收率明显高于A组(如图1所示),因此最终净化条件选择B组对应条件,详细操作见1.4.2项。
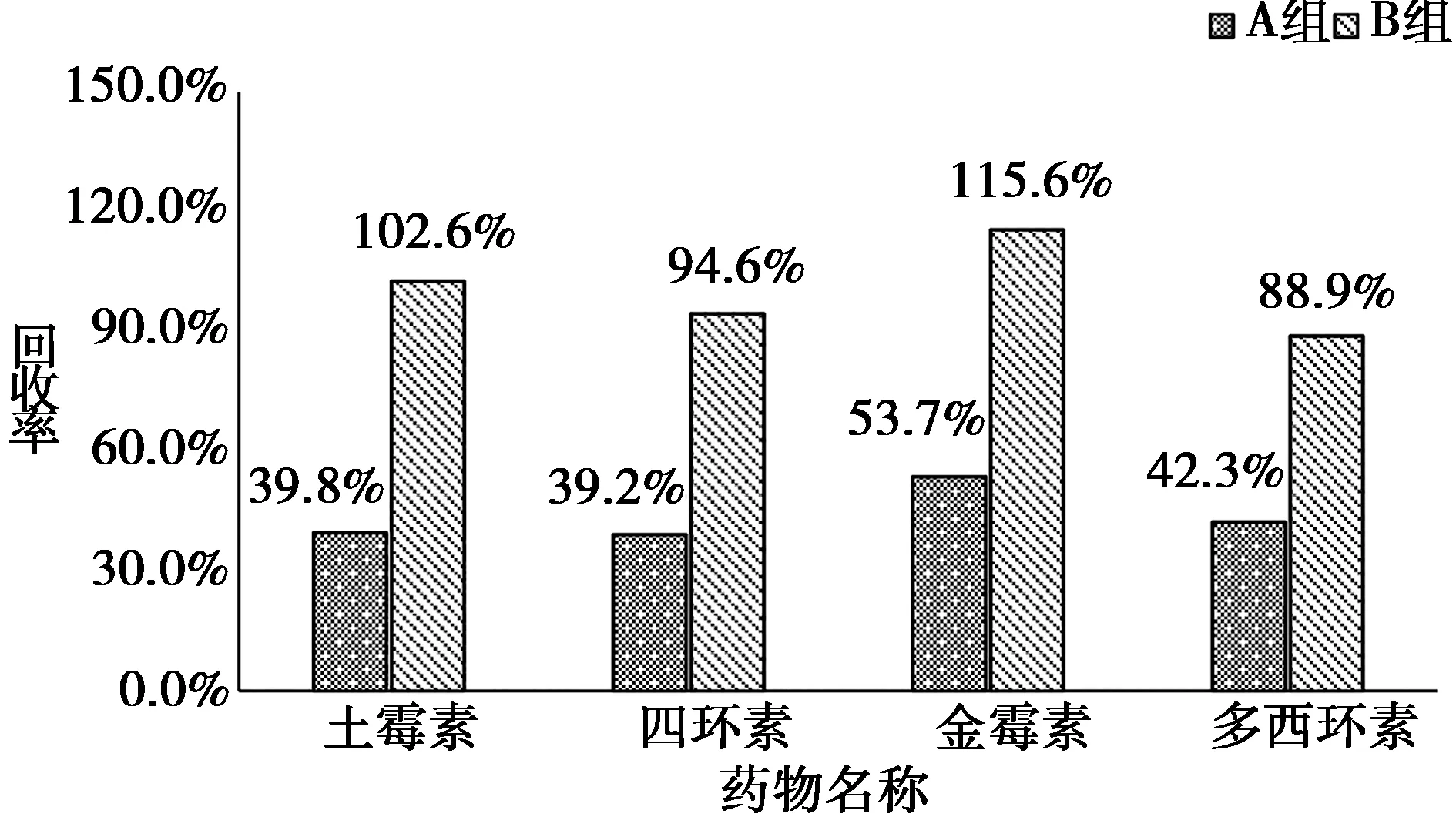
图1 不同净化pH下四环素类药物的回收率
2.2 检测波长优化 本研究测定了5 μg/mL四环素类混合标准溶液在300~400 nm下的响应值,发现在340 nm波长下,四种药物响应最高(如图2所示),因此,选择340 nm为最佳波长。
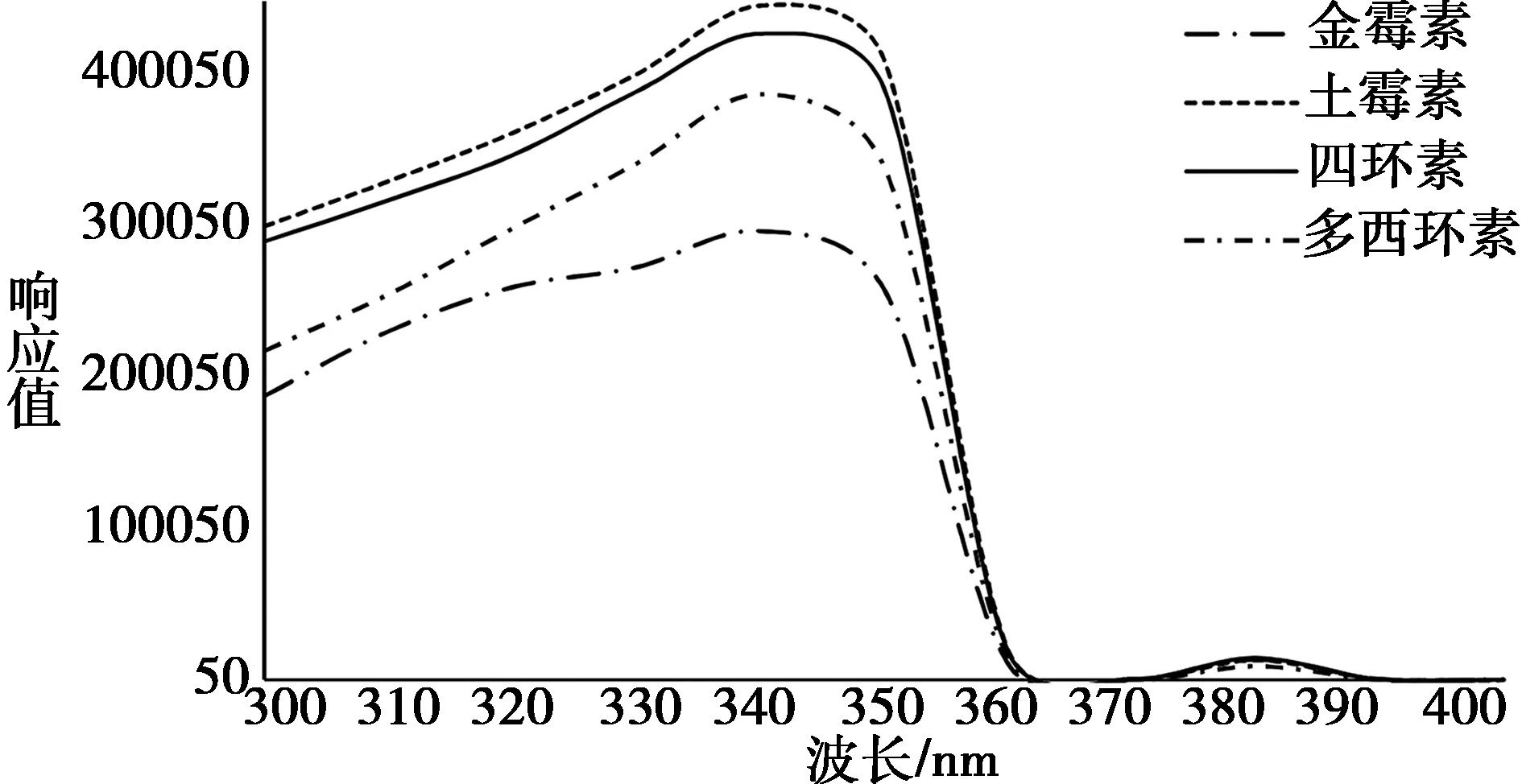
图2 四环素类标准溶液(5 μg/mL)在不同波长下的响应值
2.3 标准工作曲线 按照1.4.4项配制标准曲线并检测,结果显示四种药物在0.05~5 μg/mL浓度范围内线性关系良好,具体回归方程和决定系数见表2。

表2 回归方程及决定系数
2.4 检测限及定量限 按照1.4.5项中相关步骤,依据3倍信噪比(S/N=3)和10倍信噪比(S/N=10)计算猪肉及猪肝对应检出限及定量限,得出四种药物在猪肉中检测限为20 μg/kg,定量限为50 μg/kg;在猪肝中检测限为50 μg/kg,定量限为100 μg/kg。
2.5 回收率及精密度 按照1.4.6项中规定的样品数量及加标标准,空白猪肉样品加标浓度分别为50、100、200 μg/kg;空白猪肝样品加标浓度分别为100、200、600 μg/kg;以上样品按照1.4.1项及1.4.2项中前处理步骤处理后上机测定,计算回收率及RSD,其回收率水平及RSD值均符合《GB/T 27404-2008实验室质量控制》对应技术标准,具体结果见表3。
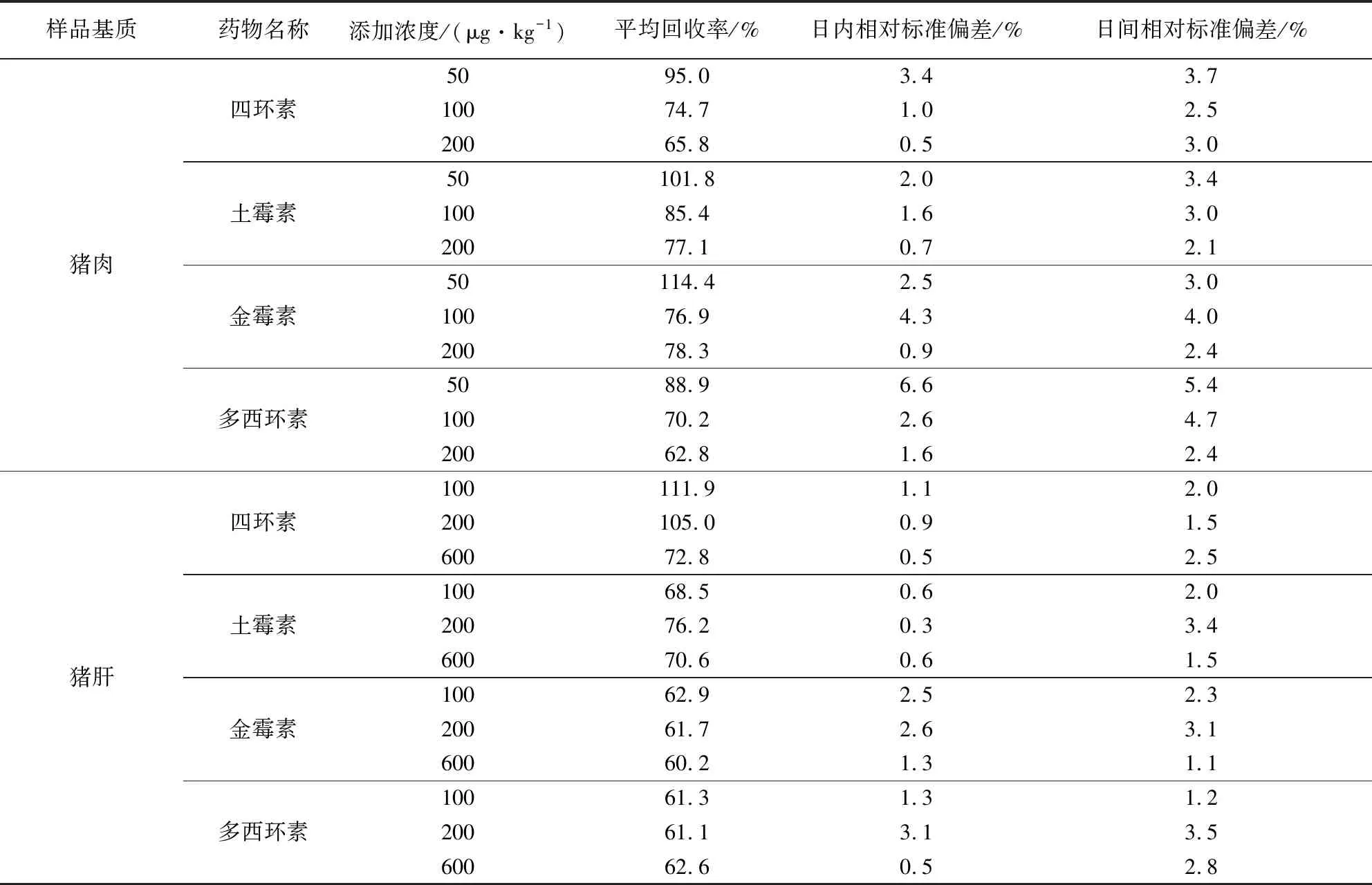
表3 猪肉和猪肝中四环素类药物的回收率及精密度
2.6 稳定性 将加标浓度为100 μg/kg的空白猪肉样品按照本实验条件进行处理,将处理后的样品溶液分别在0、12、24、48、72 h上机测定,对比四种药物的回收率。结果显示,四环素类药物随着时间的变化含量逐渐降低,在24 h内药物损失率均低于5%,24 ~48 h内,药物含量发生了明显降低,48 h时四种药物损失率均高于15%(表4),因此处理完的样品需在24 h内测定完毕,以确保检测结果的准确性。
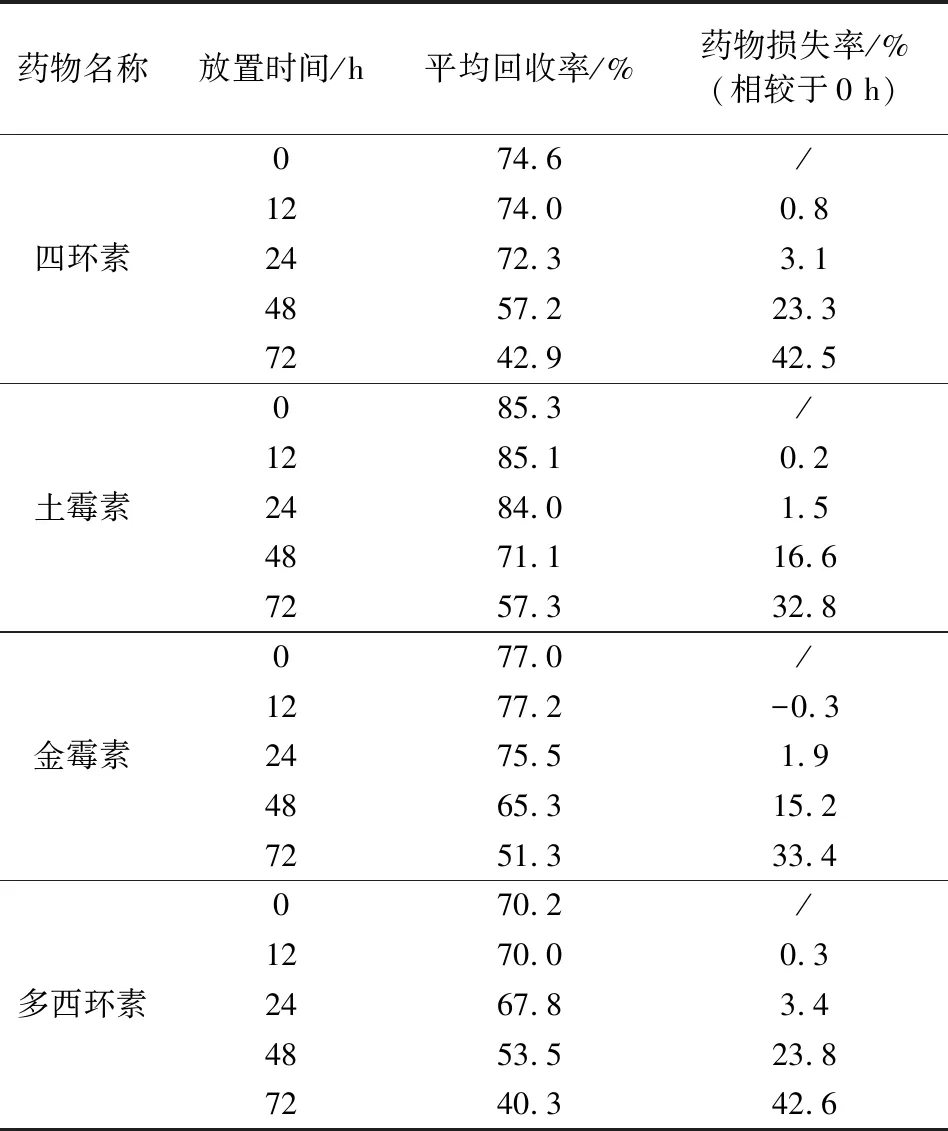
表4 稳定性测定结果
3 讨论与结论
3.1 检测方法的选择 兽药残留检测的方法目前主要有液相色谱-串联质谱法、高效液相色谱法、酶联免疫法、微生物法等[12]。微生物法操作简便、价格低廉、不需要精密仪器,缺点是不能区分具体的药物种类,难以进行定量检测。酶联免疫法成本较低,灵敏度相对较高,但在多残留检测方面存在一定的局限性,且检测精准度不够高,检测样品假阳性或假阴性概率较色谱法高。液相色谱-串联质谱法灵敏度高、分析速度快且能够精准定量[13],但仪器昂贵,影响因素较多,且受样品基质效应的影响,往往需要采用基质匹配标准曲线进行定量。高效液相色谱法具有检测成本较低、无明显基质效应、可准确定量等特点[14],适用范围较广。因此,本研究选择高效液相色谱法测定猪肉及猪肝中四环素类药物的残留量。
3.2 净化条件的优化 LCX固相萃取柱属于离子交换型固相萃取柱,样品溶液过柱前需调节pH至合适范围内,但《GB 31658.6-2021》中经HLB净化后的洗脱液过LCX小柱前未调节pH,即四环素类药物离子化不充分,目标物与LCX小柱的磷酸官能团结合效率低,导致目标物损失,回收率偏低[15]。本试验对比了HLB净化后的洗脱液上LCX小柱前调节pH及不调节pH两种条件,发现不调节pH直接过LCX小柱,四环素类药物的回收率均低于60%;经磷酸二氢钠溶液调节pH后再过LCX小柱,四环素类药物的回收率明显提高,均在80%以上。因此,本方法最终选择使用磷酸二氢钠溶液调节HLB净化后的洗脱液pH,以提高方法回收率,保证检测结果准确性。
3.3 色谱条件的优化 《GB 31658.6-2021》中四环素类药物检测波长为350 nm,有部分报道显示土霉素、四环素和金霉素的检测波长分别为355 nm和365 nm[16-17]。本试验考察了300 ~ 400 nm范围内四环素类药物的响应值,发现选择340 nm波长时,各药物响应最高。因此,选择340 nm为本方法最佳波长。
本研究建立了一种高效液相色谱法同时猪肉及猪肝中四种四环素类药物兽药残留检测方法。通过各项技术参数的考察验证,本方法无基质效应、重复性好、准确度高且精密度良好,满足猪肉及猪肝中四环素类药物残留量的检测,可为动物性食品中四环素类药物的残留监控提供检测依据。
——猪肝泥

