板青败毒口服液的HPLC特征图谱研究
张传津,牛华星,韩会刚*,战余铭 ,李有志,王尚明,张志民
(1.山东省饲料兽药质量检验中心,济南 250010;2.山东迅达康兽药有限公司,济南 250306)
板青败毒口服液现收载于《兽药质量标准》2017年版中药卷,具有清热解毒,疏风活血的功效,临床上主要用于鸡传染性法氏囊病等病毒性疾病的辅助治疗[1]。现标准通过四个薄层色谱法,分别采用绿原酸对照、甘草酸铵对照、精氨酸对照、芍药苷对照开展薄层鉴别,供试品前处理繁琐,同时展开剂采用乙酸丁酯、甲酸、正丁醇、冰醋酸、乙酸乙酯、三氯甲烷等多种有机溶剂,污染大,薄层展开耗时长,而且方中金银花、蒲公英、白英都含有或多或少的绿原酸;板蓝根、大青叶都含有精氨酸,因此本方法专属性差,重复性也不好,导致结果不易判定。中药多组分、多靶点的生物特性是其发挥临床疗效的物质基础,因此如何对中药复杂多样的化学成分体系进行质量评价也是重点难点。指纹图谱、特征图谱具有信息量大、特征性强、整体性和模糊性等特点,是公认的现代中药质量评价最为常用的分析方法之一,可宏观反映中药化学信息的整体状况,实现中药内在质量的有效表征,从整体上提高了中药质量控制水平[2-3]。基于此,本实验通过高效液相色谱法,以方中药物组分为依据,选取色谱中重要的特征信息,采用乙腈-0.4%磷酸溶液系统建立了板青败毒口服液特征图谱分析方法,为全面有效控制板青败毒口服液内在质量提供有力的技术支撑。
1 仪器与材料
1.1 仪器 AE240电子分析天平(梅特勒-托利多仪器有限公司);WatersE2695高效液相色谱仪,二极管阵列PDA检测器(美国沃特世公司);KQ-400DE数控超声波清洗器(昆山禾创超声仪器有限公司);Milli-Q型超纯水仪(AdvantageA10)。
1.2 材料 乙腈为色谱纯,磷酸为优级纯(含量大于85%),甲醇为分析纯,水为超纯水;对照品信息、样品信息分别见表1、表2。

表1 对照品信息表

表2 板青败毒口服液样品信息表
2 方法与结果
2.1 色谱条件与系统适用性试验 采用Waters XBridge C18色谱柱(粒径为3.5 μm,4.6 mm×250 mm);以乙腈流动相A相,以0.4%磷酸溶液为流动相B,按表3中的规定进行梯度洗脱;检测波长为240 nm,流速为1.2 mL/min,柱温为35 ℃,进样体积10 μL,理论板数按绿原酸峰计算应不低于10000。
2.2 参照物溶液的制备 分别取新绿原酸对照品、绿原酸对照品、隐绿原酸对照品、单咖啡酰酒石酸对照品、(R,S)-告依春对照品、甘草酸铵对照品、连翘苷对照品、咖啡酸对照品适量,精密称定,置棕色量瓶中,加70%甲醇制成每1 mL各含新绿原酸50 μg、绿原酸50 μg、单咖啡酰酒石酸50 μg、(R,S)―告依春2 μg、咖啡酸10 μg、隐绿原酸50 μg、甘草酸铵50 μg、连翘苷10 μg的混合溶液,即得。
2.3 供试品溶液的制备 精密量取本品2 mL,置50 mL棕色量瓶中,加入50%甲醇适量,超声处理20分钟(功率500 W,频率40k Hz),放冷,加50%甲醇至刻度,摇匀,滤过,取续滤液,即得。
2.4 检测波长的选择 以PDA检测器3D扫描190~450 nm波长范围,通过不同波长色谱图的对比发现,在240 nm处各种化合物均有良好的响应值,且各峰分离良好,最终选择240 nm作为检测波长。
2.5 方法学考察
2.5.1 精密度试验 取同一份样品,连续进样6次,每次进样10 μL,按2.1项下色谱条件测定,各色谱峰相对保留时间的RSD< 0.2%,各色谱峰峰面积的RSD<0.4%,结果表明仪器精密度良好。
2.5.2 稳定性试验 取同一份样品,按上述色谱条件测定,分别在 0、2、4、6、8、10、12 h进样10 μL,各色谱峰相对保留时间的RSD<0.12%,结果表明板青败毒口服液样品稳定。
2.5.3 重复性试验 对同一批供试品样品,重复配制6份供试品溶液,各取10 μl注入色谱仪,将色谱图数据导入国家药典委员会“中药色谱指纹图谱相似度评价系统(2012版)”,以对照色谱图为参照图谱,采用平均数、时间窗为0.6,计算6份样品相似度,结果显示其相似度均大于0.999,表明重复性良好,符合要求,结果见表4。

表4 重复性相似度计算结果
2.5.4 不同色谱柱耐用性 分别使用waters XBridge C18(3.5 μm,4.6 mm×250 mm)、赛默飞世尔科技(中国)有限公司Syncronis C18(5 μm,4.6 mm×250 mm)两根色谱柱,对6批供试品进行测定,结果相似度(S12)均大于0.995,符合特征图谱技术要求(应不低于0.95)。
2.6 板青败毒口服液特征图谱的建立及相似度评价
2.6.1 特征图谱的建立 按2.1项下色谱条件,测定混合参照物溶液及6批板青败毒口服液样品,将色谱图的数据导入“中药色谱指纹图谱相似度评价系统(2012版)”,以S1 为参照图谱,进行自动匹配,计算6批板青败毒口服液与对照图谱之间的相似度。共有8个特征峰,参照物色谱图及样品色谱图见图1,不同批次样品叠加特征图见图2。

(A.对照品 B.板青败毒口服液样品;1.新绿原酸,2.(R,S)告依春,3.单咖啡酰酒石酸,4.绿原酸,5.咖啡酸;6.隐绿原酸;7.连翘苷;8.甘草酸铵)

图2 板青败毒口服液不同批次叠加图谱
2.6.2 共有特征峰的确认 将参照物溶液中与板清败毒口服液中相应的8个共有峰,通过色谱图与光谱图比对均有很好的重合性。同时确认1号峰为新绿原酸,2号峰为(R,S)-告依春,3号峰为单咖啡酰酒石酸,4号峰为绿原酸,5号峰为咖啡酸;6号峰为隐绿原酸,7号峰为连翘苷,8号峰为甘草酸铵。板青败毒口服液处方中金银花、白英药材中均有较高含量的绿原酸,蒲公英药材也含有少量绿原酸,所以绿原酸在口服液中的含量相对较高,出峰时间也较适宜,因此,设定为参考峰S,并计算各特征峰与S峰的相对保留时间。结果显示,各特征峰的相对保留时间RSD<1.5%,表明具有较好的重现性。按照技术要求,初步得到板清败毒口服液的特征图谱的技术参数(表5)。

表5 板清败毒口服液HPLC特征图谱中特征峰保留时间
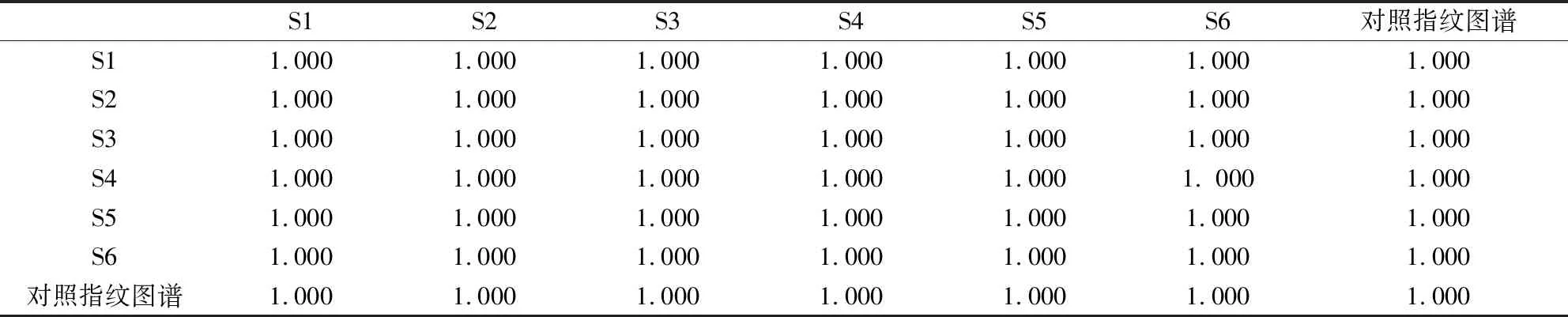
表6 特征图谱与对照图谱相似度计算结果

表7 样品特征图谱与对照图谱相似度匹配结果
2.6.3 相似度评价结果 将6批板清败毒口服液样品数据导入“中药色谱指纹图谱相似度评价系统(2012版)”,得出相似度评价结果表(表4、表5)。
3 讨论与结论
3.1 检测成份的确定 板青败毒口服液处方包含金银花、大青叶、板蓝根、蒲公英、白英、连翘、甘草、天花粉、白芷、防风、赤芍、浙贝母12味中药,我们对单味药材进行处理,分析检测,结合相关文献选择各种药材合适的质控指标组分。白英(Solanum lyratum Thunb)为茄科植物白英的全草,主要含皂苷类、甾体类化合物、有机酸、黄酮类等组分,其中绿原酸含量较高,也含有少量的咖啡酸[4-6],这两种组分都是《中国兽药典》常采纳的质控指标组分;金银花是大宗常用药材,随着现代药理研究的深入,金银花的质控指标性成分已达15种之多,分别是有机酸酸类(绿原酸、新绿原酸、隐绿原酸、咖啡酸、异绿原酸A、异绿原酸 B、菊苣酸、3,5-二-O-咖啡酰奎宁酸、4,5-二-O-咖啡酰奎宁酸等)、黄酮类(金丝桃苷、芦丁、木犀草苷、槲皮素等)、环烯醚萜类(马钱苷酸、马钱苷、7-表-马钱苷、獐芽菜苷、断氧化马钱苷等)[7-9],其中新绿原酸、绿原酸、隐绿原酸是金银花含量较高的酚酸类组分,也是《中国药典》采纳的主要质控指标组分[10];蒲公英为菊科多年生草本植物,具有清热解毒、消肿散结、利尿通淋的功效[11],现代药理研究表明,蒲公英主要含多酚酸类、萜类、植物甾醇类、倍半萜内酯类和香豆素类等多种化学成分[12],其中酚酸类化合物是蒲公英发挥药效的重要物质基础,目前从蒲公英中分离得到的酚酸类化合物有32种,其中单咖啡酰酒石酸、绿原酸、咖啡酸、阿魏酸和菊苣酸是含量较高的5个主要有效成分[13]。《中国药典》2020年版以菊苣酸的含量作为蒲公英质量评价指标[10],《中国兽药典》2020 年版以咖啡酸的含量作为蒲公英质量评价指标[14];板蓝根、大青叶所含有的氨基酸类、核苷类、黄酮类、嘌呤、靛蓝、靛玉红等成份是近年来质量控制的常用指标成份[15-18],其中(R,S) - 告依春、尿苷、鸟苷、腺苷是板蓝根特征图谱研究优选组分[14,19-20]。综上所述,本文前期摸索中,拟实现检测目标:其中板蓝根、大青叶:(R,S)-告依春、腺苷;金银花、蒲公英和白英:新绿原酸、单咖啡酰酒石酸、隐绿原酸、绿原酸、咖啡酸、异绿原酸B、菊苣酸、3,5-二-O-咖啡酰奎宁酸和4,5-二-O-咖啡酰奎宁酸,其中单咖啡酰酒石酸是本方中蒲公英特有的组分;甘草:甘草酸和甘草苷;连翘:连翘苷、连翘酯苷A;赤芍:芍药苷[14]。后期根据实际样品检测情况,基质背景干扰、分离度和各组分含量高低,删掉了部分目标化合物,成功建立了板青败毒口服液中8种有效成分(新绿原酸、(R,S)告依春、单咖啡酰酒石酸、绿原酸、咖啡酸、隐绿原酸、连翘苷、甘草酸铵)的特征图谱。
3.2 检测波长的选择 本文采用梯度洗脱的方式,PDA检测器,3D扫描范围190~450 nm,2D检测波长,选择250 nm(芍药苷最大吸收波长),240 nm(R,S)―告依春最大吸收波长),277 nm(连翘苷最大吸收波长),322 nm(咖啡酸最大吸收波长),327 nm(绿原酸等系列化合物最大吸收波长),251 nm(甘草酸最大吸收波长),329 nm(单咖啡酰酒石酸、菊苣酸最大吸收波长)328 nm(连翘酯苷A、最大吸收波长)等。由于(R,S)-告依春最大吸收波长240 nm,而在251 nm、324 nm、327 nm、330 nm等处吸收太小,因(R,S)-告依春在方中含量较低,所在优选它的最大吸收波长处,同时我们发现在240 nm处各种化合物均有良好的响应值,且各峰分离良好,最终选择240 nm作为检测波长。
3.3 色谱柱的选择 本文先后测试6根色谱柱,分别为英国ACE EXCEL3 C18-AMIDE(3.0 μm,4.6×150 mm),Agilent Eclipse plus C18(5 μm,4.6×250 mm)、Agilent ZORBAX SB-C18(5 μm,4.6×250 mm)、waters XBridge C18(3.5 μm,4.6×250 mm)、waters AtlantisT3(5 μm,4.6×250 mm)、赛默飞世尔科技(中国)Syncronis C18(5 μm,4.6×250 mm),结果只有XBridge C18、Syncronis C18两种色谱柱分离度符合要求,进一步进行耐用性实验,对6批供试品进行测定,结果相似度均大于0.995;而其余色谱柱未达到基线分离,分离度不符合要求。因此本实验需要指定色谱柱型号,分别为Syncronis C18(5 μm,4.6 mm×250 mm)、XBridge C18(3.5 μm,4.6 mm×250 mm)两种色谱柱。
板青败毒口服液由金银花、大青叶、板蓝根、蒲公英、白英、连翘、甘草、天花粉、白芷、防风、赤芍、浙贝母共12味药组成,经提取精制而成的口服溶液剂。本实验首次采用HPLC-PDA法,选取方中金银花、蒲公英、白英、甘草、连翘这些药材比较重要的8个特征指标成分,建立板青败毒口服液 HPLC 特征图谱,作为控制板青败毒口服液质量的鉴别手段,灵敏度高,重复性好,确保其内在质量的均一、稳定。综上所述,采用指纹图谱、特征图谱能够反映中药多成分特点,在中药质量控制中具有优势,也是世卫组织认同的中药质量评价方法,是中兽药标准提升的有效手段。本方法供试品前处理及流动相仅用到甲醇、乙腈两种有机溶媒,对环境友好,且前处理简单,大大缩短检测时间,提高了工作效率。可作为板青败毒口服液有效的鉴别和质量评价方法。

