微小RNA-106a-5p/集落刺激因子1轴对狼疮性肾炎患者免疫球蛋白G诱导的足细胞损伤的影响
秦艺璐, 边彩月, 左淑飞, 吴 洁, 梁 舒, 许振丹, 范文强
(河南省新乡市中心医院 风湿免疫科, 河南 新乡, 453000)
狼疮性肾炎(LN)是系统性红斑狼疮(SLE)的常见肾脏损害,多达60%的红斑狼疮患者会发展为LN, 而这是红斑狼疮患者的主要死亡原因[1-2]。发生肾炎会导致蛋白质漏出,如果不加以控制, LN最终会导致肾功能衰竭。目前, LN的主要治疗方法是使用糖皮质激素、免疫抑制剂和新兴的生物制剂[3]。足细胞是肾脏中高度分化的上皮细胞,其活性和结构完整性在维持肾小球选择性滤过中发挥关键作用,并在LN的发展中起重要作用[4-5]。微小核糖核酸(miRNAs)已被发现在多种病理和生理进程中发挥重要作用[6-7]。研究[8-9]证实miRNAs在细胞增殖、凋亡、分化、代谢等多种生物过程中具有调控功能。有研究[10]表明miRNAs在肾脏发育中起着重要作用,其失调可能导致LN肾脏细胞异常增殖、炎症和纤维化。
微小RNA-106a-5p(miR-106a-5p)是一个功能miRNA, 被发现在LN患者中表达降低,但其在LN发展中的作用尚未见报道。此外,通过Starbase预测软件发现miR-106a-5p在集落刺激因子1(CSF1)的基因上存在结合位点,而CSF1被证实在LN患者中呈高表达,并参与促进足细胞的损伤过程[11]。本研究采用LN患者血清中提取的免疫球蛋白G(LN-IgG)刺激足细胞诱导体外LN环境,探讨miR-106a-5p在足细胞损伤及LN中的作用,现将结果报告如下。
1 材料与方法
1.1 材料与试剂
本实验从本院共招募24例LN患者以及21名健康志愿者,纳入时间为2021年9月—2022年5月,并收集所有参与者血清标本用于miR-106a-5p和CSF1的表达检测以及LN-IgG和阴性对照(NC)-IgG(来自健康志愿者)提取和纯化。
人足细胞(HPC)购自ATCC(美国); 胎牛血清、RPMI-1640购自Gibco(美国); Lipofectamine 2000试剂盒、Trizol试剂购自Invitrogen(美国); miR-106a-5p mimic、miR-NC、CSF1及pcDNA由广州锐博合成; 反转录试剂盒、SYBR Green试剂盒由Takara(日本)提供; CCK-8试剂盒、细胞凋亡试剂盒由北京索莱宝提供; 双荧光素酶报告基因载体及检测试剂盒由Promega(美国)提供; ELISA试剂盒,抗LC3-Ⅰ/Ⅱ, p62, CSF1和GAPDH一抗抗体,以及HRP二抗购自Abcam(美国)。
1.2 方法
1.2.1 血清IgG的提取和测定: 通过蛋白质亲和色谱柱,洗涤、负载柱、平衡、负载样品、洗涤、洗脱和中和,分离和纯化患者及健康志愿者血清IgG, 分别命名为LN-IgG和NC-IgG,测定IgG的浓度后,放置于-80 ℃环境中保存。
1.2.2 细胞培养及分组: 足细胞培养在RPMI-1640培养基中,条件为37 ℃、5%CO2。培养基中包含胰岛素转铁蛋白硒(ITS)和10%胎牛血清。将细胞转移到不含ITS的RPMI-1640培养基中培养10 d, 诱导足细胞分化,随后将其暴露于LN-IgG或NC-IgG中培养,用于miR-106a-5p和CSF1的表达检测。
采用Lipofectamine2000脂质体转染法进行转染,分别将miR-NC、miR-106a-5p、miR-106a-5p+pcDNA或miR-106a-5p+CSF1按照实验设计转染至足细胞,随后将细胞暴露于LN-IgG中孵育,分别将细胞设为LN-IgG组、LN-IgG+miR-NC组、LN-IgG+miR-106a-5p组、LN-IgG+miR-106a-5p+pcDNA组或LN-IgG+miR-106a-5p+CSF1组。未经处理的细胞为对照组(Control)。
1.2.3 实时荧光定量聚合酶链式反应(qRT-PCR): 应用TRIzol试剂盒提取组织与足细胞中的总RNAs, 采用反转录试剂盒合成cDNAs, 随后以cDNAs为模板进行qRT-PCR扩增。反应条件为95 ℃下2 min, 95 ℃下30 s, 60 ℃下30 s, 72 ℃下30 s, 40个循环。采用2-△△Ct法,分别以U6和GAPDH为内参,计算分子含量。引物序列见表1。

表1 引物序列
1.2.4 CCK-8实验: 各组足细胞在96孔板中与10 μL CCK-8溶液室温孵育2 h(每孔1.5×103个),测量每孔450 nm处的吸光度值(A值)以评估细胞活力。
1.2.5 流式细胞术: 应用PBS洗涤收集的各组细胞,洗涤2次后,在含有细胞的EP管中加入400 μL含有10 μL Annexin V-FITC和5 μL PI的1×Annexin V结合缓冲液,黑暗条件下染色15 min, 在1 h内使用流式细胞仪分析细胞凋亡情况。
1.2.6 酶联免疫吸附试验(ELISA): 应用离心法收集各组足细胞的上清液,将上清液与抗体混合物在ELISA板中室温孵育1 h。洗涤后,将100 μL底物加入到每孔中,黑暗条件下孵育10 min。每孔加入100 μL终止反应液,检测各孔A值,计算细胞中白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的含量。
1.2.7 Western blot: 各组足细胞与500 μL RIPA缓冲液共孵育,采用10% SDS-PAGE凝胶分离蛋白,随后将分离的蛋白转移至PVDF膜。采用抗LC3-Ⅰ/Ⅱ (ab192890, 1∶2 000), p62 (ab109012, 1∶2 000), CSF1 (ab233387, 1∶1 000)和GAPDH(ab9485, 1∶5 000)与PVDF膜4 ℃孵育过夜, TBST洗涤后,加入二抗稀释液(1∶3 000)室温孵育2 h。应用ECL试剂盒检测蛋白条带,采用Image J软件分析条带灰度值。
1.2.8 双荧光素酶报告实验: Starbase预测结果显示miR-106a-5p和CSF1存在互补序列。将含有互补序列的CSF1片段扩增并插入pmirGLO载体构建野生型(WT)荧光素酶载体(WT-CSF1 3′UTR)。应用点突变技术突变含有结合位点序列片段,构建突变型(MUT)载体(MUT-CSF1 3′UTR)。随后将miR-106a-5p或miR-NC和WT-CSF1 3′UTR或MUT-CSF1 3′UTR共转染至足细胞, 48 h后检测荧光素酶活性。
1.3 统计学分析
2 结 果
2.1 miR-106a-5p在LN患者及LN-IgG诱导的足细胞中低表达
qRT-PCR结果显示,相较于健康志愿者, miR-106a-5p在LN患者中低表达,差异有统计学意义(P<0.000 1); 相较于NC-IgG组, LN-IgG诱导的足细胞中miR-106a-5p含量降低,差异有统计学意义(P<0.001)。见图1。
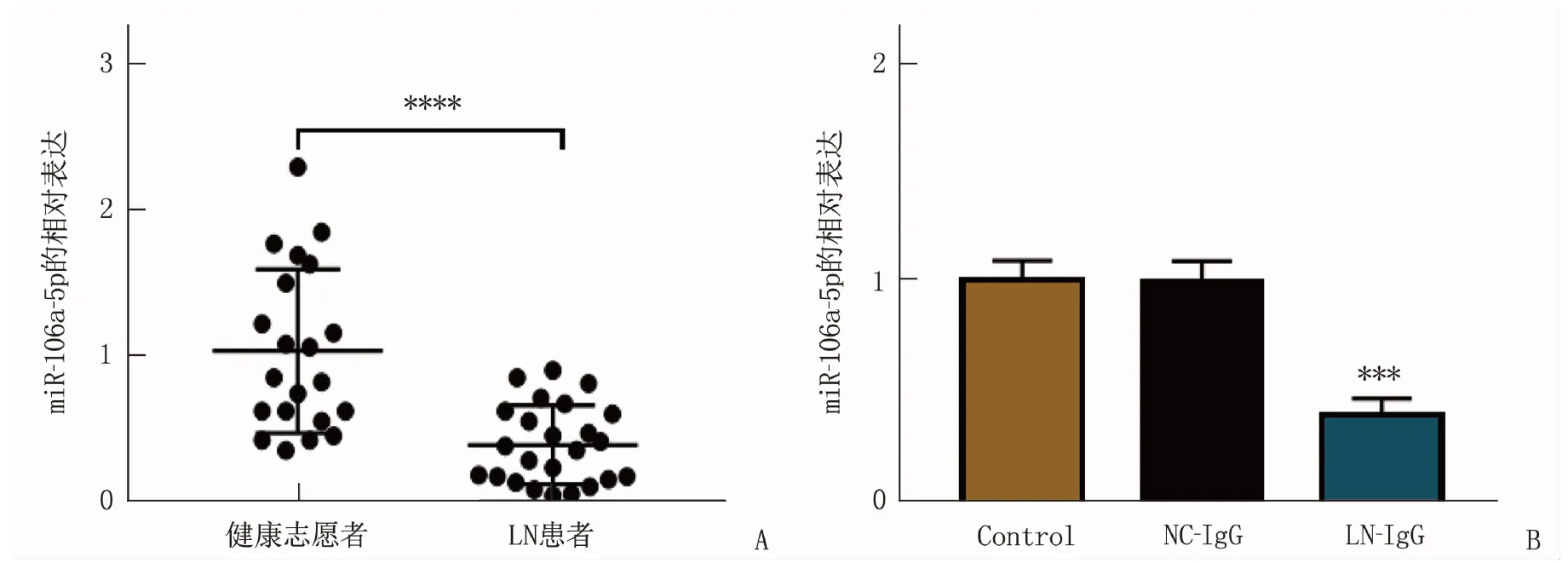
A: LN患者和健康志愿者miR-106a-5p相对表达(与LN患者比较, ∗∗∗∗P<0.000 1); B: Control、NC-IgG及LN-IgG组的足细胞中miR-106a-5p含量比较(与NC-IgG比较, ∗∗∗P<0.001)。
2.2 LN-IgG诱导的足细胞中miR-106a-5p过表达
相较于Control, LN-IgG刺激导致miR-106a-5p含量降低, LN-IgG刺激可降低细胞活力,促进细胞凋亡,抑制IL-6和TNF-α, 并导致自噬蛋白LC3-Ⅱ/Ⅰ升高以及P62蛋白含量下降,差异均有统计学意义(P<0.001或P<0.000 1)。相较于LN-IgG+miR-NC组, LN-IgG诱导的足细胞中miR-106a-5p转染后细胞中miR-106a-5p含量上升, miR-106a-5p过表达后LN-IgG诱导的足细胞的细胞活力增强,凋亡率降低, IL-6和TNF-α含量下降, LC3-Ⅱ/Ⅰ升高以及P62蛋白含量降低,差异均有统计学意义(P<0.01或P<0.001或P<0.000 1)。见图2。

A: qRT-PCR检测miR-106a-5p的含量; B: CCK-8检测细胞活力; C: 流式细胞术检测细胞凋亡; D、E: ELISA检测IL-6和TNF-α的含量; F: Western blot 分析LC3-Ⅱ、LC3-Ⅰ和P62的蛋白含量。与LN-IgG比较, ∗∗∗P<0.001, ∗∗∗∗P<0.000 1; 与LN-IgG+miR-106a-5p比较, ∗∗P<0.01, ∗∗∗P<0.001, ∗∗∗∗P<0.000 1。
2.3 CSF1是miR-106a-5p的靶基因
Starbase软件预测miR-106a-5p在CSF1上存在靶向结合位点; 双荧光素酶报告实验显示, miR-106a-5p mimic可显著降低WT组荧光素酶活性(P<0.000 1), 而对突变组则无影响,提示miR-106a-5p与CSF1存在直接相互作用; 相较于健康志愿者, CSF1在LN患者中高表达,差异有统计学意义(P<0.000 1), 且CSF1含量与miR-106a-5p含量呈显著负相关(P<0.001); Western blot分析显示,相较于NC-IgG组, LN-IgG诱导的足细胞中CSF1含量升高,差异有统计学意义(P<0.001)。见图3。

A: Starbase软件预测miR-106a-5p在CSF1上存在结合位点; B: 双荧光素酶报告实验(与miR-NC比较, ∗∗∗∗P<0.000 1); C: qRT-PCR检测LN患者和健康志愿者CSF1的含量(与健康志愿者比较, ∗∗∗∗P<0.000 1); D: CSF1含量与miR-106a-5p含量呈负相关; E: qRT-PCR检测Control、NC-IgG或LN-IgG处理的足细胞中CSF1的含量(与NC-IgG比较, ∗∗∗P<0.001)。
2.4 LN-IgG诱导的足细胞中CSF1过表达逆转miR-106a-5p的功能
相较于Control, LN-IgG诱导CSF1含量升高,相较于LN-IgG+miR-NC组, LN-IgG诱导的足细胞中miR-106a-5p转染后细胞中CSF1含量降低,相较于LN-IgG+miR-106a-5p+pcDNA组, LN-IgG+miR-106a-5p+CSF1组足细胞中CSF1含量升高,差异均有统计学意义(P<0.01或P<0.001或P<0.000 1)。相较于LN-IgG+miR-NC组, miR-106a-5p过表达后LN-IgG诱导的足细胞的细胞活力增强,凋亡率降低, IL-6和TNF-α含量下降, LC3-Ⅱ/Ⅰ升高以及P62蛋白含量降低,差异均有统计学意义(P<0.01或P<0.001或P<0.000 1)。相较于LN-IgG+miR-106a-5p+pcDNA组, LN-IgG+miR-106a-5p+CSF1组中足细胞的细胞活力降低,凋亡率升高, IL-6和TNF-α含量升高, LC3-Ⅱ/Ⅰ降低以及P62蛋白含量升高,差异均有统计学意义(P<0.05或P<0.01或P<0.001或P<0.000 1)。见图4。
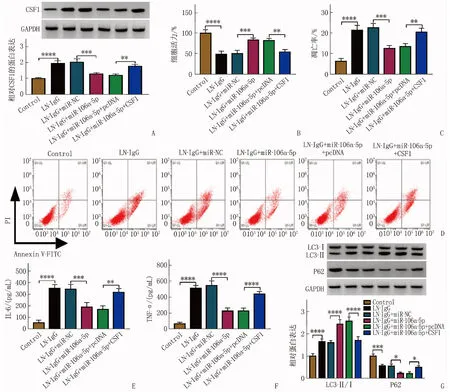
A: Western blot检测CSF1的含量; B: CCK-8检测细胞活力; C、D: 流式细胞术检测细胞凋亡; E、F: ELISA检测IL-6和TNF-α的含量; G: Western blot 分析LC3-Ⅱ、LC3-Ⅰ和P62的蛋白含量。与LN-IgG比较, ∗∗∗∗P<0.000 1; 与LN-IgG+miR-106a-5p比较, ∗∗∗P<0.001,∗∗∗∗P<0.000 1; 与LN-IgG+miR-106a-5p+pcDNA比较, ∗P<0.05, ∗∗P<0.01, ∗∗∗∗P<0.000 1。
3 讨 论
LN在SLE中非常普遍,约有44%的LN患者可发展为终末期肾病[12]。许多因素可促进LN的进展,包括激素失衡、基因突变、药物等[13]。目前,人们对LN的确切发病机制的了解仍不完善,因此其治疗进展的研究仍然有限。研究[14-15]证实足细胞损伤在LN的发病机制中发挥重要作用。免疫复合物(IC)的沉积及其引发的炎症是LN肾小球损伤机制的基础,足细胞是LN中IC沉积的直接或间接靶点,在不同程度LN中都可观察到足细胞组织学损伤[15]。目前,已有多个研究表明miRNAs参与调节LN, 例如过表达miR-183可以靶向抑制TGFBR1的表达,抑制LN小鼠肾纤维化和炎症反应[16], miR-199a通过靶向Klotho激活NF-κB通路,从而促进LN的炎症反应[17]。本研究中, miR-106a-5p被发现在LN患者及LN-IgG诱导的足细胞中含量降低; 功能实验表明, LN-IgG诱导的足细胞过表达miR-106a-5p后足细胞的活性增强、凋亡减少。促炎因子IL-6和TNF-α在免疫反应中发挥重要作用,可以促进巨噬细胞的活化和抗原呈递,并调节免疫[18]。本研究证实,过表达miR-106a-5p抑制LN-IgG诱导的足细胞中IL-6和TNF-α分泌,从而抑制炎症反应。研究[19]表明在LN小鼠模型中,在经过α干扰素(IFN-α)和LN患者血清治疗的小鼠足细胞中自噬是上调的, LN-IgG诱导的自噬可以保护足细胞免于凋亡。本研究证明LN-IgG诱导的足细胞中自噬增强,且过表达miR-106a-5p后,足细胞自噬能力进一步增强。总的来说, LN-IgG诱导的足细胞中miR-106a-5p过表达促进细胞活力,抑制凋亡、炎症以及增强自噬。
为了进一步探讨miR-106a-5p调节足细胞生物学行为的分子机制,本研究继续探索miR-106a-5p的下游靶标,随后证实CSF1是miR-216a-5p的功能靶标。CSF1是巨噬细胞的主要生长因子,敲除CSF1可抑制LN小鼠的狼疮[20]。LN小鼠体内CSF1高表达,循环CSF1刺激肾内巨噬细胞积聚,诱导肾小管上皮细胞凋亡,损害肾脏[21]。此外, LN患者血清或尿液CSF1水平升高,对其升高水平实时监测可以预测肾脏疾病活动和LN的发作和复发[22]。CSF1是LN的潜在治疗靶点。本研究发现CSF1在LN患者及LN-IgG诱导的足细胞中高表达,上调CSF1可以逆转miR-106a-5p介导的足细胞活力及自噬增强和凋亡及炎症抑制。
综上所述, LN-IgG诱导的足细胞中miR-106a-5p过表达可通过靶向抑制CSF1促进细胞活力,抑制凋亡、炎症以及增强自噬, miR-106a-5p可能是延迟或缓解LN的有效治疗靶标。

