RBP4、内脂素与GFR相关性分析:中介作用的探究*
田 莹 虞哈娜 杨华昭 全贞玉
延边大学医学院预防医学教研室(133000)
【提 要】 目的 探究视黄醇结合蛋白4(retinol binding protein 4,RBP4)、内脂素与肾小球滤过率(glomerular filtration rate,GFR)的相关性,分析影响过程中的可能中介变量并探讨其中介作用。方法 选择2011年延边地区某医院18岁以上健康体检人群共计969例。分析该人群RBP4、内脂素与GFR的相关性;采用多重线性回归分析GFR与各检测指标之间的关联,筛选可能的中介变量;构建方程模型进行路径分析,并使用自助法(Bootstrapping法)评估中介作用的显著性。结果 GFR异常组RBP4、内脂素水平均高于正常组,差异有统计学意义,且RBP4、内脂素与GFR相关。SBP、DBP、HDL、GGT为RBP4、内脂素与GFR影响过程可能的中介变量(P<0.05),路径分析及Bootsrapping法检验中介效应显示SBP、DBP、HDL、GGT在RBP4、内脂素对GFR的影响过程中均起到中介作用。结论 RBP4、内脂素与GFR有相关性,且SBP、DBP、HDL及GGT具有中介作用。
慢性肾病(chronic kidney disease,CKD)在2010年成为了继获得性免疫缺陷综合征、阿尔兹海默病、糖尿病之后,死亡率不断上升的第四大疾病[1]。CKD是由各种原因引起的肾脏结构和改变功能障碍,以内脂素与肾小球滤过率(glomerular filtration rate,GFR)下降为主要表现的疾病。由于CKD前期无特异性症状,易发生延迟诊断与延迟治疗,因此CKD患者出现症状时往往肾功能已经发生明显损伤。CKD通常与高血压、高血脂症等心血管疾病并存,即使是轻中度GFR下降患者,发生心血管事件与死亡风险也会增加,随着肾功能的进一步下降,心血管风险呈指数增长[2]。此外心血管疾病也是CKD发生的危险因素。
目前传统的危险因素(如高血压、高血脂、肥胖等)已不足以完全阐明肾功能不全与心血管疾病的关系,在此基础上应需考虑炎症、氧化应激与胰岛素抵抗(insulin resistance,IR)等非传统危险因素[3]。视黄醇结合蛋白4(retinol binding protein 4,RBP4)、内脂素作为脂肪因子,因与IR及炎症的诱导有关被广泛关注。过量脂肪因子被证明会增加心血管疾病的风险,也能够扰乱糖脂的正常代谢,进而导致GFR降低,最终发展为肾损伤[4-5]。研究表明,RBP4、内脂素与肾功能衰竭进展及终末期肾病相关[6],能够通过其血浆含量反映GFR水平,以此能够判定肾功能损害程度,实现早发现、早治疗。
故本研究在分析RBP4、内脂素与GFR的相关性的基础上同时分析了心血管疾病传统因素是否在RBP4、内脂素与GFR的影响路径中发挥作用。探究两种危险因素与GFR的联系及影响过程的中介变量,并通过路径分析明确中介作用大小,为日后慢性肾病的研究提供科学的理论参考。
对象与方法
1.研究对象
选择2011年延吉市某医院18岁以上成年人群体检资料,排除测定指标缺失对象,剩余有效样本共计969例,男性401例,女性568例。本研究通过延边大学医学院伦理委员会批准(医学伦理审查编号:2021113)。
2.资料收集
(1)一般资料
通过调查问卷收集研究对象社会人口学特征、自我报告疾病、服药记录等信息。体格检查包括身高、体重及血压的测定。测量身高、体重时需保证受检者进行检查前空腹且无剧烈运动,测定后计算BMI。血压测定使用安德自动电子血压计(RBP-9001脉搏波医用血压计),测量时需保证受检者检查前空腹且无剧烈运动,静坐10 min后开始测量。
(2)生化指标测定
取研究对象清晨空腹(8小时以上)静脉血3 ml,操作要求符合《全国临床检验操作规程(第四版)》[7]。使用德国罗氏(Roche)PPI全自动生化分析仪进行血脂、肾功能与肝功能传统心血管疾病指标的测定。血脂指标为:总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)与血糖(blood glucose,GLU);肾功能指标为:尿酸(uric acid,UA)、尿素氮(blood urea nitrogen,BUN)、肌酐(serum creatinine,Scr);肝功能指标为谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)与谷氨酰转肽酶(glutamyl transpeptidase,GGT)。血清RBP4、内脂素含量采用酶联免疫吸附试验法进行测定。
3.诊断标准
采用适合中国人群的CKD-EPI公式计算GFR[8],根据《KDIGO 2020慢性肾病糖尿病管理临床实践指南》[9]对GFR进行分组:GFR正常组:GFR>90ml/(min·1.73m2);GFR异常组:GFR≤90ml/(min·1.73m2)。GFR计算公式为:
144×(Scr/62)-0.329×(0.993)Age(女,Scr≤62μmol/L)
144×(Scr/62)-1.209×(0.993)Age(女,Scr>62μmol/L)
141×(Scr/80)-0.411×(0.993)Age(男,Scr≤80μmol/L)
144×(Scr/80)-1.209×(0.993)Age(男,Scr>80μmol/L)
路径分析模型评价指标为:
(1)卡方自由度比(CMIN/DF),CMIN/DF<5表示模型拟合度较好,CMIN/DF<3表示模型拟合度非常好;(2)拟合优度指数(GFI,GFI值越接近1,表明模型与数据拟合度越高;(3)调整后适配度指数(AGFI),AGFI值越接近1,表明模型与数据拟合度越高;(4)比较适配度指数(CFI),CFI值越接近1表明模型与数据拟合度越高;(5)近似误差均方根(RMSEA)<0.08表示模型拟合度尚可,<0.05表示模型适配度非常好。
4.统计学分析
应用SPSS 26.0对数据进行录入与统计分析。UA取平方根;TG、GLU、BUN、Scr、AST、ALT、GGT取对数后使其服从正态分布。单因素分析采用t检验、相关性分析采用Spearman 相关;多因素分析采用多重线性回归(Stepwise法)对 GFR的影响因素进行分析,α=0.05。使用Bootstrapping法进行中介效应检验[10];应用Amos 26.0 进行结构方程模型的构建并分析、验证各影响因素之间的路径关系[11]。P<0.05为差异有统计学意义。
结 果
1.GFR异常组与GFR正常组临床资料比较
GFR异常组RBP4和内脂素水平均高于GFR正常组,HDL、TC水平低于正常组,差异有统计学意义(RBP4:z=-2.114,P=0.034;内脂素:z=4.011,P<0.001),图1、图2。
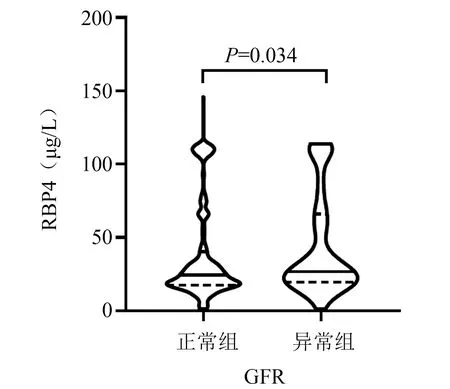
图1 GFR正常与异常组的RBP4水平比较

图2 GFR正常与异常组的内脂素水平比较
2.GFR、内脂素和RBP4与各指标的相关性
GFR与TC无相关性与其他指标均相关,RBP4与BUN无相关性与其他指标均相关,内脂素与各指标之间均存在相关性(P<0.05),见表1。

表1 GFR、内脂素和RBP4与各指标的相关性
3.GFR与测量指标的多重线性回归分析
由于相关指标存在共线性,故经组成分分析后选择RBP4、内脂素、SBP、DBP、TG、HDL、GGT为自变量,GFR为因变量进行多重线性回归分析。经分析线性关系成立(F=92.052,P<0.001),SBP、DBP、HDL、GGT均为GFR 的影响因素(P<0.05),可能为RBP4、内脂素对GFR影响路径中的中介变量,见表2。

表2 影响GFR的多重线性回归分析
4.路径分析结果
(1)RBP4与GFR路径分析结果
以SBP、DBP、HDL、GGT为中介变量,GFR为因变量,RBP4为自变量构建路径模型,模型拟合指数均达到标准:CMIN/DF=3.570;GFI=0.999;AGFI=0.974;CFI=0.998;RMSEA=0.052。路径分析结果显示,GFR通过四条路径影响GFR:①RBP4→SBP→GFR,标准化路径系数:0.15×(-0.32)=-0.048;②RBP4→SDP→GFR,标准化路径系数:0.13×0.10=0.013;③RBP4→HDL→GFR,标准化路径系数:-0.14×0.09=-0.0126;④RBP4→GGT→GFR,标准化路径系数:0.20×(-0.39)=-0.078,见图3。

图3 RBP4、GFR及各中介变量路径分析图
(2)内脂素与GFR路径分析结果
以SBP、DBP、HDL、GGT为中介变量,GFR为因变量,内脂素自变量构建路径模型,模型拟合指数均达到标准:CMIN/DF=3.789;GFI=0.999;AGFI=0.973;CFI=0.998;RMSEA=0.054。路径分析结果显示,GFR通过四条路径影响GFR:①RBP4→SBP→GFR,标准化路径系数:0.12×(-0.32)=-0.0384;②RBP4→SDP→GFR,标准化路径系数:0.14×0.10=0.014;③RBP4→SBP→GFR,标准化路径系数:-0.15×0.09=-0.0135;④RBP4→SBP→GFR,标准化路径系数:0.28×(-0.39)=-0.1092,见图4。
5.中介效应分析
(1)SBP、DBP、HDL及GGT对RBP4影响GFR的中介效应
中介检验结果SBP、DBP、HDL及GGT的95%CI不包含0,表明中介效应显著,间接效应大小分别为-0.0296(41.63%)、-0.0189(26.58%)、-0.0128(18.00%)、-0.0529(74.68%),见表3。

表3 RBP4、GFR不同中介变量总效应、直接效应及中介效应分解表
(2)SBP、DBP、HDL及GGT对内脂素影响GFR的中介作用
中介检验结果SBP、DBP、HDL及GGT的95%CI不包含0,表明中介效应显著,间接效应大小分别为-0.0113(28.75%)、-0.0093(23.66%)、-0.0078(19.85%)、-0.0349(88.80%)(见表4)。

表4 内脂素、GFR不同中介变量总效应、直接效应及中介效应分解表
讨 论
脂肪因子在CKD中的作用是一个新兴的研究领域,目前已经发现脂肪因子与GFR的改变有关。脂肪因子主要由脂肪组织分泌,参与葡萄糖与脂质的代谢调节,其水平异常能够引发肾功能损伤[12]。本研究发现GFR异常组RBP4、内脂素水平高于GFR正常组,RBP4、内脂素水平与GFR均呈负相关,与Hassan、Xun等[3,6]研究结果一致。
RBP4还能够阻碍胰岛素磷酸化的进程[13],通过激活巨噬细胞中的促炎因子引发脂肪组织炎症,最终导致IR[14]。内脂素主要在内脏脂肪组织中表达,研究发现循环内脂素水平与IR呈正相关[15]。统脂肪组织是IR发生的主要部位,在轻、中度CKD患者中很常见。IR能够联合氧化应激与炎症加速肾脏的损伤[16]。IR能够通过影响肾素-血管紧张素、血管内皮以及纤溶系活性,引起高血压、高血脂等心血管疾病促使GFR下降,还能够联合氧化应激与炎症加速肾功能下降[17-18]。因此,RBP4、内脂素可能通过IR引起GFR下降。
本研究探讨RBP4、内脂素与GFR影响过程的中介效应,最终发现4条关联路径具有中介作用,SBP、DBP、HDL与GGT分别为各路径的中介变量,这些指标与心血管疾病发生风险亦相关。目前,CKD被认为是导致死亡与心血管事件发生的重要危险因素之一,心血管疾病同样是尿毒症患者死亡的主要原因,肾功能损伤进程与心血管疾病之间存在关联。谢艳霞[19]等研究表明高血压患者GFR与SBP相互影响,DBP单向受GFR影响。何佳桐等[20]研究也表明,高血压是CKD患者的重要特征之一,脂肪因子与IR和高血压的发展密切相关。Korek E等[21]研究表明RBP4可能参与肝脏TG合成与肝脏IR的发生,但RBP4与TG之间的联系是直接的还是肝脏脂肪含量增加的结果还需要进一步研究。在肾损害患者中,内脂素与HDL呈负相关。内脂素水平的升高与GFR降低、TG水平升高以及内皮功能受损有关[22]。本研究结果显示GGT路径中介作用最为显著,可能与RBP4、内脂素由肝脏脂肪组织分泌并诱导脂肪组织炎症有关。Ryu S[23]等研究表明,CKD风险增加与GGT水平升高相关,与其他肝酶如谷丙转氨酶和谷草转氨酶无显著相关性,与本研究结果类似。该研究还表明GGT能够预测纤维蛋白原和C反应蛋白,是炎症标志物与氧化应激有关。除此以外,在肝硬化晚期患者中常见的并发症常进展为肾功能不全[24],但GGT与GFR的作用机制还需进一步研究。本研究仍有一定的局限性,如:横断面研究不能确定因果关系,需要前瞻性研究;不能完全排除残留混杂因素的作用。
结 论
综上所述,RBP4、内脂素与GFR相关,且传统心血管疾病危险因素测定指标中SBP、DBP、HDL与GGT为RBP4、内脂素与GFR影响路径中的中介变量,且GGT中介作用最大。传统心血管疾病危险因素与脂肪因子能够共同发挥作用影响肾功能,增加心血管疾病发生的风险,具体影响路径与机制还需要进一步讨论与研究。

