21基因复发风险评分在激素受体阳性乳腺癌患者中的应用
屈 洋,张燕娜,周易冬,孙 强
中国医学科学院北京协和医院乳腺外科,北京 100730
乳腺癌作为全球女性第一大癌症,发病率以每年3%的速度攀升[1],约70%以上的新确诊乳腺癌为激素受体阳性(hormone receptor positive,HR+)[2],此类乳腺癌总体预后较好,但仍有约15%~35%的患者在术后10~15年出现复发[3-5]。因此,在内分泌治疗的基础上是否需要增加化疗以降低复发风险在临床诊疗过程中一直存有争议。年龄、肿瘤大小、肿瘤级别虽可预测预后,但无法预测化疗获益[6],且此类预测信息均基于群体信息,无法针对个体患者进行准确预测。21基因检测是首个集预测和预后于一体的乳腺癌基因检测工具,其检测结果为21基因复发风险评分(recurrence score,RS),能够评估乳腺癌患者复发风险和化疗获益。RS已被美国临床肿瘤学会、美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)及中国抗癌协会推荐用于指导HR+、人类表皮生长因子受体2阴性(human epidermal growth factor receptor 2 nega-tive,HER2-)的早期乳腺癌患者辅助治疗,但其临床应用仍存有一定争议。本文就RS在HR+乳腺癌患者辅助治疗中的应用、对临床决策的影响、面临的争议与应用前景等展开综述,以期指导临床进一步扩展RS的应用范围,促进乳腺癌患者的辅助治疗更加精准化。
1 21基因检测概述
随机对照临床试验(NSABP B-14和NSABP B-20)证实,HR+、腋窝淋巴结阴性(node-negative,N0)的乳腺癌患者可从内分泌治疗和化疗中获益,成为HR+乳腺癌患者的标准治疗[4,7]。然而后续研究表明,不同患者的化疗获益存在差异[3,8]。2004年,Gianni等[9]基于已有数据挑选出250个候选基因,纳入NSABP B-14及B-20临床研究中的447例乳腺癌患者,采用RT-PCR技术检测基因表达,结果显示与乳腺癌远处复发(distant recurrence,DR)最相关的基因有21种(包括16种乳腺癌相关基因和5种内参基因),具体基因类型见图1。16种乳腺癌相关基因用于进行计算机自动加权和评分得出RS,5种内参基因用于评估标本是否符合要求、计量结果是否可靠。RS评分范围为0~100分,分数越高代表复发风险越大,同时从化疗中获益的可能性也越大。
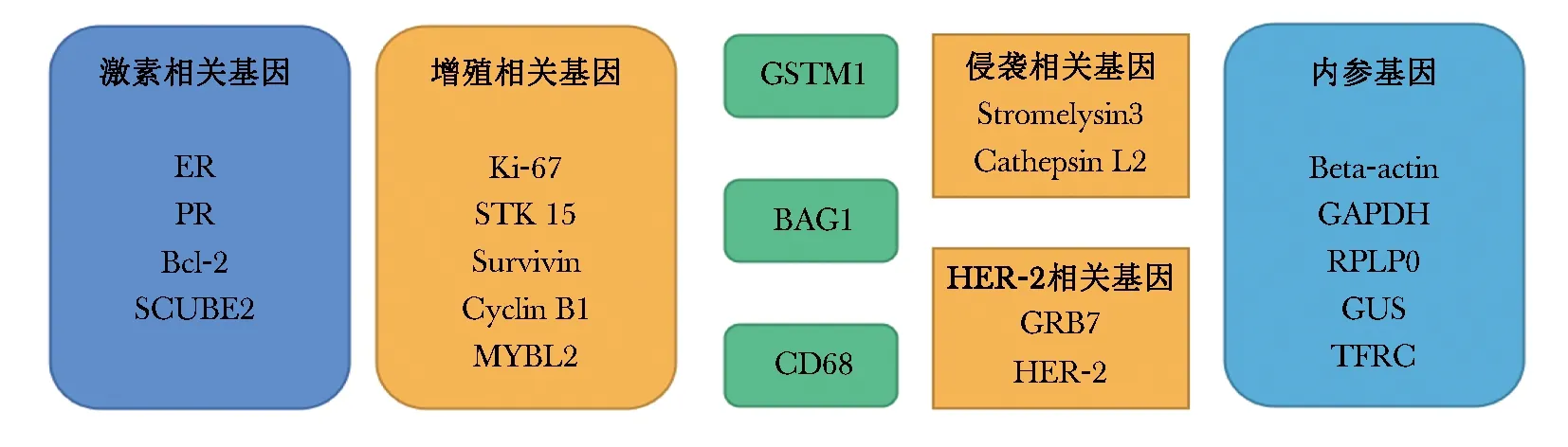
图1 21基因检测相关基因
2 RS在HR+乳腺癌患者辅助治疗中的应用
2.1 HR+、N0患者辅助治疗
Paik等[10]通过评估RS与接受他莫昔芬治疗的HR+、N0乳腺癌患者DR的相关性,发现RS在评估患者的总生存率和DR时可提供独立于临床病理因素之外的预测信息。该团队进一步运用COX风险模型测试RS与化疗之间的相关性,发现高风险组(RS≥31)化疗获益最大,低风险组(RS<18)化疗获益很小,而中风险组(RS为 18~31)化疗获益不确定。基于此,21基因检测被广泛用于评估HR+、N0乳腺癌患者预后并预测化疗获益。同时RS的分割标准被定义为:RS<18为低风险[接受化疗获益较小,10年远处转移率降低(1.1%±2.2%)];18~31为中风险(尚不确定可否从化疗中获益);RS≥31为高风险[接受化疗获益较大,10年远处转移率降低(27.6%±8.0%)]。Sparano等[11]研究显示,RS≤10、HR+/HER2-、N0的乳腺癌患者可免除化疗,该团队进一步对RS为11~25的患者进行研究发现,HR+/HER2-、N0的乳腺癌患者中除年龄≤50岁、RS为16~25的女性患者有化疗获益外,RS为0~25的患者均无化疗获益[6],因此NCCN指南于2019年将RS低、中、高临界值分别更新为RS<26、RS为26~30和RS≥31[12]。
2.2 HR+、腋窝阳性淋巴结1~3个(N1)乳腺癌患者的治疗
腋窝淋巴结转移与乳腺癌复发风险密切相关,而新诊断的HR+早期乳腺癌患者中约1/3有腋窝淋巴结转移[13],因此对于此类患者的复发风险和化疗获益预测也是目前关注的重点之一。
Albain等[14]对SWOG-8814试验肿瘤库中的367个样本进行回顾性分析,证明RS是绝经后HR+、N+乳腺癌患者无疾病生存期(disease-free survival,DFS)的预测因素,高RS评分者从化疗中获益更多(HR=0.59,95% CI:0.35~1.01,P=0.03),而低RS评分者无法从化疗中获益(HR=1.02,95% CI:0.54~1.93,P=0.97),从而将低复发风险患者从传统化疗中筛选出来,避免过度治疗[15]。TransATAC研究证实,在接受阿那曲唑和他莫昔芬治疗的患者中,低(RS<18)、中(RS 18~30)、高(RS≥31)RS评分组的9年DR率在N0患者中分别为4%、12%和25%,在N+患者中分别为17%、28%和49%,RS在接受2种药物治疗的患者中预后预测价值相似,均可作为DR的独立预测因子[16]。另有1项Ⅲ期前瞻性临床研究结果表明,对于RS≤11、N1的HR+/HER2-早期乳腺癌患者,即使通过临床病理因素被判定为高风险,豁免化疗后仍有良好的5年无病生存率(N0/N1:94.2%/94.4%),这为低RS、局限性淋巴结受累者免除化疗提供了依据[17]。
一项最新研究(RxPONDER)纳入5018例HR+/HER2-、N1、RS≤25的女性乳腺癌患者,随机分为单独内分泌治疗或化疗+内分泌治疗组,统计5年无侵袭性疾病生存期(invasive disease-free survival,IDFS)和远处无复发生存期(distant relapse-free survival,DRFS)。结果显示,在绝经前女性患者中,化疗+内分泌治疗较单独内分泌治疗的患者有更长的IDFS和DRFS,而具有相同疾病特点的绝经后女性患者则未观察到明显的化疗获益[18],因此对于绝经后女性患者可考虑豁免化疗,但对于绝经前女性患者从化疗中的获益是源于直接细胞毒性作用还是化疗诱导闭经(chemotherapy induced amenorrhea,CIA)引起的内分泌抑制这一问题目前尚不明确[19]。TAILORx试验结果表明,RS为16~25,年龄45~50岁的围绝经期患者较年龄≤40岁的患者化疗获益更明显,因此,在围绝经期患者中CIA的作用可能大于直接细胞毒性作用[20]。这为绝经前的早期乳腺癌患者使用卵巢功能抑制剂(ovarian function suppression,OFS)+内分泌治疗替代化疗提供了依据。
基于上述研究成果,最新版NCCN指南(2023年V4版)推荐,对于绝经后的HR+/HER2-乳腺癌患者,不考虑淋巴结状态,RS≥26的患者均应在内分泌治疗的基础上加用化疗。而对于绝经前的HR+/HER2-乳腺癌患者,部分RS为16~26的N0患者和RS<26的N1患者可从内分泌治疗和化疗中获益,但目前尚不明确是化疗的直接影响还是从CIA引起的内分泌抑制中获益。因此,可考虑化疗后进行内分泌治疗,或采用OFS联合三苯氧胺或芳香化酶抑制剂类药物进行治疗;而针对RS≥26的N0及N1绝经前患者,则建议在内分泌治疗的基础上加用化疗[21]。这对HR+/HER2-早期乳腺癌患者的辅助治疗指导更加精准(表1)。
3 RS对临床决策的影响
西班牙一项RS对乳腺癌患者治疗影响的研究显示,在纳入的107例患者(HR+/HER2-,N0)中,共有32%的患者在得到RS结果后改变了治疗建议,其中21%的患者从化疗+内分泌治疗改为内分泌治疗,11%的患者从内分泌治疗改为化疗+内分泌治疗[23]。美国一项回顾性研究显示,51%的医生在获得RS结果后改变了对于HR+/HER2-、N1乳腺癌患者的治疗建议,其中1/3的患者治疗强度由化疗+内分泌治疗降级为内分泌治疗[24]。一项纳入304例乳腺癌患者(RS组134例,对照组170例)的研究表明,肿瘤科医生在获得RS结果后,共对29%的患者改变了治疗建议(23%拒绝化疗,6%增加化疗),总体减少了化疗的使用,且超半数的医生表示RS提高了其对辅助治疗建议的信心[25]。尽管这些回顾性研究不可避免地存在选择性偏倚、回忆偏倚或样本量较小等局限性,但研究结果较为一致,均体现了RS在临床决策中发挥的重要作用,最常见的决策转变是由化疗改为内分泌治疗,不仅使临床医生对患者的病情有了更全面和精准的评估,也使化疗获益较少的患者避免不必要的药物毒性暴露,促使医疗资源分配更加合理。
4 RS面临的争议与应用前景
4.1 RS面临的争议
尽管目前21基因检测被国内外多个指南推荐用于指导HR+早期乳腺癌患者的辅助治疗[23-26],但高成本和长检测周期在一定程度上限制了其应用[27-28]。在全球范围内,将该检测纳入医保的国家十分有限;对于广大发展中国家,特别是基层医院,21基因检测的普及性和可负担性均受限制;包括中国在内的诸多国家均缺乏21基因检测原研产品—Oncotype DX,多数实验室或病理科采用自制检测工具,导致不同医疗单位间的检测结果存在差异,且针对中国人群开展的相关研究较少,仍缺乏共识;此外,手术和辅助化疗之间的时间间隔对于提高生存率至关重要,开始辅助化疗的时间延后会对患者的长远预后产生负面影响[29]。因此,21基因检测的周期较长可能导致治疗决策的延迟,从而影响患者预后。
目前,研究者对传统临床病理学特征进行了多变量整合,以建立更方便的临床模型替代昂贵的21基因检测[30-33],其中多为数学模型,需在线获取[34-35]。2020年,基于TAILORx试验[20]的研究成果,国内研究者通过整合临床风险、孕激素受体(progesterone receptor,PR)表达、Ki-67指数3个变量开发出一种更为便捷的IHC3预测模型,可将患者划分为高复发风险和低复发风险[36],其中关于临床风险的定义与TAILORx试验一致,最终结果表明,IHC3模型预测IDFS准确度优于RS和TAILORx,可考虑作为乳腺癌治疗和预后预测的替代方法。
韩国研究者利用191例患者的临床病理参数(核分级、PR表达和Ki-67指数)构建诺莫图预测HR+/N0早期乳腺癌患者中的高RS得分(RS>25)者,并使用264个独立病例进行了内部验证,显示预测概率与实际概率具有良好的一致性,提示该模型具有显著的风险区分能力[37]。Orucevic等[38]使用美国肿瘤数据库中的约27 000例HR+、N0早期乳腺癌患者数据构建诺莫图预测高RS得分者,结果显示有6个变量(年龄、肿瘤大小、组织学分级、组织学类型、淋巴血管侵犯、PR表达)与高RS显著相关。而基于亚洲人群建立的模型中肿瘤大小并未被判定为预测RS的临床指标[33,39],淋巴血管侵犯与RS的相关性在不同研究中的结果不同[33,40]。
不同模型纳入的预测指标差异可能是由东西方患者不同的肿瘤基线特征导致的,东西方患者存在肿瘤遗传学和生物学差异,亚洲乳腺癌女性的发病年龄较西方女性更早,绝经前女性所占比例更高[40],因此基于西方人群建立的模型可能无法直接应用于亚洲女性。此外,现有模型大多针对高RS和低RS得分者建立,未来仍需开发针对中等RS得分者的预测模型。同时,Ki-67作为细胞增殖指标,在RS中所占权重较大,其在一些模型中也被纳为预测指标[31-33],但由于观察者和实验室之间可能存在的测量差异[41],对于Ki-67的分割标准目前仍缺乏共识。
4.2 RS的应用前景
对于RS和临床病理因素判定结论不一致的患者,选择何种依据指导治疗决策尚无明确建议,因此,RS与其他临床病理特征相结合的预测模型或许能更加准确地进行预测。TAILORx临床试验根据肿瘤大小和组织学分级将乳腺癌复发的临床风险分为低和高,并将临床风险分层与RS相结合,最终证明可更准确地预测患者的远处转移和预后[20];相同RS得分的患者临床风险不同,预后结果也不同:当RS为21~25时,无论临床风险如何,患者化疗获益相似;而当RS为16~20时,高风险与低风险患者的化疗获益差异显著[(6.5±4.9)%比(0.2±2.1)%,P<0.01],提示将临床风险和RS结合可更准确地预测复发风险,但无法预测化疗获益。
Tang等[42]通过整合RS和临床风险因素(如年龄、肿瘤大小、肿瘤级别、化疗方案等)建立了更为可靠的RSPC早期乳腺癌预后预测模型,对于HR+/HER2-的早期乳腺癌患者DR的预测价值显著高于RS(P<0.01);对于中等RS得分者,经RSPC评估后部分被划分为低风险,显示出更好的风险分离。值得注意的是,RSPC同样不能预测化疗获益。
Sparano等[43]将临床风险和患者年龄、肿瘤大小相结合开发出RS Clin模型,即“RS临床加强版”,使用TAILORx试验中的基线风险和事件发生率预测患者DR,使用TAILORx和NSABP-B20试验中的个体化化疗效果预估化疗受益,经外部验证表明,与单用RS或单用临床病理因素相比,RS Clin推算出的DR风险准确率显著较高(P<0.001)[15],可更加个体化指导HR+/HER2-、N0乳腺癌患者的辅助化疗。
随着预测工具的不断研发,未来可更加准确地识别出从辅助治疗中获益的患者,使治疗方案实现个体化。目前的工具主要应用于HR+/HER2-、N0乳腺癌患者,部分工具在化疗获益预测方面表现欠佳,相信随着研究的不断深入,预测功能更加全面、可用于多种类型乳腺癌的预测工具不久后将会相继问世。
5 小结与展望
目前,RS的适应证已从最初的HR+/HER2-、N0患者扩大到HR+/HER2-、N1患者,尤其对于绝经前女性患者的检测价值更大,但仍需探讨辅助化疗的获益是由于细胞毒性效应消除了潜在转移病灶还是CIA导致的内分泌间接效应;此外,越来越多的研究者聚焦于RS指导新辅助治疗的可能性[44-46],有望将RS的应用范围进一步扩展;而RS的分割标准随着研究的不断深入也在动态改变。同时,受限于高昂的价格、较长的检测周期和原产品供应不足,21基因检测在广大发展中国家和基层医院的可及性仍较低,因此通过整合临床病理信息建立可替代RS的预测模型有望准确识别出高风险患者,但纳入的参考指标在基于不同人群建立的模型中仍存在较大差异。而21基因检测能够弥补临床病理特征的不足,为患者提供预后信息。因此,RS与临床病理特征相结合的检测工具可促进乳腺癌患者个体化治疗的发展。
除21基因检测外,70基因(MammaPrint)、28基因(RecurIndex)、12基因(EndoPredict)、7基因乳腺癌复发指数(breast cancer index,BCI)等多基因检测工具的临床应用价值也被多项指南推荐,用于指导HR+/HER2-,N0~N1早期乳腺癌患者的术后辅助化疗。但最新版NCCN指南(2023年V4版)中,仅21基因和70基因检测作为1级证据推荐[21],其中70基因检测是首个被美国食品药品监督管理局批准用于临床的多基因检测方法[47],MINDACT研究对其预后价值的验证结果显示,46.2%的临床高危患者豁免化疗[48],但这一检测方法仅适用于复发风险较高的患者,不建议在低风险患者中应用[49]。其余检测工具由于缺乏充分的前瞻性数据支持,推荐级别均为2A。
综上,RS作为乳腺癌预后预测和治疗决策的重要辅助检测工具,仍需进一步开展基于中国人群的大型临床试验,建立符合中国国情的临床规范,加强多学科交叉融合,进一步实现RS的临床优化,使乳腺癌患者的辅助治疗更加精准。