维生素D与代谢相关脂肪性肝病的关系及机制
陈丹妮,王世令,路 红,郑 亚,王玉平,任 茜,4
1兰州大学第一临床医学院,兰州 730000 兰州大学第一医院 2消化科 3消化内镜中心 4甘肃省消化系疾病临床医学研究中心,兰州 730000
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是世界范围内最常见的一种慢性肝病。由于缺乏确诊该疾病的“肯定性”诊断标准,且NAFLD的发病机制与代谢功能障碍相关。因此,2020年该疾病被重新命名为代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)[1]。来自欧洲4国(英国、法国、德国和意大利)的数据显示,2016年约5200万例MAFLD患者,直接归因于MAFLD的医疗费用每年约350亿欧元[2]。2011年至2018年,美国的MAFLD患病率从34.4%增至38.1%,逐渐成为严重的疾病负担[3]。因此,早期诊断和治疗MAFLD至关重要,然而目前尚无获批治疗该疾病的相关药物。
维生素D是一种多效激素,不仅在骨代谢、钙磷酸盐平衡中发挥重要调节作用,且被认为参与介导免疫炎症和许多代谢过程[4-5]。目前,多数研究显示,维生素D缺乏与MAFLD的发生发展密切相关。因此,本文将阐述维生素D与MAFLD的病理生理学最新研究进展,并揭示维生素D在MAFLD发病中的潜在机制,为MAFLD的临床治疗提供新思路。
1 维生素D与MAFLD的关系
维生素D是一种对人体具有多种功效的微量营养素,其主要来源为阳光合成。由于人们生活方式的改变,如长时间呆在室内及户外防护的增加,导致光照不足,从而引起内源性维生素D缺乏。越来越多的研究表明,维生素D缺乏是一个全球性健康问题。一项荟萃研究对746 564名参与者的472项研究数据进行分析,发现亚洲人群维生素D缺乏的患病率较高,其中20.93%的参与者维生素D水平低于25 nmol/L[6]。研究发现,维生素D缺乏可能与各种代谢性疾病的发生风险增加有关,包括动脉粥样硬化[7]、2型糖尿病[8]、代谢综合征[9]和MAFLD[10]等,但目前对于维生素D与MAFLD的关系尚存争议。
目前已有大量循证医学证据支持维生素D与MAFLD之间存在相关性。一项双向孟德尔随机化研究证实,血清维生素D水平与MAFLD的发病风险呈负相关[11]。同时,两项前瞻性队列研究得出了一致结论,即血清维生素D水平升高与MAFLD患者的全因死亡率之间呈非线性负相关[12-13]。此外,血清维生素D水平越低,MAFLD患者的代谢紊乱程度越严重,肝脏脂肪含量越高[14]。国内一项研究根据维生素D水平对非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)患者进行分组,结果显示维生素D水平越低,患者的肝功能、血脂水平及纤维化-4(fibrosis-4,FIB-4)指数越高,肝细胞脂质累积越多,提示维生素D水平与NASH患者的肝纤维化及病情严重程度密切相关[15]。
然而,也有一些研究证实维生素D与MAFLD之间无相关性。韩国的一项研究发现,维生素D水平在409例MAFLD患者和803名非MAFLD参与者之间无明显差异[16]。Patel等[17]对两组接受肝活检的成人队列[对照组(n=39)与MAFLD组(n=244)]进行研究,发现两组间的维生素D水平无统计学差异。在对混杂因素进行调整后,维生素D水平与MAFLD患者的肝脏脂肪变性、小叶或门静脉炎症、肝细胞气球样变性、NAFLD活动性评分(NAFLD activity score,NAS)和肝脏纤维化严重程度之间亦未发现存在相关性。最近多项随机对照试验研究均表明,补充维生素D对全因死亡率和心血管疾病死亡率无影响[18-19]。同时,我国学者进行的一项双向孟德尔随机化分析研究亦发现,维生素D水平与MAFLD之间无因果关系[20]。
综上所述,维生素D与MAFLD之间研究结果的矛盾性可能与以下因素有关。(1)维生素D的生成与紫外线照射时长及强度密切相关,不同研究中研究对象存在的地域差异可能影响研究结果;(2)经济发展水平也会对维生素D水平产生影响;(3)维生素D与MAFLD之间的相关性也可能受不同种族的影响[21];(4)肝脏作为维生素D合成的重要器官,在MAFLD发生和发展过程中或因肝功能受损而导致维生素D水平下降,从而在MAFLD患者中观察到较低的维生素D水平。因此,建议未来应排除更多影响因素,开展多地区并行、大样本、前瞻性研究,还可通过肝活检证实的MAFLD以揭示维生素D与MAFLD之间的因果关系。
2 维生素D补充与MAFLD
目前,已有大量维生素D治疗MAFLD的相关临床试验,但研究结论不一致。Lukenda Zanko等[22]利用瞬时弹性成像技术对MAFLD患者随访1年后发现,补充低中剂量维生素D(1000 IU/d)可改善MAFLD患者的肝脏脂肪变性程度。有学者对109例经肝活检证实为MAFLD的患儿进行维生素D治疗(2000 IU/d),发现6个月后患儿的肝酶水平、肝脏脂肪含量、葡萄糖代谢和胰岛素抵抗等代谢指标显著改善[23]。另一项单中心临床试验旨在评估肌注维生素D改善MAFLD患者肝脏相关指标的疗效,结果发现每月单次肌注200 000 IU维生素D(连续6个月)可有效改善MAFLD患者的肝功能、受控衰减参数及肝脏硬度值[24]。最近一项荟萃分析显示,补充维生素D可明显改善高密度脂蛋白(high density lipoprotein,HDL)、丙氨酸转氨酶(alanine aminotransferase,ALT)、空腹血糖、胰岛素抵抗指数(homeostasis model assessment of insulin resistance,HOMA-IR)、体质量指数、腰围等人体测量指标和生化指标,并提议将其作为MAFLD患者的替代治疗策略[25]。然而,也有研究显示补充维生素D无法改善MAFLD患者的代谢指标。Rasouli等[26]对超重/肥胖的2型糖尿病高危成年人随机分组,接受维生素D(4000 IU/d)和匹配的安慰剂治疗2年后发现,两组人群在β细胞功能或HOMA-IR方面无统计学差异。另一项包含8个随机对照研究的荟萃分析表明,补充维生素D并不能改善MAFLD患者的胰岛素抵抗、肝酶、糖代谢参数和血脂水平[27]。
虽然有研究提出补充维生素D可减轻肝损伤,改善肝功能,但具体使用剂量和时长还需进一步研究证实。关于研究结果的矛盾性,有学者认为,不同个体维生素D转化为活性产物,以及维生素D与其受体(vitamin D receptor,VDR)结合的能力不同,且个体对维生素D的敏感性及反应性亦存在不同,这些均可对研究结果产生影响[28]。因此,在今后的临床试验设计中,需针对维生素D的具体补充剂量及疗程开展大样本、随访周期长的随机对照研究,以进一步证实二者的相关性。
3 维生素D及其受体在MAFLD发生发展中的作用机制
研究发现,维生素D及VDR是肝脏疾病发生发展和严重程度的关键调节因素[29-30]。VDR除在骨骼、肾脏、肝脏和肠道中表达外,在心血管、内分泌及神经系统中也有表达[31]。VDR在肝细胞中的表达水平很低,但在肝脏巨噬细胞等非实质细胞中高表达。研究表明,肝脏VDR的激活可改善饮食诱导的肥胖小鼠模型肝脏炎症、脂肪变性和胰岛素抵抗[32]。而VDR敲除的小鼠显著加重了高脂饮食诱导的代谢异常[33]。因此,维生素D对MAFLD的保护作用可通过VDR的作用进行解释。
MAFLD的病因至今仍不清楚,目前以“多重打击”理论取代“双重打击”理论,可更精确地解释MAFLD的发生机制。这些打击包括胰岛素抵抗、脂质紊乱、氧化应激、肠道微生物群等[34]。研究表明,维生素D参与了诸多代谢过程,如改善脂肪组织炎症[35]、增加胰岛素敏感性[36]和维持肠道稳态[37]等。因此,维生素D缺乏也可能是MAFLD发病的危险因素之一。维生素D可能通过影响肝脏脂质代谢、胰岛素抵抗及炎症反应、参与免疫调节、基因调控和维持肠道稳态等途径参与MAFLD的发展。图1展示了维生素D缺乏症(vitamin D deficiency,VDD)与MAFLD发生发展之间的潜在途径。
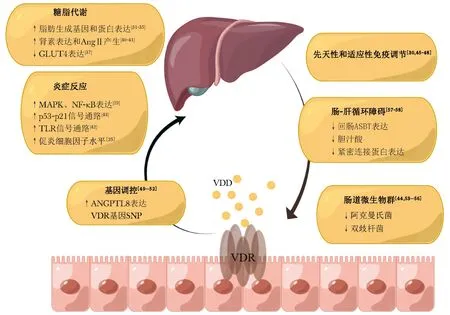
图1 VDD与MAFLD发展之间的潜在途径
3.1 维生素D与脂质代谢
MAFLD的特点是甘油三酯和其他脂类在肝细胞中病理性累积,其与全身代谢紊乱密切相关,其中包括血脂异常。最新研究发现,维生素D可影响血脂水平,从而在脂质代谢中发挥重要作用[38]。一项动物实验采用高脂饮食(high-fat diet,HFD)建立脂肪肝小鼠模型,并连续4周注射维生素D对其进行治疗,发现维生素D通过诱导自噬作用改善MAFLD小鼠的肝脏脂肪变性和炎症反应,但这种作用在小鼠VDR基因敲除后随之消失[39]。研究者给糖尿病小鼠模型连续补充12周维生素D后,其与凋亡和纤维化相关的胰岛素抵抗和肝损伤得到显著改善,并通过激活小鼠的AMPK/Akt-mTOR信号诱导自噬,减少肝脏中的脂肪沉积[40]。此外,维生素D缺乏+高脂饮食(VDD+HFD)喂养的小鼠表现为高胰岛素血症、高甘油三酯血症和脂肪变性,且小鼠脂肪生成基因和蛋白表达增强,如PPARγ、SREBP1c、FAS等;而β氧化蛋白(如PPARα)表达则减少,提示维生素D缺乏加剧了HFD诱导的肝脏脂肪变性和胰岛素抵抗[41]。维生素D还可通过增加ATP结合盒转运蛋白A1(recombinant ATP binding cassette transporter A1,ABCA1)和肉毒碱棕榈酰基转移酶1A(recombinant carnitine palmitoyltransferase 1A,CPT-1A)的表达,同时降低单核源性巨噬细胞中CD36和C/EBPβ蛋白的水平而抑制脂质累积[42]。因此,维生素D可能通过影响脂质代谢进而促进MAFLD的发生发展。
3.2 维生素D与胰岛素抵抗
胰岛素抵抗被认为是通过增加游离脂肪酸(free fatty acids,FFA)流入肝脏和脂肪从头合成以促进肝脏脂肪变性。而维生素D可通过其抗炎作用和调节胰岛素分泌作用显著改善胰岛素的敏感性[43]。研究表明,维生素D可能通过促进葡萄糖转运体4(glucose transporter-4,GLUT4)的表达而增加葡萄糖的摄取和利用[44]。Elseweidy等[45]利用高糖饮食建立糖尿病大鼠模型,相较于对照组,模型组的体质量、血脂异常、高血糖和胰岛素抵抗明显增加。同时,肝脏组织中的胰岛素降解酶显著升高,胰岛素受体磷酸化受到抑制。而口服维生素D则改善了这种代谢紊乱,可能通过降低肝脏胰岛素降解酶的水平、激活胰岛素受体磷酸化而改善糖尿病大鼠模型的胰岛素抵抗和高胰岛素血症。既往研究证实了VDD与小鼠胰岛素抵抗之间的关系,VDD影响了胰腺α细胞和β细胞胰高血糖素及胰岛素的分泌,并改变了胰岛结构,从而导致了葡萄糖稳态异常[46]。值得注意的是,维生素D还可通过抑制肾素-血管紧张素-醛固酮系统间接改善胰岛素抵抗。VDR缺失小鼠的肾素表达和血管紧张素Ⅱ的产生远远高于野生型小鼠,而补充维生素D可抑制肾素的合成[47]。此外,血管紧张素Ⅱ呈时间依赖性地抑制胰岛素诱导的蛋白激酶B激活,其可能通过激活脂肪细胞中的蛋白激酶C发挥对蛋白激酶B的抑制作用,从而抑制胰岛素信号通路,促进胰岛素抵抗[48]。因此,维生素D可通过促进胰岛素抵抗参与MAFLD的发生发展。
3.3 维生素D与炎症反应
肝脏持续慢性炎症是发生胰岛素抵抗的关键,而胰岛素抵抗是MAFLD发生的核心机制,因此炎症反应被认为是MAFLD发病机制中的一个“打击”,而维生素D及其受体在促进炎症反应过程中发挥重要作用。维生素D通过抑制丝裂原活化蛋白激酶和核因子κB(nuclear factor kappa-B,NF-κB)信号通路,阻止促炎基因的转录,从而减少脂肪组织炎症发生[36]。同时,VDR的缺乏可促进肝巨噬细胞浸润,增加炎症基因表达,提高促炎细胞因子水平[32]。一项动物实验研究发现,与西式饮食(高脂肪/高果糖玉米糖浆,west diet,WD)喂养的小鼠相比,WD+VDD组小鼠肝脏小叶的炎症及NAS评分明显升高,且Toll样受体(Toll-like receptor,TLR)2、TLR4、TLR9、白细胞介素(interleukin,IL)-6、IL-1β和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子水平也高于WD组。因此,推测低血清维生素D水平通过激活TLR信号通路,以及下游促炎细胞因子的表达和分泌,从而加重肝脏脂肪变性和炎症,导致肝脏脂肪累积[49]。研究表明,补充维生素D可阻断p53信号通路,抑制HFD诱导的MAFLD小鼠肝细胞的衰老和凋亡,从而减轻氧化应激和炎症反应,延缓MAFLD进展[50]。维生素D还通过上调肝细胞核因子4(hepatocyte nuclear factor 4,HNF4)的转录活性,增强VDR与HNF4结合,从而降低HFD诱导的小鼠脂质累积和胰岛素抵抗[33]。此外,维生素D缓解了肝细胞损伤和脂质累积,并抑制大鼠肝组织NLRP3炎症小体的激活和焦亡[51]。因此,维生素D及VDR可通过上述炎症信号通路促进炎症反应,从而参与MAFLD的发生发展。
3.4 维生素D与免疫功能
肝脏中的多种细胞类型,包括巨噬细胞、中性粒细胞、其他免疫细胞和肝细胞,通过促进慢性炎症反应在MAFLD的发病机制中发挥重要作用[52-53]。随着维生素D缺乏在多种免疫细胞中被发现,人们对维生素D在调节免疫功能方面有了新的认识。维生素D作为一种免疫佐剂能够调节先天性和适应性免疫系统[54]。而先天性免疫系统的激活是NAFLD/NASH中触发和放大肝脏炎症反应的关键因素。研究指出,维生素D-VDR轴的损伤可能损害肠道先天性免疫功能,通过下调潘氏细胞表达的α防御素,引起肠道菌群失调、内毒素血症、全身低度炎症、进而促进胰岛素抵抗和肝脏脂肪变性[37]。此外,维生素D在免疫细胞的分化和增殖中发挥关键作用,可通过抑制免疫细胞增殖,促进抗炎细胞因子表达,扩增调节性T细胞(regulatory T cells,Tregs),增加谷胱甘肽的产生以及抑制肝星状细胞的作用,发挥其免疫调节、抗炎、抗氧化和抗纤维化功能[55]。维生素D还可通过增加单核细胞向巨噬细胞的分化以增强先天免疫[56]。有学者利用HFD建立NASH大鼠模型,给予维生素D补充治疗10周后,发现维生素D慢性治疗可有效恢复全身和肠道维生素D水平,以及改善TNF-α介导的与肠道-脂肪组织-肝轴和肝脂肪变性相关的免疫异常[57]。
3.5 维生素 D与基因调控
VDR基因多态性与MAFLD的发生及严重程度相关。维生素D通过激活VDR的转录活性以调节与炎症和纤维化相关的基因表达[58]。研究发现,活化的VDR上调了血管生成素样蛋白8(angiopoietin-like protein 8,ANGPTL8)的表达,并促进肝细胞中甘油三酯的累积,而肝脏ANGPTL8 mRNA和VDR mRNA含量与MAFLD患者的脂肪变性分级相关,且敲除ANGPTL8基因可减少游离脂肪酸诱导的肝细胞中甘油三酯累积,提示ANGPTL8是一种新的维生素D受体靶基因,可能在肝脂肪变性发病机制中发挥关键作用[59]。此外,多种维生素D相关基因变异与MAFLD相关,其中包括DHCR7、CYP2R1、CYP24A1、CYP27B1、GC和VDR[60]。Arai等[61]研究发现,维生素D水平和VDR相关基因的单核苷酸多态性与肝活检证实的NAFLD患者肝组织纤维化严重程度显著相关。而血浆低维生素D水平可能增加MAFLD的易感性,维生素D结合蛋白中的rs7041-G等位基因还可降低MAFLD的发病风险[62]。上述研究结果均提示,维生素D可能通过基因调控在MAFLD的发病机制中发挥重要作用。
3.6 维生素D与肠道微生物群
研究证实,MAFLD患者存在肠道菌群失调,可通过调节肠-肝轴增加肠道通透性,使病原菌及其代谢产物转移至肝脏,引起肝细胞损伤和炎症反应,从而促进MAFLD的发生发展[63]。维生素D通过激活小肠远端和结肠中高度表达的VDR以控制肠道生理和屏障功能的基因调节[64],并通过抑制肠道上皮细胞凋亡调节肠道微生物群依赖性黏膜炎症[65]。研究显示,对VDD女性患者行维生素D3(50 000 IU/周,持续12周)补充治疗,其肠道微生物群多样性显著增加,特别是益生菌阿克曼氏菌和双歧杆菌的种类明显增加[66],且补充维生素D可改善HFD诱导的大鼠肠道微生物群失调[51]。此外,有学者指出,维生素D缺乏可通过肠-肝循环受损促进NASH的发生和进展。研究显示,通过VDD+HFD诱导小鼠NASH,发现其肝脏和胆道系统中胆汁酸的含量显著降低,回肠顶端钠依赖性胆汁酸共转运体(apical sodium-dependent bile acid transporter,ASBT)的表达下调,从而导致了肝脏的脂肪变性和炎症[67]。这表明维生素D可通过受损的肠-肝循环上调肝脏中的胆汁酸水平,从而抑制NASH。Lee等[68]探讨维生素D对肝硬化大鼠细菌易位的影响,结果显示维生素D上调了小肠和结肠中紧密连接蛋白的表达,降低了硫代乙酰胺诱导肝硬化大鼠模型的细菌异位和肠道通透性,并丰富了潜在的有益肠道微生物群。
4 小结与展望
维生素D及VDR可能通过影响肝脏脂质代谢、促进胰岛素抵抗及炎症反应、参与免疫调节、基因调控和维持肠道稳态等途径参与MAFLD的发生及发展。然而,目前关于二者的相关性及补充维生素D在治疗MAFLD的疗效方面仍存在争议,对于将补充维生素D作为MAFLD患者的替代治疗方案还为时尚早,未来仍需开展更多大样本、多中心的随机对照研究,以明确维生素D治疗MAFLD的最佳剂量和疗程。