miRNAs在肝纤维化中的作用机制
黄 璐,吴有斌,倪毅然,刘梦媛,吴江锋,4,张艳琼
三峡大学 1肿瘤微环境与免疫治疗湖北省重点实验室 2基础医学院 3器官纤维化与靶向治疗研究所,湖北宜昌 443002 三峡大学人民医院 4器官纤维化与靶向治疗研究所 5病理科,湖北宜昌 443099 6宜昌人福药业有限责任公司,湖北宜昌 443000
肝纤维化是一种由多种病因引起的肝脏内纤维结缔组织过度沉积的病理状态,是慢性肝病向肝硬化发展的中间过程和必然阶段。目前,肝活检虽作为评价肝纤维化的金标准,但有创性、可重复性差等缺点限制了其临床应用,因此,寻找灵敏度及特异度高的肝纤维化无创生物标志物成为目前研究热点。现有研究表明,在细胞内合成并加工的成熟体微RNA(microRNAs,miRNAs)可分泌并稳定存在于血清中,且多种miRNAs可通过调节肝纤维化相关基因的表达,干预肝纤维化发展进程[1]。本文就miRNAs在肝纤维化中的作用机制作一综述,以期为肝纤维化的诊断及分子靶向治疗提供借鉴。
1 miRNAs
miRNAs是一类天然的、进化保守的、短链非编码微RNA(约19~23个核苷酸),其在细胞增殖、代谢、分化、周期调控和凋亡等多种生理及病理过程中发挥重要作用[2],此外,miRNAs也是丰富的基因表达调控元件,在动物基因组中,miRNAs的编码基因约占1%~5%,调控着20%~30%的基因表达[3]。
miRNAs能够在细胞核内及细胞质中合成。在细胞核内,miRNAs通过RNA聚合酶Ⅱ被转录为pri-miRNAs的初级转录产物,再由RNase Ⅲ酶(Drosha)和双链RNA结合蛋白(Pasha/DGCR8)组成的复合物直接作用,产生前体miRNAs(pre-miRNAs),或直接切割为成熟miRNAs的3′端(miRNAs-3p)。pre-miRNAs经核转运蛋白exportin 5(Exp5)转运至细胞质中,在核糖核酸酶(Dicer)和反应性RNA结合蛋白2(trans-activation-responsive RNA-Binding Protein 2,TARBP2)的作用下,先切割为双链miRNAs,后加工为成熟miRNAs(miRNAs-5p和miRNAs-3p)。成熟miRNAs能够与AGO2蛋白结合,形成沉默复合物(RNA-induced silencing complex,RISC),进而介导miRNAs表达和RNA干扰导致的基因沉默[7-8]。
2 抑制肝纤维化的miRNAs
2.1 miR-23/27/24
miR-23/27/24由miR-23a/27a/24-2和miR-23b/27b/24-1组成,分别由人体19p13.12和9q22.32染色体上的基因编码。Li 等[9]研究发现,miR-23b通过靶向下调酰基辅酶A硫酯酶4(acyl-coA thioesterase 4,Acot4)表达,抑制乙酰辅酶A降解,减少游离脂肪酸,从而改善非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)引起的肝纤维化,而miR-24通过靶向下调Menin蛋白表达,减弱转化生长因子(transforming growth factor,TGF)-β的促肝纤维化信号;在胆管上皮细胞系和硬化性胆管炎小鼠模型中,miR-24通过下调Menin、COL1A1和TGF-β1等促肝纤维化相关蛋白的表达,从而抑制肝纤维化进展,抑制miR-24则会加重肝纤维化。笔者在前期研究中发现,miR-23b下调TGF-β2表达、miR-27b下调整合素亚基α2和α5(integrin subunit alpha 2/5,Itgα2/5)表达、而miR-23b及miR-27b下调Gremlin1表达、miR-27b及miR-24-1下调酪氨酸氧化酶(lysyl oxidase,LOX)表达,均可抑制 TGF-β 信号通路,进而抑制肝星状细胞(hepatic stellate cells,HSCs)活化,而HSCs的活化与增殖是肝纤维化发生发展的中心环节,该机制在miR-23b/27b/24-1改善四氯化碳(CCl4)导致的肝纤维化小鼠模型中得到验证,因此,miR-23/27/24可能成为肝纤维化治疗的新靶点。然而,在慢性丙型肝炎(chronic hepatitis C,CHC)患者的血清中,miR-23b的水平与天冬氨酸氨基转移酶(aspartate aminotransferase,AST)呈负相关[10]。因此,血清中的miR-23b/27b/24-1是否可用来评估肝细胞损伤、HSCs活化和肝纤维化程度,尚需进一步研究。
2.2 miR-29
miR-29家族由miR-29a、miR-29b-1、miR-29b-2和miR-29c组成,miR-29a/b-1由人体7q32.3染色体上的基因编码,miR-29c/b-2由人体1q32.2染色体上的基因编码[11]。miR-29在HSCs中高表达,但在肝纤维化患者及动物模型中表达量降低[12]。Yu等[13]研究表明,在促纤维化信号TGF-β 和血小板衍生生长因子(platelet-derived growth factor,PDGF)-BB刺激HSCs活化的过程中,细胞自噬作用增强,促进了胞质内miR-29a/b/c以微泡内容物形式排出,miR-29a/b/c减少,抗纤维化作用减弱,在CHC患者及CCl4诱导的肝纤维化小鼠模型中,血清miR-29a/b/c表达水平升高,且与肝纤维化严重程度呈正相关,miR-29a/b/c可抑制HSCs表达COL1A1,COL4A5 和 COL5A3等胶原纤维,减轻TAA和CCl4诱导的肝纤维化程度[14],提示miR-29可作为肝纤维化的生物标志物及治疗靶点。
2.3 miR-122
miR-122由人体18q21.31染色体上的基因编码,是小鼠及人肝脏组织中表达最丰富的miRNAs,分别占比70%和52%,而在其他组织中的表达水平极低[15]。miR-122在多种肝脏疾病中发挥重要作用,研究表明,敲除miR-122基因或注射miR-122拮抗剂会导致小鼠出现严重的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)[16-17]。miR-122在HSCs中通过下调促肝纤维化的脯氨酰4-羟化酶亚基α-1(prolyl 4-hydroxylase subunit alpha-1,P4HA-1)及纤连蛋白1(fibronectin 1,FN1)表达,使细胞外基质(extracellular matrix,ECM)发生降解[18-19]。最新研究报道,miR-122可通过下调非受体酪氨酸激酶Abelson超家族成员c-Abl表达,抑制HSCs活化[20]。鉴于miR-122可在肝脏中特异性表达以及通过多靶点抑制HSCs活化和肝纤维化,目前已成为治疗肝纤维化的研究热点。一项针对CHC患者的研究显示,在诊断早期肝纤维化方面,与AST/血小板比值(AST/platelet ratio index,APRI)、FIB-4指数、Forns纤维化指数等肝纤维化血清学诊断相比,血清中升高的miR-122更具优势[21];通过注射过表达miR-122的间充质干细胞(mesenchymal stem cells,MSCs)及其分泌物,肝纤维化程度得以缓解[22-23]。
3 促进肝纤维化的miRNAs
3.1 miR-34
miR-34由miR-34a、miR-34b和miR-34c组成,miR-34a由人体1p36.22染色体上的基因编码,而miR-34b/c的编码基因位于11q23.1染色体上。miR-34a可通过抑制乙酰基辅酶A合成酶长链家族成员1(acyl-CoA synthetase long-chain family member 1,ACSL1)、过氧化物酶体增殖物激活受体γ(peroxi-some proliferative activated receptor γ,PPARγ)、去乙酰化酶1(sirtuin 1,SIRT1)及TGF-β诱导因子同源异构体2(TGF-β induced factor homeobox 2,TGIF2)等多个靶点促进肝纤维化进程。
静息HSCs的细胞质内存在大量富含维生素A的脂肪滴(贮脂细胞),ACSL1可促进脂质生成并在HSCs内贮存,进而维持HSCs的静息状态,抑制HSCs活化。然而,过表达的miR-34a 下调ACSL1表达,进而促进ECM的分泌,活化HSCs[24]。PPARγ在静息HSCs中表达丰富,其与核内受体结合后,能够抑制HSCs增殖并诱导HSCs凋亡[25]。SIRT1可使p53去乙酰化,阻止其与Smad3形成复合物,抑制TGF-β信号通路中促肝纤维化相关基因的表达,进而抑制HSCs活化和肝纤维化。SIRT1激活剂白藜芦醇及其类似物紫檀芪通过解除miR-34a对SIRT1的抑制作用,在多种肝纤维化模型中显示出良好的抗纤维化效果。TGIF2既可抑制Smad2/3磷酸化,也可抑制TGF-β-Smad2/3信号靶基因的表达。研究表明,在肝内胆管上皮细胞中,miR-34a可通过下调TGIF2,促进TGF-β-Smad2/3信号通路发挥促肝纤维化作用[26-27]。
CHC患者血清中miR-34a的表达量与肝纤维化程度呈正相关,与生存率呈负相关,且miR-34a抑制剂已在多种动物模型中证实能够改善肝纤维化[26,28]。一项针对脂质体miR-34a 类似物的研究显示其可抑制肝细胞癌(hepatocellular carcinoma,HCC)等实体肿瘤的发生发展[29]。因此,miR-34a有望作为CHC、原发性胆汁性胆管炎和NASH等多种肝脏疾病的无创性肝纤维化生物标志物及抗肝纤维化药物应用于临床。
3.2 miR-199
miR-199由miR-199a1、miR-199a2和miR-199b组成,其编码基因分别位于人体19p13.2、1q24.3和9q34.11染色体上。其中,miR-199a2经剪切形成的miR-199a-5p和miR-199a-3p在多种肝纤维化模型及HCC伴肝纤维化患者的血清中表达上调,且与纤维化程度呈正相关[30-31]。小窝蛋白1(caveolin-1,CAV1)可通过介导胞吞作用,内化TGF-β受体和抑制Smad2磷酸化而抑制TGF-β信号通路,进而抑制HSCs活化及肝纤维化[32]。CAV2可与CAV1共表达形成复合物共同发挥作用,miR-199a-5p能够通过种子序列“CCAGUGU”靶向抑制CAV1。研究表明,转染miR-199a-5p类似物可显著下调CAV1表达,并促进HSCs活化[30];同时,miR-199a-3p可通过种子序列“CAGUAGU”抑制CAV2表达,miR-199a-3p拮抗剂能够显著减轻CCL4模型小鼠肝纤维化程度[33]。
3.3 miR-221/222
miR-221/222由人体Xp11.3染色体上的基因编码。miR-221与miR-222的表达产物具有相同的种子序列“GCUACAU”,高度相似的作用靶点和生物学效应。miR-221/222在HCC合并肝硬化、由HCC和NASH引起的肝纤维化患者肝组织中表达上调[34-35]。与静息HSCs相比,活化的HSCs中miR-221/222水平显著升高。研究证实,瞬时转染miR-222前体不仅能够显著上调人HSCs细胞系(LX-2)中COL1A1胶原纤维的mRNA水平,同时也可下调抗肝纤维化基因基质金属蛋白酶(matrix metalloproteinase,MMP)-1和MMP-9的表达[35]。通过分析启动子结构发现,miR-221/222受核因子κB 及c-Jun促肝纤维化转录因子的调控[36]。
研究表明,miR-221/222可通过转录后水平下调多个抗肝纤维化基因表达,促进肝纤维化进程。细胞周期蛋白依赖性激酶抑制剂(cyclin dependent kinase inhibitor,CDKN)1B/C作为miR-221/222的靶点,具有抑制HSCs增殖,进而抑制肝纤维化的作用[35]。细胞因子信号抑制因子(suppressor of cytokine signaling,SOCS)1作为miR-221/222的靶点,可抑制促肝纤维化因子CCL2表达。研究表明,在肝细胞或巨噬细胞中敲除SOCS1可减轻CCl4模型小鼠肝纤维化程度[37-38];组织基质金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinase,TIMP)3作为miR-221/222的靶点,可通过抑制基质金属蛋白酶的活性,抑制ECM降解,从而促进肝纤维化[39];此外,受miR-221/222靶向负调控的促肝纤维化基因还包括PTEN和E-cadherin[40]等。
4 双向调节肝纤维化的miRNAs
miR-155的编码基因位于人体21q21.3染色体上,其表达产物种子序列为“UAAUGCU”。miR-155在巨噬细胞和T淋巴细胞等免疫细胞中表达水平较高,在其他肝细胞类型中表达程度有限,但其对于肝纤维化仍发挥重要的调控作用,且与肝脏原发病类型、作用靶点和细胞类型密切相关。例如,miR-155靶向参与调控Treg细胞分化中含SH2结构域的肌醇5-磷酸酶(SH2 domain-containing inositol 5-phosphatase,SHIP1)。在由刀豆蛋白A(concanavalin A,ConA)介导的免疫性肝损伤小鼠模型中,敲除miR-155可显著减少辅助T淋巴细胞向肝脏募集及产生细胞因子,进而加重肝损伤及肝纤维化[41]。相反,在酒精性脂肪性肝炎和肝纤维化小鼠模型中,巨噬细胞和肝实质细胞中miR-155的表达水平显著升高,进而下调PPARα促进肝纤维化,而敲除miR-155则可显著减轻模型小鼠肝纤维化程度[42]及改善由高脂高糖饮食所引起的肝纤维化[43]。血管紧张素受体(angiotensin type receptor,AGTR)1和T细胞因子(T cell factor,TCF)4均为miR-155的作用靶点,AGTR1通过胞外信号调节激酶1(extracellular signal-regulated kinase 1,ELK1)信号通路促进HSCs活化,而TCF4促进上皮间质转化(epithelial-mesen-chymal transition,EMT)及HSCs活化,HSCs经TGF-β1刺激活化后,miR-155表达水平降低,而过表达miR-155作用于TCF4和AGTR1抑制HSCs的活化,并诱导HSCs凋亡[44]。由于miR-155在不同病因引起的肝纤维化中的作用机制不同,miR-155能否成为治疗肝纤维化的靶点仍有待研究,但已有研究报道,miR-155血清水平与肝硬化严重程度呈正相关,提示其可能是潜在的肝纤维化血清诊断标志物[45]。
上述肝纤维化相关miRNAs的染色体定位、种子序列、作用靶点、效应细胞类型、相关疾病(模型)、表达水平等见图1、表1。
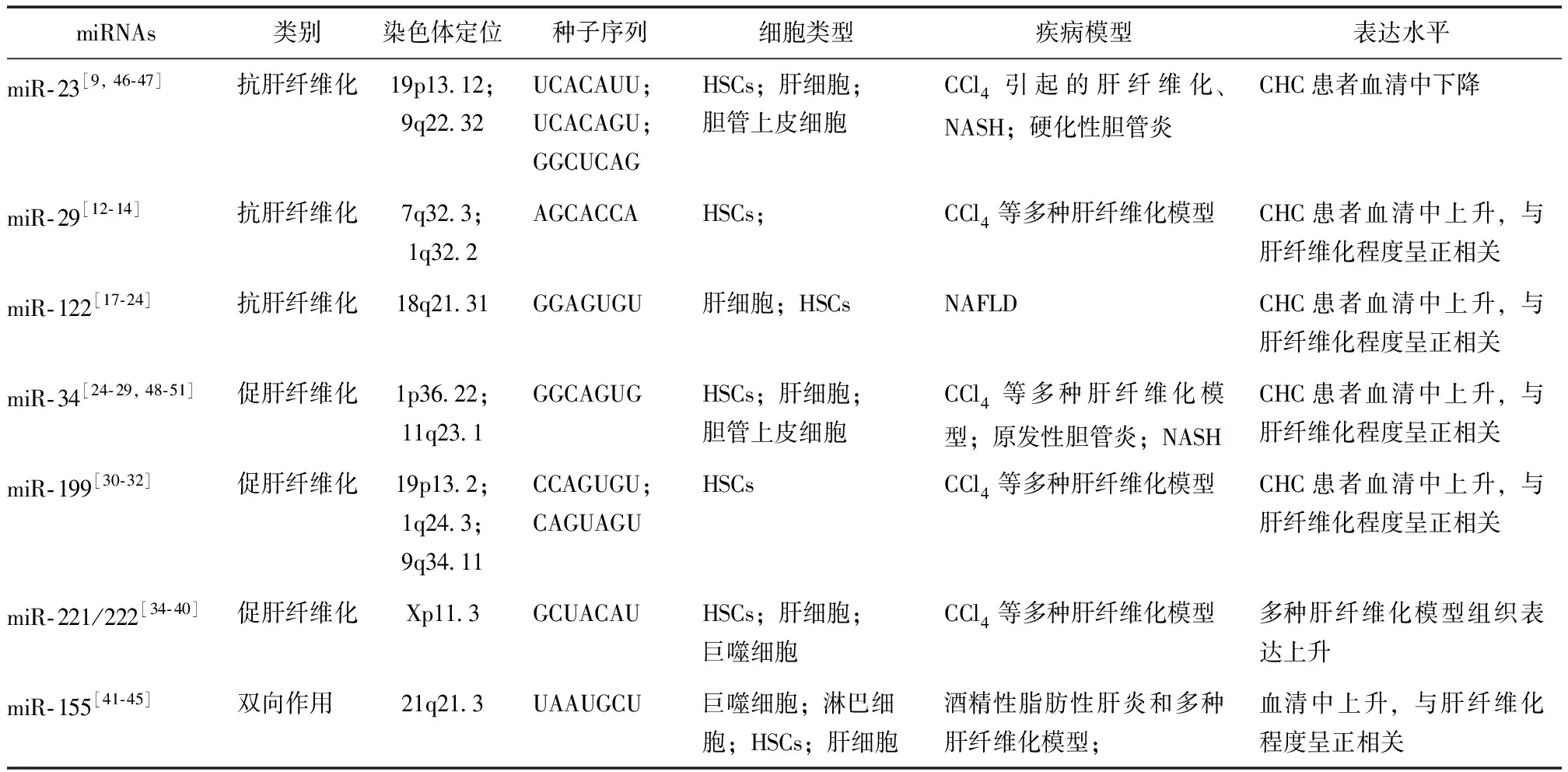
表1 肝纤维化相关miRNAs
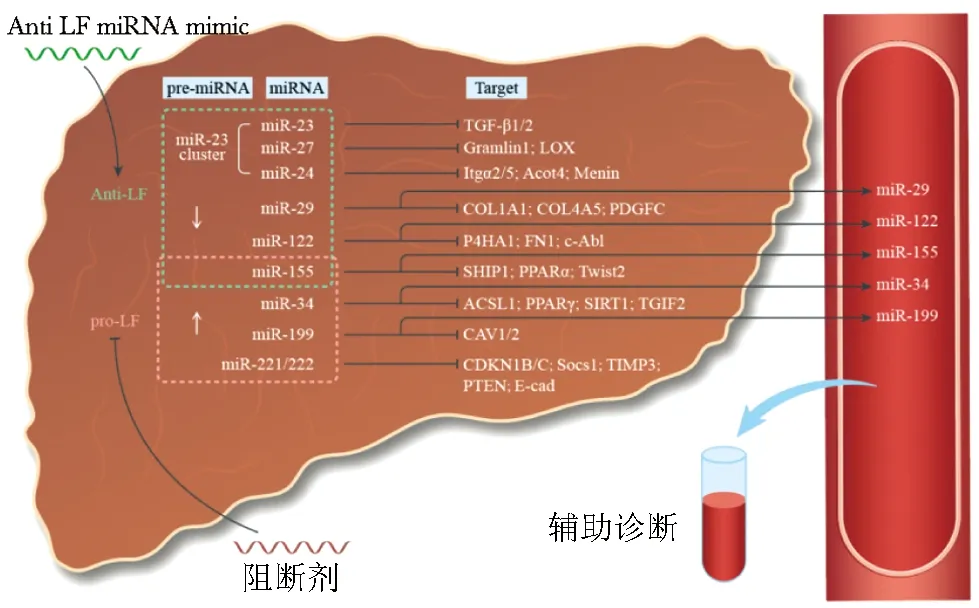
图1 肝纤维化相关miRNAs作用靶点
5 小结与展望
据国内最新指南报道,2019年我国慢性乙型肝炎患者人数为(2000~3000)万,由慢性乙型肝炎发展为肝硬化的年发生率为2%~10%。尽管由慢性肝炎等引起肝纤维化严重危害人类生命健康,但临床上肝纤维化的治疗策略仍以治疗原发病为主,保肝护肝为辅,缺乏特异性干预肝纤维化进程的药物[52]。
目前,使用miRNAs治疗肝纤维化的研究均处于临床前研究阶段,仍无基于miRNAs或其拮抗序列的核酸药物进入临床实验,且诊断与评估肝纤维化的主要手段仍为肝活检[53]。此外,也包括血清生物标志物的测定、瞬时弹性成像和磁共振成像等无创性诊断方法[54]。研究显示,血清miRNAs可用于无创诊断肝纤维化,或评估肝纤维化分级、分期和预后,多种肝纤维化模型和患者血清miR-29、miR-122、miR-34、miR-199和miR-155水平均上调,且与肝纤维化严重程度呈正相关,提示miRNAs可作为肝纤维化无创性血清标志物。
根据肝纤维化过程中miRNAs的调节机制,可将基于miRNAs的核酸类药物分为两类:miRNAs抑制剂(miRNAs互补核酸序列)和miRNAs补充剂(miRNAs类似物),但血清稳定性不足、穿膜效率低及缺乏细胞靶向性限制了该类药物的临床应用。随着核酸类药物结构修饰技术的发展,核酸药物的血清稳定性极大提升,如采用-F、-NH2或-OMe取代核糖2′位的-OH及磷酸骨架的硫代化修饰等[55]。此外,mRNA递送载体脂质纳米颗粒(lipid nanoparticle,LNP)的应用,为miRNAs在血清中的稳定运输提供了条件。随着细胞膜靶标的深入研究,各种靶向递送技术应运而生,如将核酸药物与N-乙酰半乳糖胺偶联,通过唾液酸糖蛋白受体可将miRNAs靶向递送至肝细胞内[56]。肝纤维化的发生发展与HSCs的活化及肝血窦内皮细胞的去窗孔化密切相关。目前笔者正在针对这两类细胞进行核酸适配体的相关研究,拟靶向递送miRNAs,并提高其穿膜效率,通过递送工具将miRNAs递送至细胞质或者细胞核后发挥作用,其中涉及miRNAs与递送工具的切割分离,可根据miRNAs在体内合成的相关特征进行设计达到分离载体和外援miRNAs的作用,以期为肝纤维化的分子靶向治疗提供新的策略。

