脓毒症休克患者复苏早期氧摄取率与预后的相关性
周高生,王小亭,刘晶晶,张宏民,张 青,刘大为
1中国医学科学院北京协和医院重症医学科,北京 100730 2三峡大学第一临床医学院 宜昌市中心人民医院重症医学科,湖北宜昌 443003
脓毒症休克(septic shock)是感染引起可危及生命的急性循环衰竭,为脓毒症病情持续进展的结果,其病理生理本质是组织细胞存在氧供应不足和/或细胞氧利用障碍[1]。尽管在休克早期即进行“以血流动力学为目标”的复苏,但部分患者由于细胞氧代谢异常未得到纠正最终出现了器官功能障碍[2]。机体正常的氧代谢过程包括氧输送(Oxygen delivery,DO2)、氧摄取(Oxygen extraction,EO2)及氧消耗(Oxygen consumption,VO2)[3],脓毒症休克时上述3个环节均受到不同程度的损伤[4],表现为休克早期有效循环血量相对降低直接引起DO2不足。尽管经过积极有效的心肺复苏DO2可得到一定程度的改善,但部分患者仍存在EO2相对降低,以致氧代谢失衡,若不及时纠正,最终可引发多器官功能障碍,严重威胁脓毒症患者的生命安全[5]。
临床可通过氧摄取率(Oxygen extraction ratio,ERO2),即组织从血液中摄取氧的能力反映组织细胞的氧代谢功能,其与微循环灌注及线粒体功能密切相关。脓毒症时炎症介质大量释放可直接引起组织细胞氧代谢功能紊乱,导致ERO2降低[6-7],而维持一定水平的ERO2及细胞氧利用是脓毒症休克复苏的关键环节[8],故ERO2是调节氧代谢功能的重要参数[9],脓毒症休克早期复苏除关注DO2变化外,还应警惕ERO2改变。氧代谢监测是纠正氧代谢失衡的基础,通过氧代谢监测明确组织细胞缺氧状态及复苏后氧代谢恢复情况,对脓毒症休克的治疗至关重要。目前,尽管氧代谢指标的早期监测可为脓毒症休克复苏提供重要的参考信息,但脓毒症休克早期ERO2变化及其与患者预后的关系仍未明确。本研究旨在评估复苏早期ERO2与脓毒症休克患者ICU预后的相关性,以期为开展脓毒症休克复苏早期氧代谢障碍机制相关研究提供临床依据。
1 资料与方法
1.1 研究对象
本文为回顾性分析。研究对象为2016年1月—2021年7月北京协和医院重症医学科脓毒症休克患者。纳入标准:(1)参照国际共识中的相关定义,脓毒症休克诊断明确[1];(2)年龄>18岁;(3)通过脉搏指示连续心排血量技术(pulse indicator continous cadiac output,PiCCO)进行了血流动力学监测,且监测时间>24 h。排除标准:(1)合并急性心肌梗死和严重心肌瓣膜病的患者;(2)大出血患者;(3)住院期间放弃治疗的患者;(4)氧代谢及预后相关指标严重缺失的患者。
本研究已通过北京协和医院伦理审查委员会审批(审批号:I-22PJ102),并豁免患者知情同意。
1.2 研究方法
通过电子病历系统收集脓毒症休克患者的临床资料,包括基本信息、既往史、感染部位、急性生理学和慢性健康状况Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)评分、序贯器官衰竭估计(sequential organ failure assessment,SOFA)评分、乳酸(lactate,Lac)、PiCCO监测的脓毒症休克复苏后6 h血流动力学参数、机械通气时间、连续性肾脏替代治疗时间、ICU住院时间、ICU预后(死亡/生存),并根据ICU预后将患者分为生存组、死亡组。
基于血流动力学参数,根据FICK公式进行氧代谢指标计算[7]:DO2[mL/(min·m2)]=心脏指数[mL/(min·m2)]×动脉血氧含量×10;VO2[mL/(min·m2)]=心脏指数[mL/(min·m2)]×(动脉血氧含量-静脉血氧含量)×10;ERO2=VO2/DO2。其中动脉血氧含量(mL/100 mL)=1.34×血红蛋白×动脉血氧饱和度+0.0031×动脉血氧分压;静脉血氧含量(mL/100 mL)=1.34×血红蛋白×混合静脉血氧饱和度(本文采用中心静脉血氧饱和度替代)+0.003×静脉血氧分压。
1.3 样本量估算
参照文献[10-11]及临床观察,假设脓毒症休克生存、死亡患者ERO2分别为35%、68%。在检验水准α为0.05,把握度(1-β)为0.85的标准下,经计算所需脓毒症休克生存、死亡患者分别为40例、20例,总样本为60例。
1.4 统计学处理
采用SPSS 22.0和GraphPad Prism 8软件进行统计学分析及相关图表绘制。VO2、ERO2等正态分布计量资料以均数±标准差表示,组间比较采用t检验;年龄、APACHE Ⅱ评分、DO2等非正态分布计量资料以中位数(四分位数)表示,组间比较采用Mann-WhitneyU检验。性别、感染部位、机械通气情况等计数资料以频数(百分数)表示,组间比较采用卡方检验。采用单因素及多因素Logistic回归法评估脓毒症休克患者ICU死亡的危险因素,并采用受试者工作特征(receiver operating characteristic,ROC)曲线评估各指标对脓毒症休克患者ICU死亡的预测价值。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入与排除标准的脓毒症休克患者73例。其中男性45例,女性28例;平均年龄(65±16岁);感染部位:肺组织50例,腹腔16例,血流4例,皮肤软组织2例,心内膜1例。
73例脓毒症休克患者中,生存组52例、死亡组21例。相较于生存组,死亡组SOFA评分、APACHE Ⅱ评分明显升高,差异具有统计学意义(P均<0.05)。两组年龄、性别、体质量指数、体表面积、感染部位、机械通气时间、连续性肾脏替代治疗时间、ICU住院时间均无统计学差异(P均>0.05),见表1。
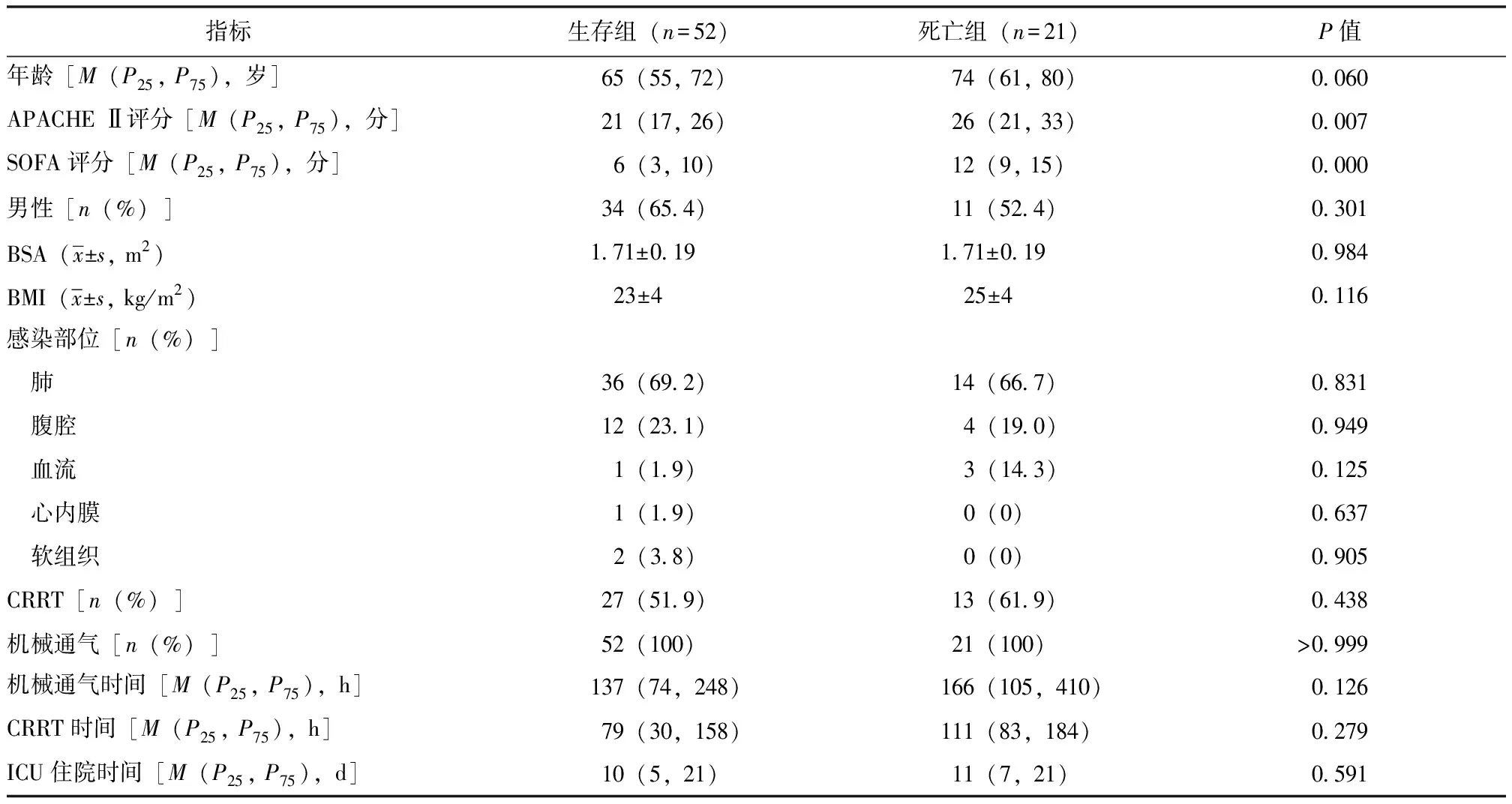
表1 两组患者临床资料比较
2.2 复苏早期氧代谢相关指标与ICU预后的相关性
相较于生存组,死亡组复苏后6 h Lac、VO2、ERO2均升高,差异具有统计学意义(P均<0.05);DO2呈降低趋势,但差异无统计学意义(P=0.159),见表2。

表2 两组患者复苏后6 h氧代谢指标比较
2.3 脓毒症休克患者ICU预后的危险因素分析
结合既往研究结果[10-11]及临床实践,以年龄、APACHE Ⅱ评分、SOFA评分、Lac、ERO2为自变量,脓毒症休克患者ICU预后为因变量,采用单因素和多因素Logistic回归法分析脓毒症休克患者ICU死亡的危险因素。单因素Logistic回归分析结果显示,APACHE Ⅱ评分、SOFA评分、Lac、ERO2均与脓毒症休克患者ICU死亡相关;多因素Logistic回归分析结果显示,APACHE Ⅱ评分、Lac、ERO2是脓毒症休克患者ICU死亡的独立危险因素,见表3、表4。
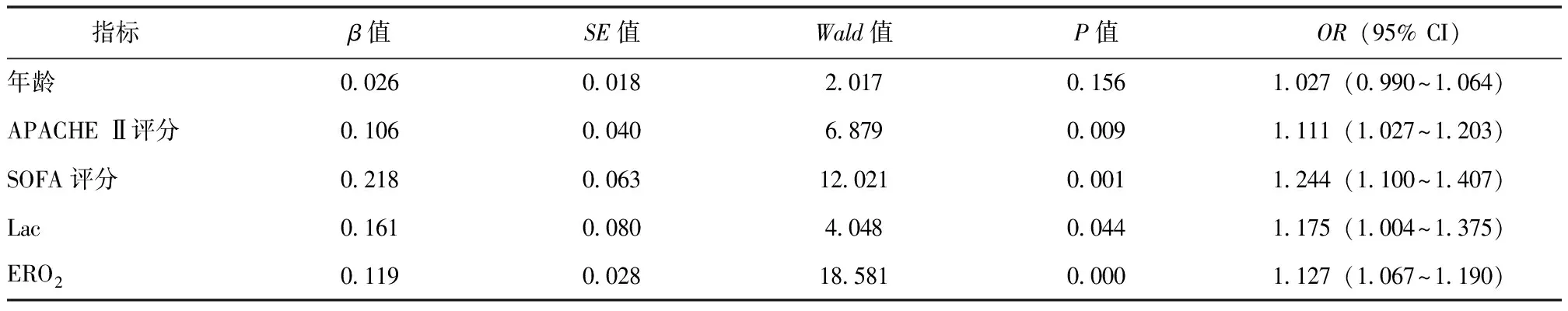
表3 脓毒症休克患者ICU死亡危险因素的单因素 Logistic回归分析
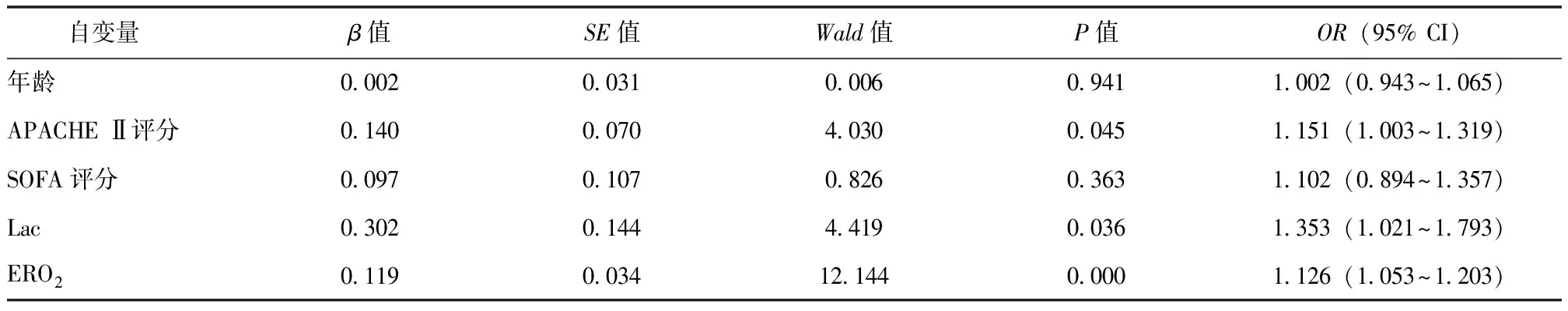
表4 脓毒症休克患者ICU死亡危险因素的多因素 Logistic回归分析
2.4 ERO2对脓毒症休克患者ICU预后的预测价值
选取单因素Logistic回归分析中与脓毒症休克患者ICU死亡相关的指标进行ROC曲线分析,以进一步评估各指标对脓毒症休克患者ICU死亡的预测价值,结果显示ERO2预测脓毒症休克患者ICU死亡的曲线下面积(area under the curve,AUC)为0.833,最佳临界值为45.93%,灵敏度为76.19%,特异度为94.23%,其预测效能优于APACHE Ⅱ评分、SOFA评分和Lac,见图1、表5。
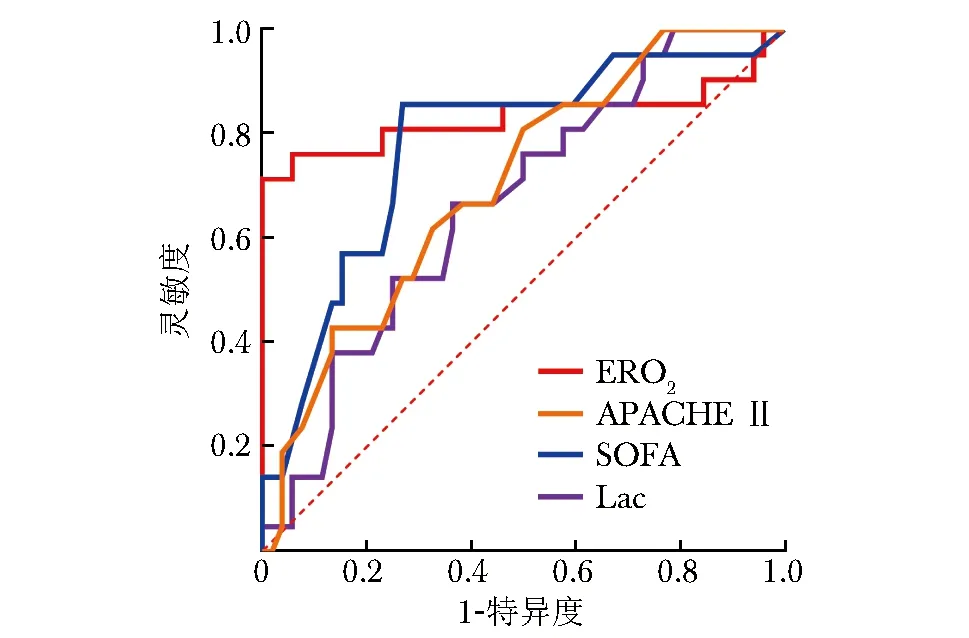
图1 ERO2、Lac等指标预测脓毒症休克患者ICU死亡的受试者工作特征曲线
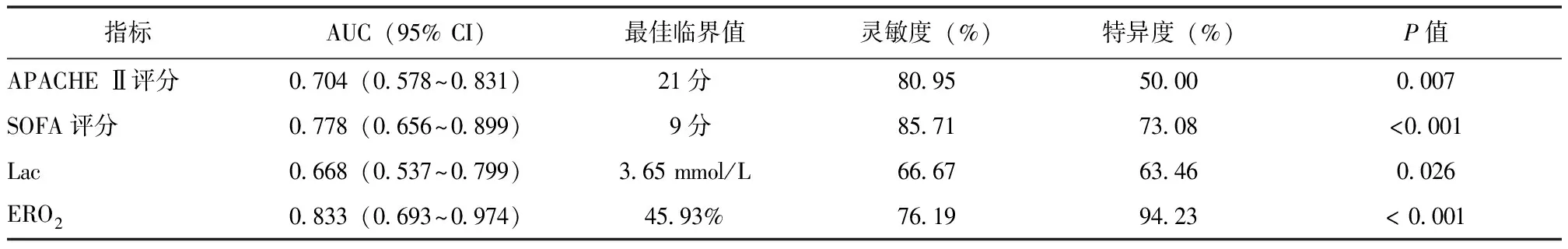
表5 ERO2、Lac等指标对脓毒症休克患者ICU死亡的预测价值
3 讨论
本研究基于73例脓毒症休克患者的临床资料,回顾性分析了脓毒症休克复苏早期氧代谢指标变化规律及其与患者ICU预后的相关性,结果显示死亡组复苏后6 h Lac、VO2、ERO2均升高;多因素Logistic回归分析结果显示,ERO2是脓毒症休克患者ICU死亡的独立危险因素(OR=1.126,95% CI:1.053~1.203,P=0.000),其对脓毒症休克患者ICU死亡具有较高的预测价值,ROC曲线的AUC为0.833,灵敏度为76.19%,特异度为94.23%。
正常状态时DO2能力远大于VO2,故生理情况下VO2仅取决于代谢状态,几乎不受DO2能力的影响,即VO2不依赖于DO2,而脓毒症时由于细胞代谢速率显著增加,以致VO2增多[12]。此时,可通过增加心输出量或血红蛋白水平以代偿性上调DO2能力,使VO2和DO2达到新的平衡[13]。由于个体差异及脓毒症的异质性,上述代偿能力及时程可能不同[14],若代偿机制均被耗竭,则VO2完全依赖于DO2,即所谓的DO2依赖型VO2。脓毒症休克患者由于缺氧,可能存在原发性细胞氧代谢障碍[15],加剧了VO2与DO2失衡程度。ERO2可综合评定VO2与DO2功能状态,反映了机体对氧气的摄取能力,生理情况下ERO2约为25%~30%。本研究生存组及死亡组复苏后6 h ERO2分别为33.71%和56.56%,均存在不同程度的升高,表明脓毒症休克患者通过早期复苏改善DO2的同时,可使ERO2获得不同程度的提升,即脓毒症休克早期组织细胞缺氧一方面是由于DO2不足,另一方面可能存在VO2异常。
脓毒症休克时由于组织细胞VO2增多,而DO2相对不足,且DO2依赖型VO2与非DO2依赖型VO2临界点发生改变,故机体通过代偿机制提升ERO2,以防止组织缺氧进一步加重[16]。研究表明,微循环障碍及血流异质性是引起ERO2变化的重要因素,脓毒症休克早期ERO2增加是中枢神经系统调节和组织细胞局部代谢因素共同作用的结果:机体一方面通过激活交感神经调节外周血管张力,引起器官之间血流重分配;另一方面组织细胞可通过释放血管舒缩物质调节组织器官的有效灌注毛细血管密度[17-18]。提示,此类ERO2升高的脓毒症休克患者复苏早期可能需先提高DO2或降低VO2,以改善氧的供需平衡。
本研究单因素分析显示,相较于生存组,死亡组复苏后6 h VO2升高,DO2呈降低趋势,以致死亡组ERO2升高。如上所述,由于脓毒症时非DO2依赖型VO2转变为DO2依赖型VO2的临界点上调,机体通过增加心输出量仍无法满足组织氧耗,因此只能以增加ERO2的形式满足机体氧需求。复苏后死亡组DO2仍然不足,而ERO2呈增加趋势,亦证明了ERO2升高主要由于机体发生脓毒症休克后为防止组织缺氧代偿所引起。
本研究死亡组复苏后6 h ERO2、Lac均高于生存组,表明死亡组患者复苏早期尽管ERO2代偿性增加,由于缺氧时间较长导致组织细胞虽可摄取氧分子,但因线粒体功能障碍出现组织无法利用氧气的现象,因此,组织细胞仍为无氧代谢,组织缺氧持续存在且程度加重,而持续性氧代谢障碍将造成不可逆性组织损伤。死亡组ERO2较高的原因可能与患者氧代谢失衡加重,虽然机体通过代偿性增高ERO2以改善组织氧供需平衡,但由于细胞代谢障碍、病情不可逆无法使损伤恢复相关。本研究多因素Logistic回归分析结果显示,ERO2、Lac均为脓毒症休克患者ICU死亡的独立危险因素,且对脓毒症休克患者ICU预后具有较好的预测价值。可能原因:脓毒症休克患者细胞发生氧代谢障碍且代偿机制被耗竭时,组织细胞缺氧将导致氧代谢发生重编程,由有氧代谢转换为无氧酵解,以致Lac生成增多[19]。故复苏早期ERO2、Lac变化可预测脓毒症休克患者ICU预后,而ERO2作为细胞氧代谢的上游因素,其对缺氧及预后的预测价值明显优于细胞氧代谢的下游指标Lac。Rivers等[20]提出的早期目标导向性治疗(early goal-directed therapy,EGDT)方案强调了“以氧代谢为复苏目标”策略的实用性,为脓毒症休克患者的个体化复苏提供了重要理论依据。近年来,越来越多的研究者意识到血流在休克中具有龙头效应,而血流中的氧流更是休克血流动力学复苏的目的性指标[21]。组织细胞缺氧作为脓毒症休克的本质,决定了氧代谢监测对脓毒症休克治疗及预后的重要指导意义。因此,脓毒症休克的复苏及预后不仅需关注血流动力学指标,更应重视氧代谢指标,尤其ERO2的监测和管理。对于复苏后ERO2仍处于高水平的脓毒症休克患者,ICU死亡的风险增高,应在积极进行病因治疗的同时,进一步调整DO2、VO2及ERO2,从而改善复苏效果及临床预后。
本研究局限性:(1)为单中心回顾性研究且样本量较小,确切结论仍需多中心大样本前瞻性研究进一步验证;(2)仅评估了氧代谢指标与脓毒症休克患者ICU预后的关系,缺乏详细机制的分析。
综上所述,复苏早期ERO2可预测脓毒症休克患者ICU死亡风险,氧代谢指标不仅可作为脓毒症休克病情监测及复苏的指标,亦可作为临床转归的评价指标。

