基于《第一批罕见病目录》的罕见病药物可及性研究
刘清扬,刘 鑫,王少红,尚俊美,唐 彦,张 波
中国医学科学院北京协和医院药剂科,北京 100730
罕见病是一类患病人数少、发病率低的疾病,具有种类多、遗传为主、诊断难、病情重、可治性低、治疗费用昂贵等特点[1]。据文献报道,约80%的罕见病为遗传疾病,约50%~60%的罕见病为儿童疾病[2],罕见病为患者的生活和国家医疗费用支出带来了沉重负担。近年来,国家高度关注罕见病用药,从药物研发、注册、定价与报销、供应、监管等方面均制定了相关政策,鼓励与支持罕见病用药[3]。2018年5月,我国公布了《第一批罕见病目录》后[4],相继发布《第一批罕见病目录释义》[5]、《罕见病诊疗指南(2019版)》[6]等指导罕见病的临床诊疗规范,并推进罕见病病例登记注册制度[7]及全国罕见病诊疗协作网[8]的建立。此外,国家卫生健康委公布了国家罕见病医学中心的设置标准[9]。
罕见病治疗手段有限,药物治疗是其重要的治疗方式。孤儿药是指用于预防、诊断和治疗罕见病的药物[1],目前美国食品药品监督管理局(Food and Drug Administration,FDA)和欧洲药品管理局(European Medicines Agency,EMA)等通过孤儿药资格认定的方式,激励和加速孤儿药获批上市用于罕见病的治疗[10]。近年来,《第一批罕见病目录释义》[5]和《罕见病诊疗指南(2019版)》[6]等的编写,梳理了罕见病相关治疗药物,为罕见病的标准化和规范化治疗提供了参考。然而,目前我国尚无罕见病的明确定义,仅发布了罕见病目录释义,也无孤儿药资格认定相关政策,导致评价罕见病治疗药物可及性的不同研究和数据报道存在较大差异。本研究以美国FDA和EMA获批上市的孤儿药及我国药品说明书适应证批准用于罕见病治疗的药物为标准,梳理《第一批罕见病目录》中的罕见病治疗药物,并分析其可及性,完善和更新我国罕见病药物治疗现状,为罕见病药物治疗的管理和研究提供参考。
1 资料与方法
1.1 资料
本研究以《第一批罕见病目录》中的疾病为参考,研究对象为《第一批罕见病目录》疾病在美国FDA、EMA获批上市且在我国国家药品监督管理局(National Medical Products Administration,NMPA)获得批准文号的孤儿药,以及我国药品说明书适应证批准用于治疗《第一批罕见病目录》疾病的药物。
1.2 方法
(1)梳理《第一批罕见病目录》疾病的国内外治疗药物。国外药物:检索在美国FDA[11]和EMA[12]获得孤儿药资格认定的药物目录;检索时间范围:美国FDA自1983年1月1日起,EMA自数据库建立起,截至时间为2022年12月31日。提取上述孤儿药在美国FDA(状态为Designated/Approved)和人类医学欧洲公众评估报告(Human Medicine European Public Assessment Report,EPAR)获批罕见病适应证上市的药品。因国内尚无孤儿药目录或数据库,故通过“药智网”“用药助手”等工具,检索我国药品说明书适应证批准用于罕见病治疗的药物,获得罕见病治疗药物目录。
(2)对罕见病药物的可及性进行分析。检索国外已获批罕见病适应证上市的孤儿药在我国NMPA[13]获得批准文号的情况(截至2022年12月31日),分析国内外罕见病药物的可及性差异。对于NMPA已有批准文号的药品,记录其是否具有国产药品文号和/或进口药品文号,分析罕见病药物在我国的国产化情况。通过NMPA药品审评中心网站公布的三批临床急需境外新药名单,检索上述药物是否具有“临床急需境外新药”身份[14-16]。通过2023年3月1日实施的国家基本医疗保险目录[17]检索上述已具有NMPA批准文号的罕见病药物是否纳入国家医保目录及报销范围,分析其在我国用于罕见病治疗的医保覆盖情况。
信息检索、梳理和统计分析工作均由双人核对完成,以确保数据准确。
1.3 统计学处理
本研究采用描述性统计学方法,通过频数(百分数)对罕见病种类、罕见病药物种类及药物剂型数量等计数资料进行统计描述。
2 结果
2.1 罕见病的药物治疗现状
《第一批罕见病目录》共纳入121种罕见病,对其治疗药物进行分析。在美国FDA,共55种(45.5%,55/121)罕见病具有至少1种孤儿药获批相关适应证上市;在EMA,共27种(22.3%,27/121)罕见病具有至少1种孤儿药获批上市;在FDA和EMA,仍有24种罕见病尚无获得孤儿药资格认定的治疗药物,27种罕见病具有孤儿药资格认定的治疗药物但均未获批罕见病适应证上市,合计共51种罕见病均无获批上市的治疗药物。在我国,44种罕见病具有孤儿药(已在美国FDA上市)并取得NMPA批准文号,26种罕见病具有孤儿药(已在EMA上市)并取得NMPA批准文号,合计共48种罕见病(39.7%,48/121)国外上市的孤儿药在国内可及。检索我国药品说明书,43种(35.5%,43/121)罕见病具有至少1种可治疗性药物。以上共53种(43.8%,53/121)罕见病在国内具有治疗药物。
仍有11种罕见病的孤儿药在美国FDA和/或EMA已上市,而在我国尚未获得NMPA批准文号。以下6种罕见病在美国FDA和EMA均有上市的孤儿药而我国尚无:低碱性磷酸酶血症、N-乙酰谷氨酸合成酶缺乏症、卟啉病、婴儿严重肌阵挛性癫痫、甲基丙二酸血症、丙酸血症;以下3种罕见病在美国FDA有上市的孤儿药而我国尚无:溶酶体酸性脂肪酶缺乏症、进行性家族性肝内胆汁淤积症、进行性肌营养不良;以下2种罕见病在EMA有上市的孤儿药而我国尚无:异戊酸血症、视网膜色素变性。
此外,以下5种罕见病在美国FDA和EMA均无上市的孤儿药,而我国则有相应的治疗药物(药品说明书批准用于其治疗):先天性肾上腺发育不良、帕金森病(青年型、早发型)、原发性联合免疫缺陷、谷固醇血症、X-连锁无丙种球蛋白血症。
2.2 罕见病相关治疗药物
对于《第一批罕见病目录》疾病,在美国FDA和EMA获批上市的孤儿药中(包含在美国FDA上市的74种孤儿药和在EMA上市的36种孤儿药),共80种至少1种剂型获得NMPA批准文号。此外,我国药品说明书已批准93种药物用于罕见病的治疗,其中39种(41.9%,39/93)药物在美国FDA或EMA尚未获批罕见病孤儿药上市。通过文献检索和数据汇总,《第一批罕见病目录》的罕见病治疗药物共116种,其中22种为临床急需境外新药,详见表1。
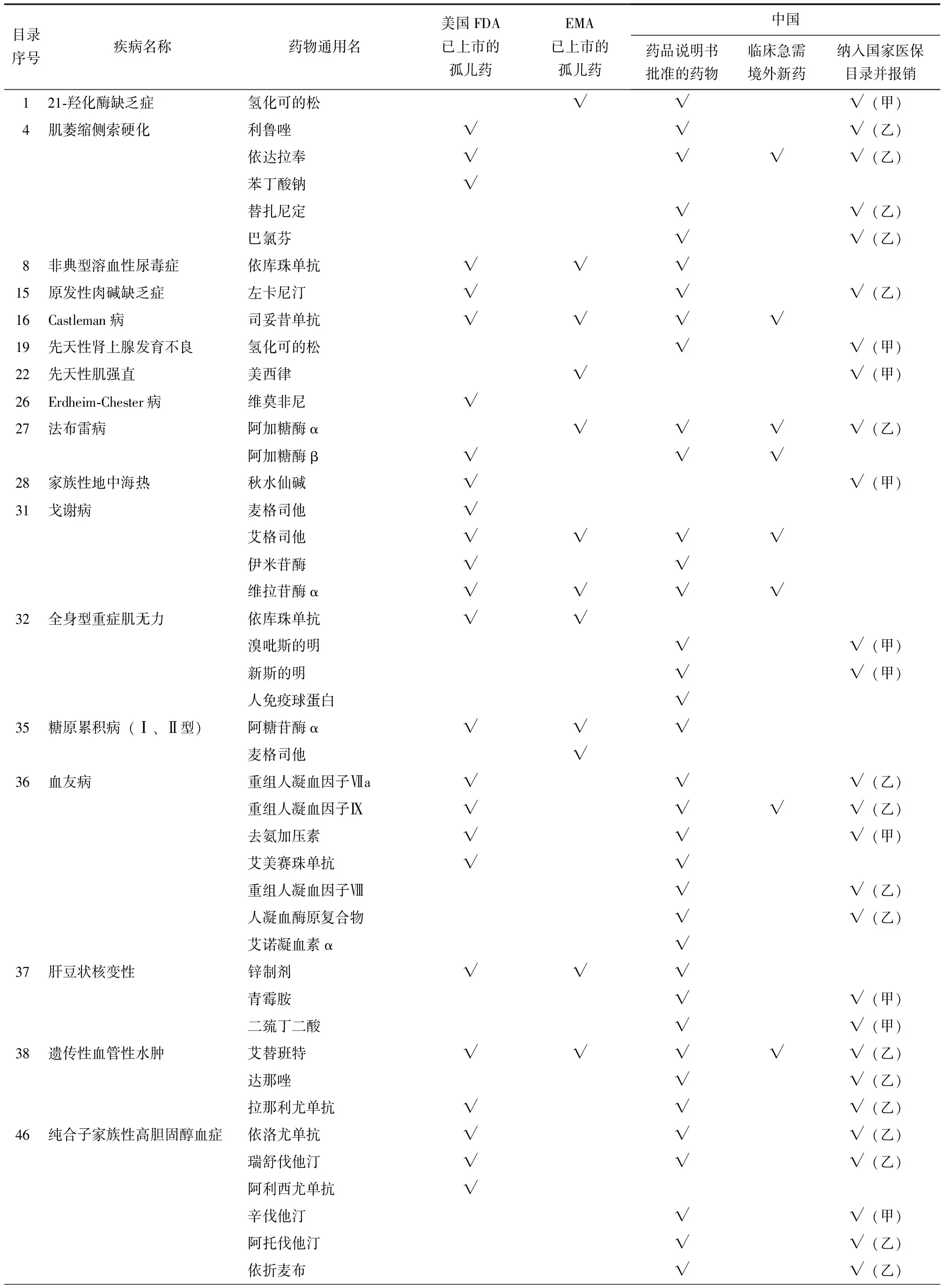
表1 《第一批罕见病目录》的罕见病治疗药物
2.3 罕见病药物可及性分析
2.3.1 罕见病药物批准文号情况
在我国,《第一批罕见病目录》的罕见病治疗药物共116种,其中33种(28.4%,33/116)药物仅有国产批准文号的药品剂型,57种(49.1%,57/116)药物仅有进口批准文号的药品剂型,26种(22.4%,26/116)药物同时具有国产和进口批准文号的药品剂型。共59种药物具有至少1种国产批准文号的药品剂型,覆盖36种罕见病;17种罕见病目前尚无国产批准文号的药品剂型,仍完全依赖进口。
上述116种罕见病药物现共有185种药品剂型,其中89种(48.1%,89/185)药品剂型仅有国产批准文号,68种(36.8%,68/185)药品剂型仅有进口批准文号,28种(15.1%,28/185)药品剂型同时具有国产和进口批准文号。
2.3.2 罕见病药物国家医保目录纳入情况
从药物角度分析,截至2023年3月1日实施的国家医保目录,共69种(59.5%,69/116)药物具有至少1种药品剂型可用于罕见病治疗,已纳入国家医保目录且在报销范围内;12种(10.3%,12/116)药物已纳入国家医保目录但均不在报销范围内(用于治疗任何一种罕见病);35种(30.2%,35/116)药物未纳入国家医保目录。
从疾病角度分析,29种(54.7%,29/53)罕见病具有至少1种药物纳入国家医保目录且在报销范围内;11种(20.8%,11/53)罕见病有部分药物纳入国家医保目录,但限定的报销适应证中未覆盖这些疾病;13种(24.5%,13/53)罕见病的全部治疗药物均未纳入国家医保目录。
由于存在1种罕见病药物可同时治疗多种罕见病的情形,上述罕见病药物的不同药品剂型用于治疗《第一批罕见病目录》的罕见病包括216种情形:115种(53.2%,115/216)药物纳入国家医保目录并在报销范围内,包含医保甲类40种、医保乙类75种;40种(18.5%,40/216)虽纳入国家医保目录,但治疗罕见病不属于医保报销范围;61种(28.2%,61/216)未纳入国家医保目录。
2018年国家医疗保障局正式成立以来,国家医保目录每年均进行修订,现对2019—2022年国家医保目录新增《第一批罕见病目录》的罕见病药物进行梳理,详见表2。

表2 2019—2022年国家医保目录新增《第一批罕见病目录》的罕见病药物
3 讨论
目前,我国48种罕见病具有孤儿药(已在美国FDA或EMA获批罕见病适应证上市)且已获得NMPA批准文号,相较于2019年,新增了28种罕见病[1];在美国FDA和EMA获批上市的孤儿药,分别有74种和36种获得NMPA批准文号,相较于2019年(分别有27种和8种在中国上市)[1],罕见病药物在我国的可及性显著提高,我国与美国FDA和EMA在罕见病药物可及性方面的差距逐渐缩小。但仍存在罕见病“境外有药,境内未批准”的现状,目前《第一批罕见病目录》中的11种罕见病在美国FDA或EMA具有获批上市的孤儿药,而我国暂无上述药物的批准文号。针对“境外有药,境内未批准”的药物,国家药品监督管理局药品审评中心先后公布了三批临床急需境外新药名单,36种药物可用于《第一批罕见病目录》的疾病治疗。截至2023年3月,已有22种药物在我国上市,覆盖16种罕见病,与2020年11月的统计数据[2]相比,新增了9个品种。对于米托坦、氯巴占、依库珠单抗等药物,北京协和医院采取“罕见病药物一次性进口”“拓展性同情使用临床试验用药”、开设急需用药“绿色通道”等方式,最大程度满足罕见病患者的治疗需求。
获得NMPA批准文号的罕见病药物,其中50.9%(59/116)具有至少1种药品剂型获国产批准文号,相较于2019年的48.1%(13/27)有所增加,国产化药品的占比提高。然而,目前仍存在罕见病药物“境内批准,但难于获得”的现状,如国内暂无用于治疗血友病的去氨加压素鼻喷剂型,暂无用于治疗肺囊性纤维化的妥布霉素、氨曲南和甘露醇等吸入剂型,以及暂无治疗镰刀型细胞贫血病的L-谷氨酰胺较高剂量的口服剂型等。
近年来,国家和政府部门大力推进罕见病用药工作,自2019年至今国家医保目录共进行了4次修订、新增18种罕见病药物。2022年,我国针对罕见病用药开通了单独申报渠道,以支持其优先进入医保目录,在很大程度上提高了罕见病患者治疗的可及性与可负担性。截至2023年3月1日,共69种罕见病药物纳入国家医保目录并在报销范围内,覆盖29种罕见病,与《中国罕见病药物可及性报告(2019)》[18]的统计数据相比,新增了11种罕见病的40种治疗药物。但我国的罕见病医疗保障体系仍不健全,高值类罕见病药品保障还不够充分,仍存在“境内有药,医疗保障不足,患者经济负担重”的现状。目前,仍有24种罕见病的治疗药物均未被国家医保目录报销范围覆盖,47种罕见病药物未纳入医保目录,其中涉及诸多高值类药物。如依库珠单抗,美国FDA或EMA已批准其用于非典型溶血性尿毒症、阵发性睡眠性血红蛋白尿、全身型重症肌无力、视神经脊髓炎等多种罕见病的治疗,年治疗费用超过200万元。
4 小结
本研究首次以美国FDA和EMA获批罕见病适应证上市的孤儿药及我国药品说明书适应证批准用于罕见病治疗的药物作为参考,梳理我国《第一批罕见病目录》的罕见病治疗药物。同时,既横向比较了罕见病药物在国内外的可及性差异,以及上述药物在我国的本土化生产情况、国家医保目录覆盖情况,又纵向比较了上述内容相较于《第一批罕见病目录》发布时的发展变化情况。《第一批罕见病目录》发布以来,国内罕见病治疗药物可及性持续提高,国内自主生产的药物品种不断增加,越来越多的药物纳入国家医保报销范围,将满足罕见病患者的治疗需要。