基于液相色谱-串联质谱法研究男宝胶囊中人参投料掺伪*
薛 平,汪嘉丽,王倬暄,李 莉,刘旻虹,顾峥嵘,黄强燕,潘璐艳
常州市食品药品纤维质量监督检验中心,常州 213000
男宝胶囊最早名为补肾胶囊,具有补肾壮阳、益精养血之功效,由鹿茸、牡丹皮、黄芪、人参、肉桂、枸杞子等31 味中药组成,其内容物为暗褐色粉末,味微咸,气微弱,临床上主要用于肾阳不足引起的性欲淡漠,阳痿滑泄,腰腿酸痛,肾囊湿冷,精神萎靡,食欲不振等症[1]。
目前男宝胶囊的质量控制方法主要是关于人参、肉桂和附子等药味的薄层色谱鉴别[2,3],淫羊藿苷、丹皮酚和金丝桃苷等成分的含量测定[4-6],也有针对一家生产企业形成的质量标准草案[7],然而关于原料药投料真实性的研究相对较少。
近年来多次报道人参中掺伪西洋参进行含人参制剂的投料生产情况,其中将拟人参皂苷F11为西洋参中特征成分作为非法投料使用的检验依据[8]。男宝胶囊是本中心承担的国家药品监督管理局2022 年国家药品抽验品种,针对上述监管空白,本研究采用液相色谱-串联质谱法探究男宝胶囊中人参的投料情况,制定合理的掺伪判定原则,为中成药质量控制和市场监管提供参考。
1 材 料
1.1 仪器
LCMS-8060 高效液相色谱质谱联用仪(日本岛津有限公司);XP504 万分之一电子天平、XP105DR万分之一电子天平(瑞士梅特勒-托利多公司);KQ5200DE 超声波清洗器(昆山市超声仪器有限公司);Milli-Q 超纯水处理系统(默克密理博有限公司)。
1.2 试药与试样
拟人参皂苷F11对照品(批号110841-202209,含量99.5%)和人参皂苷Rf 对照品(批号111719-201806,含量100%)均购自于中国食品药品检定研究院。
男宝胶囊样品来源于全国30 个省级行政区,共涉及8 家生产企业(编号S1~S8),72 批次样品。乙腈均为色谱纯,甲醇为分析纯,水为去离子水。
2 方法与结果
2.1 色谱及质谱条件[8-10]
2.1.1 色谱条件 色谱柱:Agilent Poroshell 120 SB C18(2.1 mm×100 mm,2.7 μm);流动相:乙腈(A)-水(B),行梯度洗脱:0 min(20∶80)→2 min(50∶50)→4.5 min(80∶20);流速0.35 mL·min-1;柱温40℃;进样量5 μL。
2.1.2 质谱条件 以三重四极杆串联质谱仪检测:电喷雾离子源(electron spray ionization,ESI);离子源接口温度:300℃;脱溶剂温度:526℃;DL 管温度:250℃;载气流速:2.8 L·min-1;加热器流量:10 L·min-1;加热块温度:400℃;干燥气流速:10 L·min-1;采集模式为负离子模式;各化合物监测离子对和碰撞电压(collision energy,CE)见表1。

表1 化合物质谱测定条件
2.2 溶液的制备
2.2.1 对照品贮备液 精密称取拟人参皂苷F11对照品适量,加甲醇制成100 μg·mL-1的溶液,作为拟人参皂苷F11贮备溶液。精密称取人参皂苷Rf 的对照品适量,加甲醇制成85 μg·mL-1的溶液,作为人参皂苷Rf 贮备溶液。
2.2.2 供试品溶液 取男宝胶囊内容物,研细,取约3 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇100 mL,密塞,称定重量,超声处理30 min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,精密量取续滤液1 mL,置25 mL 量瓶中,加20%乙腈稀释至刻度,摇匀,即得。
2.2.3 阳性对照溶液 按生产企业S5 的处方比例及工艺,制备含0%、3%、5%、10%、20%、50%和100%西洋参的阳性对照样品,按“2.2.2”项下方法制备系列阳性对照溶液。
2.3 专属性实验
取“2.2”项下的含0%西洋参对照溶液、含100%西洋参阳性对照溶液和对照品溶液(拟人参皂苷F11和人参皂苷线性关系中第三个浓度点),按“2.1”项下条件各进样5 μL 分析,质谱多反应监测模式(multiple reaction monitoring,MRM)提取离子对色谱叠加图见图1。结果发现0%对照溶液均未检出拟人参皂苷F11,检出人参皂苷Rf 色谱峰;含100%西洋参阳性样品中检出拟人参皂苷F11色谱峰,未检出人参皂苷Rf 色谱峰,表明拟人参皂苷F11可作为男宝胶囊中西洋参掺伪的专属性鉴别成分。
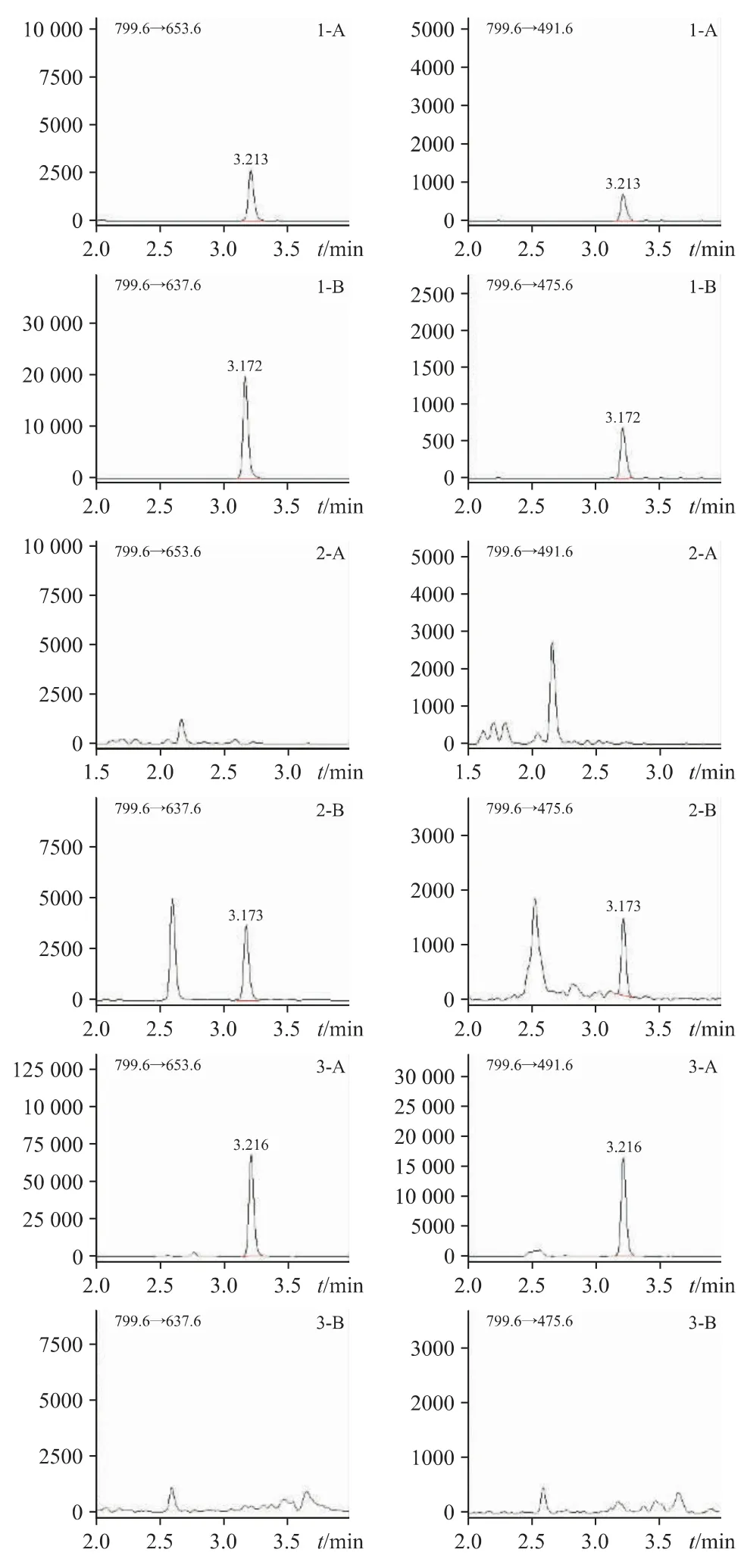
图1 对照品溶液及对照溶液MRM 提取离子对色谱叠加图
2.4 线性关系考察
精密吸取拟人参皂苷F11贮备溶液1 mL,置100 mL 量瓶中,加20%乙腈稀释至刻度,摇匀,作为拟人参皂苷F11对照溶液。精密吸取人参皂苷Rf 贮备溶液5 mL,置100 mL 量瓶中,加20%乙腈稀释至刻度,摇匀,作为人参皂苷Rf 对照溶液。
分别精密量取拟人参皂苷F11对照溶液0.1、0.2、0.5、1.0、2.0、4.0、5.0、10.0 mL 置100 mL 量瓶中,加20%乙腈稀释至刻度,摇匀,制得拟人参皂苷F11系列对照品溶液。分别精密量取人参皂苷Rf 对照溶液0.1、0.2、0.5、1.0、2.0、4.0 mL 置100 mL 量瓶中,加20%乙腈稀释至刻度,摇匀,制得人参皂苷Rf 系列对照品溶液。
按“2.1”项下条件将上述系列对照品溶液进样测定峰面积,以对照品浓度(ng·mL-1)为横坐标(X),峰面积为纵坐标(Y),得拟人参皂苷F11线性方程为Y=4.854×103X+1.575×103(r=0.999 4),线性范围1.049~104.900 ng·mL-1;人参皂苷Rf 线性方程为Y=2.963×103X+4.392×103(r=0.998 9),线性范围4.250~170.000 ng·mL-1。
2.5 定量限与检测限
取线性关系中对照品溶液稀释至一定的浓度,按“2.1”项下条件进样分析。以信噪比为10∶1 时相应浓度计算定量限,以信噪比为3∶1 时相应浓度计算检测限。定量限与检测限均折算至样品,拟人参皂苷F11定量限为0.087 μg·g-1,检测限为0.035 μg·g-1;人参皂苷Rf 定量限为0.071 μg·g-1,检测限为0.028 μg·g-1。
2.6 进样精密度试验
取对照品溶液(拟人参皂苷F1110.487 ng·mL-1,人参皂苷Rf 42.000 ng·mL-1),按“2.1”项下条件进样分析,连续进6 针,记录峰面积。结果拟人参皂苷F11和人参皂苷Rf 峰面积的RSD(n=6)为1.41%和1.54%,表明仪器精密度良好。
2.7 重复性试验
取男宝胶囊样品(编号S6-4),按“2.2.2”项下方法平行制备6 份供试品溶液,按“2.1”项下条件进样分析,测得拟人参皂苷F11和人参皂苷Rf 平均含量分别为3.478 和24.601 μg·g-1,RSD 分别为6.98%和2.70%(n=6),结果表明本方法重复性良好。
2.8 稳定性试验
取男宝胶囊样品(编号S3-3),按“2.2.2”项下方法制备供试品溶液,在0、2、4、8、12、24 h 内按“2.1”项下条件进样分析,记录峰面积,拟人参皂苷F11和人参皂苷Rf RSD 分别为5.29%和4.78%(n=6),结果表明供试品溶液24 h 内稳定性良好。
2.9 加样回收率试验
取男宝胶囊样品(编号S2-1,拟人参皂苷F11含量19.563 μg·g-1,人参皂苷Rf 20.288 μg·g-1)约1.5 g,分别精密加入拟人参皂苷F11贮备溶液0.3 mL,人参皂苷Rf 贮备溶液0.4 mL,按“2.2.2”项下方法制备供试品溶液,平行制备6 份,再按2.1”项下条件进样分析。根据试验结果计算含量、回收率、平均回收率,结果(表2)表明本试验准确度良好。
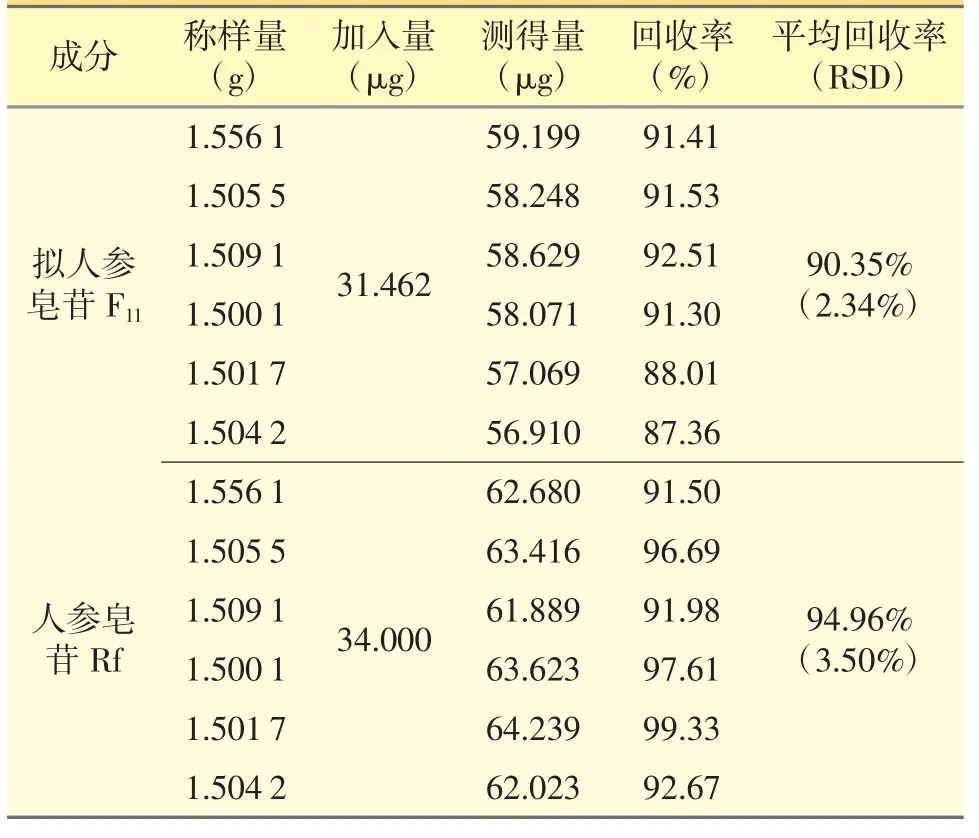
表2 加样回收试验结果(n=6)
2.10 样品含量测定结果
取不同生产企业的男宝胶囊样品,按“2.2.2”项下方法制备供试品溶液,再按上述“2.1”项下条件分析,分别计算样品中拟人参皂苷F11和人参皂苷Rf的含量。
8 家生产企业共72 批次样品,受篇幅限制测定数据不便于一一列出。故将测定结果以不同生产企业为单位,统计生产企业不同批次样品中拟人参皂苷F11和人参皂苷Rf 含量范围与平均值,详见表3。

表3 不同生产企业样品含量测定结果(μg·g-1,n=2)
3 限度浓度的制定
8 家企业的男宝胶囊生产工艺均是部分原料水提+部分原料30%乙醇提+部分原粉入药,其中人参均为水煎煮提取。对比各企业生产工艺,详见表4(秉持对企业生产工艺保密原则,表4 仅列出涉及人参的处方量、制成量和水煎煮提取方式),发现上述生产企业之间存在细微的差异,7 家人参投料量完全一致,生产企业S3 的投料量稍有差异(800 g 胶囊内容物的人参投料量为人参77.8 g),少了接近22%,但该生产企业的男宝胶囊中拟人参皂苷F11含量相对较低,远远低于拟定限度的78%(男宝胶囊样品中拟人参皂苷F11含量为8.3 μg·g-1×78%=6.5 μg·g-1),该企业掺伪风险低。考虑到成本、效率和方法的一致性,故统一制备阳性对照样品,拟定西洋参掺伪限度。生产企业S5 的生产工艺(800 g 胶囊内容物的人参投料量为人参100 g,煎煮3 次,第一次2 h,第二次1.5 h,第三次1 h)较为均衡兼顾,故参照生产企业S5 的生产工艺阳性对照样品(模拟掺伪西洋参样品)。
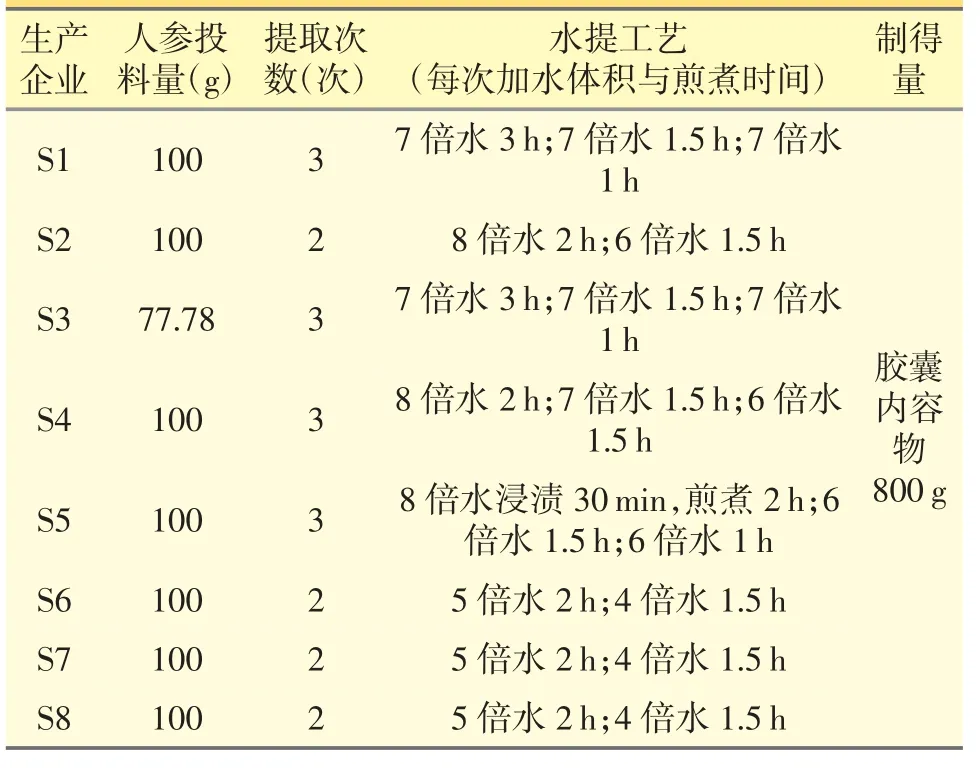
表4 8 家生产企业人参投料量与制得量生产工艺对比
3.1 掺伪比例考察
取“2.2.3”项下含0%、3%、5%、10%、20%、50%和100%西洋参的阳性对照样品,按“2.1”项下条件测定,计算样品中拟人参皂苷F11。阳性对照溶液的阳性对照样品(模拟掺伪西洋参样品)使用的西洋参来源为辽宁龙参健康药业有限公司,批号211001,拟人参皂苷F11含量1.299×103μg·g-1。
测定结果(表5)显示,当掺入3%的西洋参时,样品中拟人参皂苷F11已经能被检出。同时按公式阳性对照样品测得含量/阳性对照样品理论含量×100%计算拟人参皂苷F11转移率,其中阳性对照样品理论含量=1.299×103μg·g-1(掺入的西洋参拟人参皂苷F11含量)×西洋参掺入比例×12.5%(处方量100 g/800 g)。结果掺入不同比例西洋参样品中拟人参皂苷F11的平均转移率为48.67%。

表5 不同掺伪比例样品中拟人参皂苷F11 的含量(μg·g-1)
以西洋参掺入比例为横坐标(X),测得的拟人参皂苷F11的含量(μg·g-1)为纵坐标(Y),得到线性方程Y=7.697×101X+5.137×10-3(r=0.997 9),其相关性系数良好,表明西洋参掺入的量跟拟人参皂苷F11的含量呈正相关性。
3.2 掺伪限度拟定
参照已颁布的其他含人参制剂的西洋参检查补充检验方法中判定检出的依据,考虑实际生产中非主观原因的混入,同时模拟掺伪阳性对照样品制备过程中转移率较大生产高,拟将限度适当放宽,以男宝胶囊中掺西洋参比例大于10%时判定为检出西洋参,超过拟定限度。
课题组对自行收集的西洋参饮片3 批、西洋参粉1 批、西洋参对照药材1 批进行拟人参皂苷F11含量测定,结果见表6。

表6 自行收集西洋参中拟人参皂苷F11 的含量
由“3.1”可知,拟人参皂苷F11的平均转移率为48.67%,结合上述5 批次拟人参皂苷F11的平均含量,计算得男宝胶囊中拟人参皂苷F11应不得超过7.897 μg·g-1(1.298 × 103μg·g-1× 12.5% × 10% ×48.67%),即制备的相应供试品溶液中拟人参皂苷F11浓度为9.48 ng·mL-1。
为便于操作及判断,根据上述限量折算配制相应浓度(10 ng·mL-1)的对照品溶液(相当于男宝胶囊样品中拟人参皂苷F11含量为8.3 μg·g-1),规定供试品溶液的色谱峰面积值大于该浓度的对照品溶液中相应的峰面积值,视为检出西洋参,超过拟定限度。
3.3 判定原则
为简便生产企业的质量控制和监管,节约资源。人参的质量控制在原料执行《中国药典》2020 年版中规定的人参皂苷Rg1、Re、Rb1含量的基础上,额外增加成药单项检测拟人参皂苷F11即可。故在判定检出西洋参超过拟定限度原则时,未对人参皂苷Rf 含量进行限定,仅对拟人参皂苷F11进行了详细要求。
判定原则主要为三种情况:①供试品溶液的提取离子流色谱中,未同时出现与拟人参皂苷F11对照品溶液(10 ng·mL-1)色谱相应的色谱峰,视为未检出西洋参;②供试品溶液的提取离子流色谱中,同时出现与拟人参皂苷F11对照品溶液(10 ng·mL-1)色谱相应的色谱峰,但供试品色谱中m/z 799.6→653.6 的色谱峰峰面积值不大于拟人参皂苷F11对照品溶液(10 ng·mL-1)相应的峰面积值,视为未检出西洋参,未超过拟定限度;③供试品溶液的提取离子流色谱中,同时出现与拟人参皂苷F11对照品溶液(10 ng·mL-1)色谱相应的色谱峰,且供试品色谱中m/z 799.6→653.6 的色谱峰峰面积值大于拟人参皂苷F11对照品溶液相应的峰面积值,视为检出西洋参,超过拟定限度。
4 结果与分析
4.1 结果判定
72 批次男宝胶囊样品中拟人参皂苷F11,有1批次样品低于检测限,其余71 批次含量范围为0.072~43.260 μg·g-1,人参皂苷Rf 5 批次样品低于检测限,67 批次含量范围为1.070~34.788 μg·g-1。根据“3.2”项下的限度,有22 批次样品拟人参皂苷F11含量大于8.3 μg·g-1,检出西洋参,超过拟定限度,问题样品批次占比为30.56%。
4.2 含量测定结果分析
72 批次样品结果数据繁杂,不便于结果直观分析。故将不同生产企业分组绘制含量测定直方图,以含量测定的结果(μg·g-1)为纵坐标(详见图2)。为了更直观清晰地表述,将人参皂苷Rf 含量用正轴半轴表示,拟人参皂苷F11含量用负半轴表示,图中低于检测限的均视为0。从直方图可见生产企业S7不仅人参皂苷Rf 含量极低,而且拟人参皂苷F11含量异常高,表明整体人参原料质量控制较差。生产企业S1、S4、S3 和S5 的人参质量控制相对较好,人参皂苷Rf含量远远高于拟人参皂苷F11含量,同时人参皂苷F11含量极低。

图2 含量测定直方图
5 讨论
人参与西洋参为同科同属药材,外观性状与组织结构相似,容易混淆,且西洋参生长周期较人参短,种植成本低。而现行标准中多以两者共有成分人参皂苷Rg1、Re、Rb1来进行质量控制,因此存在使用西洋参掺人参进行投料的风险。拟人参皂苷F11和人参皂苷Rf是一对同分异构体,文献研究表明拟人参皂苷F11为西洋参中特征成分,人参皂苷Rf 为人参特征成分,可作为非法投料使用的检验依据[9,10]。近年来人参中掺西洋参投料是中成药质量控制研究的热点,特别是人参生粉入药的相关中成药研究已较为完备。然而男宝胶囊此类人参需提取入药,组方复杂,生产企业多的中成药相关研究较少[7,8]。
由于诸多原因未能制定男宝胶囊中人参皂苷Rf的限度,客观原因是现行的人参制剂标准中未有关于人参皂苷Rf限度可以参考,同时生产企业配合度相对不高,制定限度欲望低;主观原因是实验室制备小样所用的原药材质量佳,提取效率高,可能会导致人参皂苷Rf限度拟定过高,质量标志成分的限度仍需多批次中试和大试样品的验证。人参皂苷Rf的限度拟定欲在后期研究中进一步完善。目前本着简便高效、节约资源的原则,课题组相信生产企业在原料人参执行《中国药典》2020 年版中规定的人参皂苷Rg1、Re、Rb1含量的基础上,额外增加成药单项检测拟人参皂苷F11即可控制男宝胶囊中人参的质量。
通过上述试验,发现男宝胶囊部分生产企业存在人参中掺西洋参投料的迹象,提示生产企业需加强风险质量管理意识,课题组已向国家药品监督管理局建议对相关制剂的投料情况进行专项整治检查。本试验旨在通过建立男宝胶囊中拟人参皂苷F11限量检查方法,为生产企业产品质量控制提供参考,巩固国家监管部门及社会群体对中成药掺伪的监管,保障中药质量安全。

