食物中添加葡萄糖对斑翅果蝇发育与肠道细菌群落结构的影响
高欢欢, 赵 猛, 刘 利, 龙诗颖, 张安盛, 周仙红, 庄乾营,*
(1. 山东省农业科学院植物保护研究所, 济南 250100; 2.山东省葡萄研究院, 济南 250100;3. 滕州市植保检疫站, 滕州 277599)
斑翅果蝇Drosophilasuzukii隶属双翅目(Diptera)果蝇科(Drosophilidae)果蝇属Drosophila,分布广泛,偏好于取食刚刚成熟的新鲜水果(Goodhueetal., 2011; Milanetal., 2012)。寄主多达60余种,如樱桃、草莓、蓝莓、黑莓、葡萄及油桃等,可造成大量减产,严重时甚至绝收,2013年被列入检验检疫名单,成为全球关注的重要害虫之一。与斑翅果蝇生态位不同的是,黑腹果蝇Drosophilamelanogaster以成熟后期的腐烂水果为食,属于腐生型果蝇。腐烂水果中的微生物性蛋白质含量丰富(Becheretal., 2012),可为腐生性果蝇提供足够的营养物质。但新鲜水果中糖类和其他碳水化合物较多,蛋白质和氨基酸则相对缺乏,斑翅果蝇需要降解新鲜水果中大量的糖类物质,以满足自身的营养需求。斑翅果蝇对于糖含量高的水果具有较强的适应性,而腐烂水果发酵后乙醇和乙酸含量较高,斑翅果蝇对其耐受性远低于黑腹果蝇(高欢欢等, 2018; Gaoetal., 2018)。在新鲜的樱桃、草莓、葡萄、苹果和番茄 5 种寄主水果中,斑翅果蝇在含糖量高且果皮硬度低的樱桃和草莓上产卵量最高(骆亚琴等, 2015)。斑翅果蝇对同种水果不同品种的产卵选择性也与寄主中糖类物质正相关(Liuetal., 2019; 高欢欢等, 2020)。因此,斑翅果蝇自身一定存在相应的代谢机制以适应高糖低蛋白的生态位,其适生性机制将成为其成灾机制研究中的关键问题之一。
昆虫肠道中的共生菌可参与寄主的能量与代谢的平衡,为宿主昆虫的生长发育和繁殖提供所需要的营养成分,弥补昆虫自身代谢的缺陷(Douglas, 2009)。例如,黑腹果蝇肠道内较为稳定的微生物包括酿酒酵母Saccharomycescerevisiae(DSM1333)、植物乳杆菌Lactobacillusplantarum(DSM-20174)和醋酸菌Acetobactermalorum,在饲料中添加这些肠道微生物可显著提高其产卵量、取食量以及体重(Qiaoetal., 2019)。肠道内的醋酸菌Acetobacterpomorum可以通过胰岛素/胰岛素样生长因子信号通路(insulin/IGF-1 signaling pathway, IIS)提高黑腹果蝇体内乙醇脱氢酶的活性,以适应酒精含量升高的腐烂水果(Shinetal., 2011)。已有研究证明,肠道菌可参与寄主昆虫的糖类代谢,例如,Rhynchophorusferrugineus肠道中的克雷伯氏菌Klebsiellasp.、沙雷氏杆菌Serratiasp.、肠杆菌Enterobactersp.和柠檬酸杆菌Citrobactersp.均能调控糖苷水解酶基因的表达,从而降解植物中的纤维素、蔗糖和淀粉等多糖类物质,调节寄主体内蛋白和葡萄糖的代谢 (Jiaet
al., 2013; Muhammadetal., 2017; Habinezaetal., 2019)。黑腹果蝇肠道内的共生菌可参与寄主体内的维生素合成以及脂类物质、糖原、葡萄糖、蔗糖等物质的代谢(Ridleyetal., 2012; Newell and Douglas, 2014; Douglas, 2017)。去除肠道菌的黑腹果蝇表现出寿命延长、体内葡萄糖和甘油三酯含量升高的现象,但重新定殖肠道微生物后,其糖代谢恢复到了正常果蝇的水平(Newell and Douglas, 2014; Huang and Douglas, 2015; Liuetal., 2021)。
斑翅果蝇肠道共生菌对其生长发育同样具有重要的促进作用,去除肠道微生物后,斑翅果蝇的卵孵化率、幼虫体重、化蛹率及3龄幼虫体内蛋白质含量均明显下降(高欢欢等, 2020)。Bing等(2018)和Lin等(2021)对野外及人工饲料饲养的斑翅果蝇肠道微生物多样性分别进行了研究,说明斑翅果蝇在取食草莓及蓝莓等新鲜水果时需要肠道微生物才可以生存,但斑翅果蝇的肠道微生物是否调控寄主的糖代谢并没有相关的报道。因此本研究通过在食物中添加糖类物质,对斑翅果蝇的肠道细菌进行多样性分析,旨在寻找与糖类代谢相关的细菌类群,为研究斑翅果蝇适应高糖低蛋白环境的代谢机制提供重要的依据。
1 材料与方法
1.1 斑翅果蝇
斑翅果蝇实验室种群饲养于温度(25±0.5) ℃、相对湿度70%±0.5%和光周期16L∶8D的人工气候室中。饲喂以香蕉、苹果、玉米粉、葡萄糖和酵母为主要成分的常规饲料(饲料配方见表1,以蒸馏水定容)。此为斑翅果蝇常规饲养品系。

表1 本研究使用的斑翅果蝇人工饲料配方Table 1 Formulation of artificial diets of Drosophila suzukii used in this study
参考高欢欢等(2020)的方法,斑翅果蝇产卵后,收集6-8 h内的卵,无菌水清洗卵表面后,用3.0%次氯酸钠消毒1 min,70%乙醇消毒2次,1 min/次,含0.1% Triton X-100的磷酸缓冲液(pH 7)清洗1次,用无菌水再次清洗后,将卵转移到灭菌后的果蝇人工饲料上,放置于无菌的果蝇管(直径2.4 cm,高9.5 cm)中,于培养箱中培养,建立无菌斑翅果蝇品系。
收集无菌斑翅果蝇体系的卵、幼虫、蛹和成虫各30 mg分别研磨,分别稀释10和100倍后,取200 μL在NA培养基品平板上涂板,在相同条件的培养箱中培养48 h后,观察无菌落生长便可判断无菌果蝇品系创建成功。
1.2 果蝇的存活率测定
将葡萄糖添加至人工饲料中,浓度设置为5%和10%,以未添加葡萄糖的人工饲料为对照(表1)。高压灭菌后在超净工作台中分别转移至无菌果蝇管(直径2.4 cm,高9.5 cm)中备用。分别从斑翅果蝇无菌品系和常规饲养品系中挑取斑翅果蝇6-8 h的卵50粒,放入不同葡萄糖浓度的果蝇管中,每管放1粒卵。分别统计各处理中3龄幼虫的数量及羽化成为成虫的数量。每个处理重复3次。
1.3 果蝇体内葡萄糖含量测定
在不同浓度葡萄糖处理的斑翅果蝇无菌品系和常规饲养品系中,各挑取大约1.0 g 3龄幼虫和羽化后4-5 d的成虫,在冰上研磨,根据葡萄糖含量测定试剂盒(A154-1-1,南京建成生物工程研究所)的说明书进行操作,加入相应体积的提取液,经过离心、加入反应液、温浴等步骤后用酶标仪(EMax Plus, Molecular Devices, 上海)进行测定,波长分别为505 nm,每个样品测定3次作为技术重复,取其平均值为每个生物学重复的值,根据试剂盒中的公式计算物质含量。每个斑翅果蝇品系设3个生物学重复。
1.4 肠道细菌多样性分析
1.4.1肠道样品收集和解剖:收集不同浓度葡萄糖处理常规饲养品系的成虫(羽化后4-5 d),雌雄分开后在冰上冷却麻醉。用70%酒精消毒90 s后,无菌水清洗两次,每次1 min。利用体视显微镜(SZX2-ILLB, Olympus, Hatagaya, 日本)在PBS缓冲液(0.2 mol/L, pH 7.2)中解剖斑翅果蝇,取出肠道后放入1.5 mL无菌离心管中,液氮速冻保存于-80 ℃备用,每个处理解剖500头左右的斑翅果蝇成虫的肠道作为样本,雌雄分开,分别设置3个生物学重复。
1.4.2DNA抽提、PCR扩增和PacBio三代测序:将上述肠道样品按照昆虫NDA提取试剂盒(OMEGA, 美国)说明书提取DNA,并根据MoBio PowerSoil Kit试剂盒的说明书进行纯化。将纯化后的高质量DNA用无菌水稀释至1 ng/μL后,对16S rDNA的全长序列进行三代扩增子测序。使用2%琼脂糖凝胶电泳检测PCR产物,对目的条带使用Qiagen公司提供的胶回收试剂盒回收产物。
利用SMRTbellTMTemplate Prep Kit (PacBio)构建SMRT Bell文库,并通过Qubit 2.0 Fluorometer (Thermo Scientific)和Agilent Bioanalyzer 2100 System检测文库质量和插入片段大小,随后用PacBio平台进行测序。用cutadapt软件(Version 1.2.1, https:∥pypi.org/project/cutadapt/1.2.1/)、PEAR软件(Version 0.9.6, https:∥cme.h-its.org/exelixis/web/software/pear/)和PRINSEQ软件(Version 0.20.4, http:∥prinseq.sourceforge.net/)剔除接头序列、引物序列、嵌合体和低质量序列后,获得高质量的序列数据。原始读段(raw reads)上传至国家微生物科学数据中心(National Microbiology Data Center, NMDC)数据库(CRA008396)。
1.4.3α多样性和β多样性分析:根据可操作分类单元(operational taxonomic unit, OUT)丰富度,使用Qiime软件(Version 1.9.1)计算Shannon-Wiener, Simpson, Chao 1和Ace指数用于分析各处理肠道细菌种群多样性和丰度。同时,基于weighted_unifrac 距离算法采用Vegan 2.5-3软件对不同样品的细菌群落进行主坐标分析(principal co-ordinates analysis, PCoA)。
1.4.4OUT聚类、菌群分类注释及功能预测:利用Uparse 软件(Uparse v7.0.1001,http:∥drive5.com/uparse/)对所有样品的全部有效读段(clean reads)进行聚类,默认以97%的一致性将序列聚类成为OTUs。用Mothur方法与SILVA(http:∥www.arb-silva.de/)的SSUrRNA数据库对OTUs代表序列进行物种注释(设定阈值为0.8~1.0)。分别在不同分类阶元统计各样本的肠道细菌群落组成。同时,将各样本中的OTUs代表序列利用微生物群落功能注释-FAPROTAX数据库进行功能预测。
1.5 数据分析
不同浓度葡萄糖糖处理下斑翅果蝇幼虫存活率、羽化率、体内葡萄糖含量、肠道菌群Shannon-Wiener指数、Simpson指数、Chao 1指数和Ace指数以及优势菌种相对丰度的差异均采用单因素方差分析(one-way ANOVA)和Tukey氏多重比较的方法进行分析,软件为SPSS 20.0。
2 结果
2.1 不同营养条件下斑翅果蝇的存活率
根据方差分析结果得知,葡萄糖浓度对无菌斑翅果蝇品系的幼虫存活率和成虫羽化率并没有显著影响(P>0.05)(图1: A, B)。对于常规饲养品系而言,与对照组相比,5%和10%葡萄糖处理组斑翅果蝇的幼虫存活率分别显著提高了60.44%和87.87%(P<0.05)(图1: A),5%葡萄糖处理组成虫羽化率显著提高了123.79%(P=0.021),而10%葡萄糖处理并没有对成虫羽化率产生显著影响(P>0.05)(图1: B)。由此说明无菌斑翅果蝇成虫无法利用葡萄糖,而斑翅果蝇共生菌可促进斑翅果蝇对高糖食物的利用,从而满足其生长发育的需求(图1)。
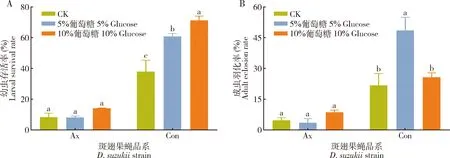
图1 不同浓度葡萄糖处理下斑翅果蝇无菌品系和常规饲养品系幼虫存活率(A)和成虫羽化率(B)Fig. 1 Larval survival rates (A) and adult eclosion rates (B) of microbiota-free and conventionally reared adults of Drosophila suzukii exposed to different concentrations of glucoseCK: 未添加葡萄糖的人工饲料Artificial diet without adding glucose; Ax: 斑翅果蝇无菌品系Microbiota-free D. suzukii; Con: 斑翅果蝇常规饲养品系Conventionally reared D. suzukii. 图2同。The same for Fig. 2. 柱上不同字母表示同一品系不同处理间经单因素方差分析以及Tukey氏多重比较差异显著(P<0.05)。Different letters above bars indicate significant difference among different treatments for the same strain by one-way ANOVA followed by Tukey’s multiple comparison test (P<0.05). 下图同。The same for the following figures.
2.2 不同营养条件下斑翅果蝇成虫体内的葡萄糖含量
随着葡萄糖浓度的增加,斑翅果蝇无菌品系(Ax)和常规饲养品系(Con)成虫体内的葡萄糖含量均显著增加(Ax:P<0.0001; Con:P<0.0001)。在对照条件(取食未添加葡萄糖的饲料)下,无菌品系和常规饲养品系成虫体内葡萄糖的含量分别仅为(3.40±0.37)和(3.80±0.30)mmol/L。5%和10%葡萄糖处理组中,与无菌品系相比,常规饲养品系成虫体内中的葡萄糖含量分别降低了39.16%和33.43%,证明无肠道共生菌的斑翅果蝇确实无法利用葡萄糖,其体内葡萄糖含量处于较高的水平,而肠道共生菌可促进斑翅果蝇体内葡萄糖的利用(图2)。

图2 不同浓度葡萄糖处理下斑翅果蝇无菌品系(Ax)和常规饲养品系(Con)成虫体内葡萄糖含量Fig. 2 Glucose contents in microbiota-free (Ax) and conventionally reared (Con) adults of Drosophila suzukii exposed to different concentrations of glucose
2.3 序列拼接与OTU聚类
通过对不同浓度葡萄糖处理的斑翅果蝇常规饲养品系成虫肠道细菌16S rDNA进行PacBio三代测序,发现不同葡萄糖浓度、不同性别的斑翅果蝇成虫肠道菌群测序所得的条带数和有效读段平均长度都有所差异(表2)。其中5%葡萄糖处理组斑翅果蝇雌成虫(G1f)样品得到的有效读段最多(27 435条),10%葡萄糖处理组斑翅果蝇雄成虫(G2m)样品的有效读段最少(22 280条)。 18个样品通过测序平均得到 30 550 对原始读段, 经拼接、 过滤后平均共产生26 015条有效读段,有效读段所占比例为84.84%。有效读段的平均长度并随着葡萄糖浓度的增加而增加,其范围为1 415~1 431 bp,但雌成虫和雄成虫间并没有明显差别。每个样品分别获得的OTU数量如表2所示,对比不同浓度葡萄糖处理下的斑翅果蝇来看,10%葡萄糖处理下的斑翅果蝇雄成虫(G2m)获得的OTU数量最多。

表2 不同浓度葡萄糖处理下的斑翅果蝇常规饲养品系成虫肠道细菌16S rDNA高通量测序基本信息Table 2 Basic information of high-throughput sequencing of 16S rDNA in the gut of conventionally rearedDrosophila suzukii adults exposed to different concentrations of glucose
2.4 不同浓度葡萄糖处理下斑翅果蝇成虫肠道细菌α多样性及β多样性
斑翅果蝇常规饲养品系成虫肠道细菌的α多样性分析结果(图3)表明:雌雄成虫肠道菌群的Shannon-Wiener指数在5%葡萄糖处理组与对照组之间并没有显著差异(P>0.05),在10%葡萄糖处理组中则显著增加(雄:P=0.018; 雌:P=0.001)。与对照组相比,5% 葡萄糖处理组雄成虫肠道菌群的Simpson指数显著降低(P<0.05),但雌成虫肠道菌群的Simpson指数没有显著变化(P>0.05),10%葡萄糖处理组雌雄成虫Simpson指数均显著提高(雄:P=0.028;雌:P=0.002)。斑翅果蝇雌成虫和雄成虫肠道菌群的Chao 1指数(雄:P=0.500; 雌:P=0.105)和雄成虫的Ace指数(P=0.324)并没有受到葡萄糖的显著影响,10%葡萄糖处理组中雌成虫的Ace指数显著提高(P=0.024)。由此可见,食物中添加葡萄糖可更多地影响斑翅果蝇雄成虫肠道菌群的多样性。

图3 不同浓度葡萄糖处理下斑翅果蝇常规饲养品系成虫肠道细菌的α多样性Fig. 3 Alpha diversity of gut bacteria in conventionally reared Drosophila suzukii adults exposed to different concentrations of glucoseA: Shannon-Wiener指数Shannon-Wiener index; B; Simpson指数Simpson index; C: Chao 1指数Chao 1 index; D: Ace指数Ace index.
为了更直观地对不同处理的斑翅果蝇肠道细菌差异进行聚类分析,我们采用了PCoA分析(图4)。结果表明,葡萄糖的添加以及性别均可明显影响斑翅果蝇肠道细菌多样性,不同处理条件下的雌雄成虫肠道细菌间存在重叠。

图4 不同浓度葡萄糖处理下斑翅果蝇常规饲养品系成虫肠道细菌的主坐标分析(PCoA)图Fig. 4 Principal co-ordinates analysis (PCoA) plot of gut bacteria in conventionally reared Drosophila suzukii adults exposed to different concentrations of glucose样本名称同表2。下图同。The sample name was the same as in Table 2. The same for the following figures.
2.5 不同浓度葡萄糖处理下斑翅果蝇常规饲养品系肠道细菌的核心菌群
通过OTU聚类分析,将斑翅果蝇常规饲养品系不同比较组中的肠道细菌以属为分类阶元制作韦恩图(图5: A),并对核心菌群进行注释分析(图5: B),发现不同浓度葡萄糖处理组所有样品的核心菌群为24个OTU,主要为隶属于醋杆菌科的葡萄杆菌属Gluconobacter(10个)、醋杆菌属Acetobacter(5个)、Commensalibacter(1个)和2个隶属于醋杆菌科的未知菌属,共占据75%;其次为隶属于肠杆菌科的摩根氏菌属Morganella(1个)和普罗维登斯菌属Providencia(1个),隶属于链球菌科的和肠球菌属Enterococcus(1个)、乳球菌属Lactococcus(1个)和明串珠菌属Leuconostoc(1个),以及隶属于α变形菌纲(Alphaproteobacteria)的未知菌属(1个)等。

图5 斑翅果蝇常规饲养品系成虫不同比较组中肠道细菌的韦恩图(A)及核心可操作分类单元(OTU)数量(B)Fig. 5 Venn diagram (A) and core operational taxonomic unit (OTU) number (B) of gut bacteria in conventionally reared Drosophila suzukii adults in different comparison groups
2.6 不同浓度葡萄糖处理下斑翅果蝇成虫肠道细菌群落组成
斑翅果蝇常规饲养品系肠道样本在门、科、属和种4个分类阶元水平上的细菌群落组成情况如图6所示。在门分类阶元水平,斑翅果蝇肠道细菌主要有变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、 蓝细菌门 (Cyanobacteria) 及拟杆菌门 (Bacteroidetes)等。对照组和 5%葡萄糖处理组的斑翅果蝇雌雄成虫肠道优势菌群均是变形菌门,其相对丰度均在90%以上;10%葡萄糖处理组中厚壁菌门所占的比例有所上升(雌: 11.53%; 雄:10.96%),但仍以变形菌门为优势菌群(图6: A)。
在科分类阶元水平,斑翅果蝇常规饲养品系成虫肠道细菌主要有醋杆菌科(Acetobacteraceae)、链球菌科(Streptococcaceae)和肠杆菌科(Enterobacteriaceae)等。对照组和5%葡萄糖组的斑翅果蝇雌雄成虫肠道优势菌群均是醋杆菌科,其中5%葡萄糖处理组雌虫肠道中肠杆菌科细菌相对丰度达到11.09%,也成为了其优势菌群;10%葡萄糖处理组成虫的优势菌群是醋杆菌科 (雌: 63.94%;雄: 53.95%) 和肠杆菌科(雌: 16.34%; 雄: 29.78%)(图6: B)。
在属分类阶元水平,斑翅果蝇常规饲养品系成虫肠道细菌主要有葡萄杆菌属Gluconobacter、乳球菌属Lactococcus、摩根氏菌属Morganella、醋杆菌属Acetobacter、普罗维登斯菌属Providencia、金黄杆菌属Chryseobacterium和明串珠菌属Leuconostoc等(图6: C)。对照组斑翅果蝇的肠道优势菌群主要为葡萄杆菌属、醋杆菌属和金黄杆菌属,在雌雄成虫肠道中的总相对丰度分别为95.47%和94.36%,其中葡萄杆菌属的相对丰度均超过80%;随着葡萄糖浓度的增加,葡萄杆菌属在雌雄成虫肠道中的相对丰度不断下降,且在雄成虫中的相对丰度低于雌成虫中的,而优势菌群的种数明显增加;5%葡萄糖处理组雄虫肠道中的醋杆菌属相对丰度增加至28.38%,成为仅次于葡萄杆菌属(62.61%)的优势菌群;10%葡萄糖处理组成虫肠道中的优势菌群为葡萄杆菌属、摩根氏菌属、醋杆菌属、普罗维登斯菌属和明串珠菌属,其中雄成虫肠道中的摩根氏菌属相对丰度达到21.44%。
在种分类阶元水平,斑翅果蝇常规饲养品系成虫肠道细菌的优势菌种为乳酸乳球菌Lactococcuslactis、弗氏葡萄杆菌Gluconobacterfrateurii、醋杆菌A.thailandicus,A.malorum和A.persici、以及产碱普罗维斯登菌Providenciaalcalifaciens(图6: D)。对照组的优势种为弗氏葡萄杆菌,在雌雄成虫肠道中的相对丰度分别为31.57%和39.33%,5%葡萄糖处理组雄成虫肠道中弗氏葡萄杆菌和醋杆菌相对丰度均较高,分别为26.62%和25.32%,但雌成虫中没有较为明显的优势种,10%葡萄糖处理组的优势种为弗氏葡萄杆菌、醋杆菌和产碱普罗维斯登菌。
通过Tukey氏多重比较的方法对不同处理间前4种优势种的相对丰度进行差异显著性分析,如图7所示。随着葡萄糖浓度的增加,斑翅果蝇成虫肠道中乳酸乳球菌的相对丰度显著增加(雄:P=0.01;雌:P=0.037),且在雌成虫中的相对丰度明显高于在雄成虫中的(图7:A)。除了5%葡萄糖处理组雄成虫外,弗氏葡萄杆菌在其他处理斑翅果蝇肠道中的相对丰度均较高,添加5%葡萄糖显著降低了该菌的相对丰度(雄:P<0.001; 雌:P=0.002)(图7: B);雄成虫肠道中A.thailandicus的相对丰度并未受到葡萄糖浓度的影响,但在雌成虫中,与未添加葡萄糖人工饲料饲喂的对照相比,添加5%的葡萄糖显著增加了醋杆菌A.thailandicus的相对丰度(P<0.0001)(图7: C); 葡萄糖的添加显著增加了产碱普罗维斯登菌在雄成虫肠道中的相对丰度(P=0.042),但只有添加10%的葡萄糖可增加雌成虫中该菌的相对丰度(P=0.049)(图7: D)。

图7 不同浓度葡萄糖处理下前4种肠道细菌在斑翅果蝇常规饲养品系成虫肠道内的相对丰度Fig. 7 Relative abundance of top 4 bacterial species in the gut of conventionally reared Drosophila suzukii adults exposed to different concentrations of glucoseA: 乳酸乳球菌Lactococcus lactis; B: 弗氏葡萄杆菌Gluconobacter frateurii; C: 醋杆菌Acetobacter thailandicus; D: 产碱普罗维斯登菌Providencia alcalifaciens.
2.7 肠道共生菌功能预测
在未添加葡萄糖的人工饲料饲喂的对照组雌成虫和雄成虫肠道菌群中,可注释为化学异养作用和好氧-化学异养作用的OUTs总相对丰度分别为92.29%和95.50%,在人工饲料中添加5%葡萄糖后,可注释为化学异养作用和好氧-化学异养作用的OUTs总相对丰度在雌成虫中为92.75%,但在雄成虫中下降为79.45%,注释为发酵作用的OTUs的相对丰度在雌成虫和雄成虫中分别增加至2.08%和3.54%,同时在雄成虫中尿素分解作用以及人类疾病和动物疾病相关的OTUs相对丰度也有所增加(图8)。添加10%葡萄糖后,化学异养作用和好氧-化学异养作用相关的菌群数量继续降低,在雌成虫和雄成虫中分别占比56.70%和52.52%,而硝酸还原作用相关的菌群数量增加,在雌雄成虫肠道菌群中的比例分别增加至9.25%和2.44%,尿素分解作用相关的菌群在雌雄成虫肠道菌群中所占比例分别增加至19.91%和9.21%,发酵作用相关的菌群在雌雄成虫肠道菌群中所占比例分别增加至18.71%和8.51%(图8)。说明,斑翅果蝇肠道菌群可能通过发酵作用、硝酸还原作用和尿素分解作用参与宿主的糖代谢。

图8 不同浓度葡萄糖处理下斑翅果蝇常规饲养品系成虫肠道细菌功能分析Fig. 8 Functional analysis of gut bacteria of conventionally reared Drosophila suzukii adults exposed to different concentrations of glucose
3 讨论
本研究发现,添加适量的葡萄糖可提高斑翅果蝇的幼虫存活率和成虫羽化率,促进野生果蝇的生长,但去除肠道微生物的斑翅果蝇无法利用葡萄糖作为自身的碳源(图1)。Bing等(2018)也证明斑翅果蝇在取食草莓、蓝莓等新鲜水果时需要肠道微生物才可以生存,由此可见,肠道微生物对于果蝇的糖类代谢起到不可或缺的作用,而斑翅果蝇在糖类含量高而蛋白含量低的新鲜水果中,必然需要肠道微生物的辅助代谢作用。为了寻找与斑翅果蝇糖代谢相关的肠道菌群,我们通过设定不同的营养条件,对其肠道微生物多样性进行分析,发现斑翅果蝇的核心菌群主要为醋杆菌科的葡萄杆菌属、醋杆菌属和肠杆菌科的摩根氏菌属和普罗维登斯菌属(图5),这与前人的研究结果一致。Chandler等(2011)分析了14个果蝇物种的肠道微生物多样性,发现相对丰度较高的为肠杆菌科、醋杆菌科、乳杆菌科、肠球菌科。斑翅果蝇主要以醋杆菌科和肠杆菌科为其优势菌群(Martinez-Saudoetal., 2018),其中醋杆菌科中的醋酸菌属和葡萄杆菌属为斑翅果蝇和黑腹果蝇的核心菌群(Martinez-Saudoetal., 2017; Adairetal., 2018; Linetal., 2021)。
昆虫肠道微生物多样性与生长环境、营养条件、宿主发育阶段均密切相关(Colmanetal., 2012; Yunetal., 2014)。在取食高糖食物的昆虫肠道中通常以醋酸杆菌科细菌为主,主要包括葡萄杆菌属和醋杆菌属(Chouaiaetal., 2014),食物种类的不同会影响其多样性(Vacchinietal., 2016)。本研究中,斑翅果蝇取食葡萄糖后,醋杆菌属、普罗维登斯菌属和摩根氏菌属的相对丰度明显增加(图6和7)。目前已有多项研究证明了黑腹果蝇肠道菌群在糖原、葡萄糖和海藻糖等能量物质代谢中的作用(Douglasetal., 2017)。蜜蜂肠道中的副干酪乳杆菌Lactobacillusparacasei可以利用果糖、甘露糖、海藻糖、葡萄糖、半乳糖和乳糖等作为碳源(Zhangetal., 2021)。肠道微生物可促进黑腹果蝇对葡萄糖和甘油三酯的代谢,特别是醋杆菌科的细菌,可调节果蝇体内的胰岛素信号,以足够高的速率降解糖类物质从而减少脂质储存(Shinetal., 2011; Chastonetal., 2013; Huang and Douglas, 2015)。苹果醋酸杆菌A.malorum和A.orientalis均能促进黑腹果蝇幼虫的生长发育(李玉娟等, 2017; 王露等, 2021),我们的结果中,A.thailandicus,A.malorum和A.persici是斑翅果蝇肠道中3种相对丰度最高的醋酸菌,并且A.thailandicus的相对丰度在添加葡萄糖后显著增加(图6),因此该菌很有可能参与了斑翅果蝇的糖类代谢,其代谢机制需要通过创建无菌品系和回补肠道菌的方式进行进一步研究。也有一类肠道细菌直接降解植物中的多糖类物质,如蜜蜂体内的肠道菌群双歧杆菌Bifidobacterium和吉列菌Gilliamella可以将花粉中的半纤维素和果胶转化为短链脂肪酸(Zhengetal., 2017)。虽然黑腹果蝇肠道细菌也可将部分多糖类物质转化为短碳链脂肪酸,但这并不是果蝇获得能量的主要来源(Fischer, 2017; Kimetal., 2018)。另外我们还发现,肠杆菌科的普罗维登斯菌属和摩根氏菌属的相对丰度也会随着葡萄糖的添加而显著增加(图6),这两种菌可能也与斑翅果蝇的糖类代谢密切相关。
另外,肠道微生物也可以参与宿主蛋白质或者氨基酸的代谢,如黑腹果蝇的肠道菌群可以通过合成某些必需氨基酸或者通过把含氮废物回收为氨基酸的方式来提高果蝇生长发育所需的蛋白质营养(Yamadaetal., 2015)。肠道菌群中的各种细菌和酵母促进果蝇的蛋白质营养,尤其是雌性果蝇,这种相互作用有助于延长果蝇的寿命(Storellietal., 2011; Wongetal., 2014; Yamadaetal., 2015)。本研究对斑翅果蝇肠道菌群进行了功能预测,发现取食葡萄糖后的斑翅果蝇肠道细菌可更多地注释到发酵作用、硝酸还原作用和尿素分解等功能中(图8)。Bing等(2018)证明斑翅果蝇的肠道微生物[如乳酸菌属Lactobacillus、乳球菌属、丛毛单胞菌科(Comamonadaceae)和肠杆菌科(Enterobacteriaceae)]可为斑翅果蝇提供生长发育所需要的关键蛋白质。由此可见,本研究中在添加葡萄糖后,相对丰度有所增加的乳球菌属细菌对于斑翅果蝇体内蛋白质的代谢具有重要的作用,但具体代谢机制仍需要进一步的研究和验证。
斑翅果蝇作为全球重要的果树害虫之一,其对高糖低蛋白营养条件的适生性较强是其危害性极大的重要原因之一。因此,可在肠道微生物与宿主共生的角度,以本研究中所预测的与糖类代谢相关的肠道细菌为研究对象,对其在宿主代谢中的功能进行进一步的研究和验证,以期为研究斑翅果蝇的适生性机制,并寻找新的防治靶点提供重要的理论依据。

