芽孢杆菌的引入对褐飞虱微生物群和生长发育的影响
王渭霞, 朱廷恒, 赖凤香, 魏 琪, 万品俊, 何佳春, 傅 强,*
(1. 中国水稻研究所, 水稻生物育种全国重点实验室, 杭州 311401; 2. 浙江工业大学生物工程学院, 杭州 310014)
绝大多数昆虫体内都含有共生细菌,参与和调控宿主昆虫的生长发育、营养代谢、生殖、抵御不良环境等基本生命过程,是宿主昆虫不可或缺的“重要器官”(Razaetal., 2020; 王渭霞等, 2021)。研究昆虫共生微生物不仅利于了解昆虫-植物协同进化和互作关系,也有助于开发利用昆虫资源和害虫防治。然而,大部分的共生菌只能生活于昆虫体内,不能独立生存,难以离体培养。近年来,随着转录组学、蛋白组学和基因组学等的进步和发展,促进了昆虫与共生菌共生机制的研究,为从微观角度研究昆虫种群形成和扩散提供了便利(杨义婷等, 2014)。传统微生物分离和培养是最为直观的方法,采用此法,人们从家蚕、蜜蜂和果蝇等昆虫肠道分离培养出了多种微生物(Douglas, 2015),为进一步研究功能奠定了基础。
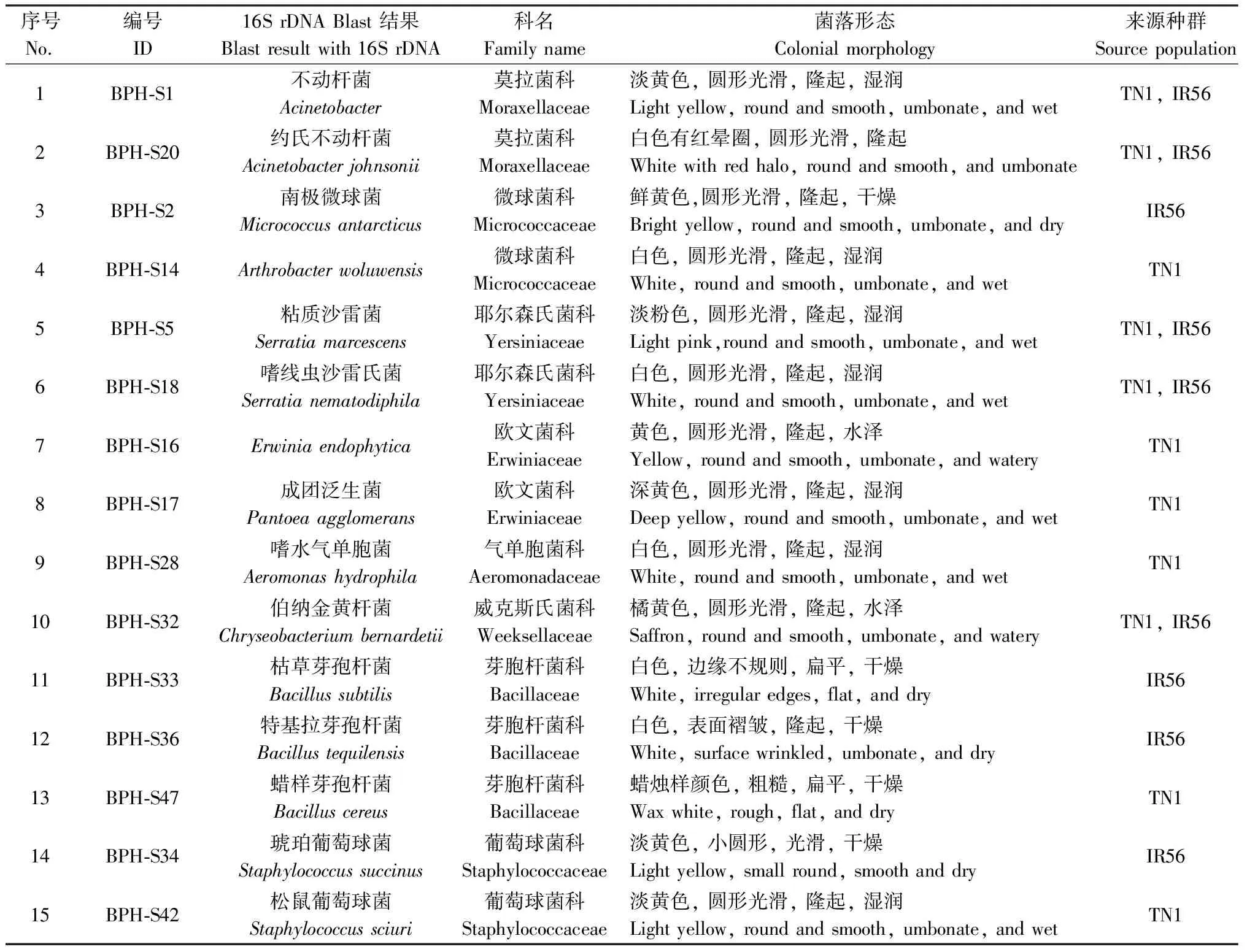
表1 本研究从褐飞虱中分离的共生菌编号、科名、菌落形态和来源种群Table 1 ID, family name, colonial morphology and source population of symbionts isolatedfrom Nilaparvata lugens in this study
褐飞虱Nilaparvatalugens是一种取食水稻韧皮部汁液的寡食性水稻害虫,具有繁殖力强、致害性易变化、远距离迁飞和传播病毒等特征,是我国和许多亚洲国家当前水稻上的首要害虫。当虫量大、受害重时可引起稻株失水枯死,导致严重的减产或失收(Bottrell and Schoenly, 2012)。褐飞虱体内共生微生物与其致害性变化和抗药性形成的相关性研究也有一些零星的报道。其中类酵母共生菌(yeast-like symbiont, YLS)参与了尿素循环,为褐飞虱提供不平衡食物中所缺乏的营养物质(王国超等, 2005; Xueetal., 2014; Bao and Zhang, 2019)。褐飞虱共生解脂假丝酵母Yarrowialipolytica和Arsenophonus与对吡虫啉的抗性有关(李娜等, 2010, 2011; Pangetal., 2018)。不动杆菌Acinetobactersoli和粘质沙雷氏菌Serratiamarcescens可诱导水稻合成稻壳酮、抗毒素等防御物质,参与调控水稻的防御反应(Warietal., 2019a, 2019b)。这些研究表明褐飞虱体内共生菌与其致害性以及对杀虫剂的抗性密切相关。
由于共生菌的离体培养以及无菌褐飞虱的实验材料不易获得,无法为其功能研究提供直接的证据。本研究利用离体培养法从褐飞虱两种不同致害性种群中获得了9个属的15株不同的共生细菌;从利用原位杂交技术分析了其在褐飞虱体内的分布;通过饲喂和显微注射的方式回补添加共生芽孢杆菌考察其功能,为研究共生菌-褐飞虱-水稻互作提供了直接的证据。
1 材料与方法
1.1 虫源和水稻
2010年从浙江富阳中国水稻研究所试验田收集褐飞虱种群分别饲养于感虫水稻台中1号(TN1)和含有bph3基因的抗性水稻IR56上。饲养条件为温度(27±2) ℃和光周期16L∶8D。连续饲养130代后获得两个稳定的实验室种群TN1和IR56种群。
1.2 共生菌的分离和特性分析
分别取TN1和IR56种群不同龄期的褐飞虱混合样本共计50头,每个龄期(包括初羽化雌雄成虫)约5~7头,75%酒精中处理10 min,用无菌水清洗3次,每次5 min。在0.8%无菌生理盐水中将样本研磨,匀浆液在7 000 r/min离心5 min。上清稀释不同倍数后,取100 μL涂布于LB固体培养基上,37 ℃过夜培养。选取形态以及颜色不一样的菌落扩大培养于4 mL LB培养基中,37 ℃ 200 r/min培养9 h后,取500 μL与等体积50%灭菌甘油混合后,-80 ℃保存,剩余菌液7 000 r/min离心5 min,利用细菌基因组DNA提取试剂盒(DP302-02, 天根生物技术有限公司)提取基因组DNA,利用16S rDNA通用引物27F: 5′-AGAGTTTGATCCTGGCTC AG-3′; 1492R: 5′-TACGGCTACCTTGTTACGACTT-3′进行PCR扩增,扩增产物回收后送浙江尚亚生物科技有限公司进行16S rDNA测序。获得序列在NCBI中进行比对和分类定位。利用Mega 7.0基于邻接法对分离获得的共生菌以及NCBI库中其他细菌的16S rDNA序列进行聚类分析。
LB培养基中分别添加终浓度为氨苄青霉素100 mg/L,四环素50 mg/L,链霉素100 mg/L,利福平50 mg/L和卡那霉素50 mg/L的抗生素,划线接种不同共生细菌,37 ℃培养24 h观察共生菌的生长。
从平板上挑取单个菌落接种于4 mL LB液体培养基中, 37 ℃ 200 r/min振荡培养。分别在培养3和6 h后取500 μL菌液测定OD600值,并稀释103和106倍后,取100 μL涂布于LB固体培养基,过夜培养,统计平板菌落数即cfu/mL。cfu/mL是菌落形成单位,表示每毫升含有细菌群落的总数。
1.3 共生菌的分布
以培养所得的BPH-S36的共生细菌DNA为模板,用16S-338F: 5′-ACTCCTACGGGAGGCAGCAG-3′和16S-806R: 5′-GGACTACHVGGGTWTCTAAT-3′为引物扩增16S rDNA的V3-V4区。扩增产物经回收后,测定浓度,依据PCR-Dig Labelling Kit试剂盒说明对模板DNA进行地高辛标记。以地高辛标记的DNA探针与组织中的RNA杂交。
显微镜下分离褐飞虱成虫不同组织包括唾液腺、肠道、雌虫内生殖器、雄虫内生殖器等,利用多聚甲醛固定组织、结合地高辛标记的16S rDNA通用探针杂交和NBT/NBCT显色技术,根据生成的蓝色或紫蓝色反应确定共生菌的分布情况。结果显示,共生细菌在褐飞虱肠道(图3: A)、唾液腺(图3: B)、卵巢(图3: C)和卵(图3: D)中均有分布,在雄虫内生殖器中无明显分布(图3: E)。
探讨完翻转课堂的狭义和广义的定义之后,我们就可以把翻转课堂定义为由以下两部分组成的教育技术:课内的互动式小组学习活动和课后的以计算机为基础的个人辅导。形象的定义表述见图1。我们对这一定义进行了严格限制,排除了那些在课外活动中没有使用视频的研究设计。尽管翻转课堂的广义定义可能对我们有帮助,但如果定义过广,也就意味着单纯的课外布置阅读任务和课内讨论就构成了所谓的翻转课堂,这种误解也是我们所要避免的。
1.4 共生菌的抗生素减菌饲喂和芽孢杆菌的回补饲喂
将40头饥饿处理6 h的TN1种群2龄末若虫饲养于含利福平(50 mg/L)的人工饲料上饲养2 d,2 d后利用添加共生菌BPH-S36或BPH-S33的培养液(菌液浓度为OD600为0.8左右时,按50×稀释添加)的人工饲料继续饲养2 d。由于共生菌在人工饲料中的不断繁殖,期间需更换1次人工饲料。抗生素处理组为抗生素饲喂 2 d后用不含抗生素的人工饲料继续饲养2 d。对照为不添加抗生素的人工饲料持续饲养4 d, 2 d时更换1次饲料。4 d后将褐飞虱转接到苗龄为25-30 d的TN1水稻上,用笼罩罩住水稻。每个处理接30头虫。人工饲料的配制和饲养方法参照Fu等(2001)。分别在饲养第6 和10天时统计活虫数。每个处理3~4次生物学重复。
1.5 共生菌的饲喂和显微注射
苏州托克斯冲压设备有限公司是德国TOX PRESSOTECHNIK GmbH& CO.KG在中国的全资子公司,主要生产TOX气液增力缸、TOX电子压力机、TOX板件冲压连接技术及各类专用冲压设备和生产线,产品广泛应用于国内外汽车工业、家电工业和工业电器等行业。目前为止,该公司已在国内外销售了6 000多台套各式通用、专用冲压设备及专用生产线,成为TOX产品亚洲销售、生产基地。
1.6 褐飞虱DNA的提取和qPCR分析
利用Mega 7.0对分离获得的3株芽孢杆菌类共生菌以及NCBI库中其他芽孢杆菌类细菌的16S rDNA进行比较。以大肠杆菌Escherichiacoli为外群,用Mega 7.0软件包中的Maximum Composite Likelihood模型计算进化距离,用邻接法自展检验值(Bootstrap) 1 000次构建系统发育树。结果发现,源于IR56种群的两株共生菌(BPH-S33和BPH-S36)聚类在一个分枝上,而源于TN1种群的BPH-S47为另一分枝(图2)。
15株芽孢杆菌菌株在含利福平的培养基中均不能生长,而在含有四环素的培养基中均能正常生长。其中BPH-S36可在添加氨苄青霉素、链霉素、四环素的培养基上正常生长,而在添加利福平和卡那霉素的培养基上不能生长。BPH-S33仅在添加四环素的培养基上可正常生长。对这两株仅从IR56种群中获得的芽孢杆菌进一步开展了功能研究。在扩大培养至OD600为0.8时BPH-S33和BPH-S36的菌落数量分别为10.3×107和10.4×108cfu/mL。
1.7 数据分析
使用GraphPad Prism(版本8.0.0, GraphPad Software, www.graphpad.com)进行绘图,利用DPS统计软件进行单因素方差分析和t测验。
将40头饥饿处理6 h的TN1种群3龄若虫饲养于添加芽孢杆菌BPH-S36或BPH-S33菌液的人工饲料中饲养2 d。菌液浓度为OD600为0.8左右时按50×和100×稀释添加。期间更换人工饲料1次。2 d 后将其接到 IR56 水稻苗上; 利用显微注射法给褐飞虱TN1种群的3龄若虫注射用无菌水稀释50×和100×的菌液,每头虫注射0.1 μL。注射后褐飞虱集中饲养与TN1苗上恢复24 h。24 h挑取活虫接到苗龄为25-30 d的IR56水稻上,用笼罩罩住水稻。每笼接虫约40头。其中未处理的TN1种群若虫作为阴性对照,未处理的IR56种群若虫作为阳性对照。在IR56上饲养10 d后统计活虫数。并收取各处理不同重复的褐飞虱用于DNA提取。另取各处理雌若虫2头,研磨于600 μL无菌水中。分别稀释100和1 000倍后,取100 μL涂板于LB培养基,37 ℃培养24 h,统计各平板菌落数量。每个重复涂3个平板,每个处理3次生物学重复。
2 结果
2.1 褐飞虱可培养共生菌的分类地位和生物学特性分析
利用离体培养技术从褐飞虱两种种群中共获得15株菌株,包括不动杆菌属Acinetobacter、沙雷氏菌属Serratia、节杆菌属Arthrobacter、金黄杆菌属Chryseobacterium、微球菌属Micrococcus、葡萄球菌属Staphylococcus、气单胞菌属Aeromonas、欧文菌属Erwinia和泛菌属Pantoea等。其中从IR56种群中分离获得两株芽孢杆菌类共生菌BPH-S33和BPH-S36,TN1种群获得1株BPH-S47。所分离菌株的编号、菌落形态和16S rDNA序列blast一致性在98%以上的结果见表1。各种共生菌在LB培养基上的生长形态见图1。
3.培训需求预测分析的核心在于确认差距。其核心是通过对被培训者现有状况和理想状况的调查与分析,确定二者的差距,为确定是否需要培训及需要培训的内容提供依据。

图1 LB培养基上生长的分离于两种褐飞虱种群中的共生细菌Fig. 1 Symbiotic bacteria isolated from two different populations of Nilaparvata lugens grown on LB mediumA: BPH-S1; B: BPH-S2; C: BPH-S5; D: BPH-S14; E: BPH-S16; F: BPH-S17; G: BPH-S18; H:BPG-S20; I: BPH-S28; J: BPH-S32; K: H-S33; L: BPH-S34; M: BPH-S36; N: BPH-S42; O: BPH-S47. 菌种编号和菌落形态描述见表1。下同。See Table 1 for bacterial no. and description of colonial morphology. The same below.
褐飞虱DNA的提取和qPCR分析所用引物和方法均参照(Wang等, 2015)。
1.2.5 盆栽实验 种子在超净台中处理,用75%的酒精浸泡种子3 min,用无菌滤纸吸干,然后用1%的次氯酸钠浸泡3 min,用无菌滤纸吸干,用75%的酒精冲洗种子30 s,最后用无菌水冲洗3遍,用无菌滤纸吸干,待种子彻底干燥后,用发酵4 d的生防菌原液浸泡30 min[7]。

图2 应用邻接法构建的基于16S rDNA序列的褐飞虱芽孢杆菌类共生菌和其他芽孢杆菌的聚类分析Fig. 2 Cluster analysis of the Bacillus spp. from Nilaparvatalugens and other Bacillus sp. based on 16S rDNAsequence using neighbor-joining method标尺示每个核苷酸位置的替换率为0.02; 本研究获得的芽孢杆菌类共生菌以三角形标记。The scale bar indicates 0.02 substitutions per nucleotide position. The symbiotic Bacillus spp. isolated in this study are marked by triangle.
采用SPSS19.0的统计学软件对数据进行分析处理,计量资料以均数±标准差(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2.2 共生菌在褐飞虱体内的分布
共生菌分布的检测参照王渭霞等(2022)。显微镜下分离解剖褐飞虱成虫各组织置于4%多聚甲醛中,6 ℃固定16 h。经超声和蛋白酶K处理后,PBS缓冲液清洗。用杂交缓冲液清洗3次后,加入含有探针(终浓度为300 μg/L)的杂交液,37 ℃过夜杂交。吸出杂交液,清洗3次后,在偶联碱性磷酸酯酶的抗地高辛抗体溶液中孵育2 h。PBS清洗数次后,用BCIP/NBT显色剂对杂交后样本进行显色。甲醇除去背景色后,加入PBS并在显微镜下观察拍照。
5.劳动力流出严重。由于各个因素导致农村经济收入较低,年轻劳动力被迫外出他乡。有的父母为了子女的教育问题不得不带上自己的子女,甚至举家搬迁到条件较好的地区安家落户。因为劳动力的流出从而导致田地荒芜、消费流出、空巢老人,空巢子女等一系列问题。这一列问题导致了生产力的下降,从而影响了经济的发展。

图3 16S rDNA通用探针检测共生细菌在褐飞虱成虫组织中的原位杂交定位Fig. 3 Localization of symbiotic bacteria in adult tissues of Nilaparvata lugens by in situ hybridization with 16S rDNA universal probeA: 肠道Gut; B: 唾液腺Salivary gland; C: 卵巢和脂肪体Ovary and fat body; D: 卵Egg; E: 雄虫内生殖器Male internal genitalia.
2.3 抗生素处理和回补芽孢杆菌对褐飞虱存活率以及共生菌含量的影响
结果表明,饲喂抗生素后,褐飞虱若虫在TN1水稻上饲养3和6 d时的存活率分别为37.4%±6.0%和14.5%±4.0%,显著低于对照组(分别为85.0%±4.1%和76.3%±4.3%)。回补稀释50×的OD600为0.8时的芽孢杆菌菌株BPH-36(2.1×107cfu/mL)可显著提高褐飞虱在TN1水稻上3和6 d时的存活率,其存活率分别上升至66.7%±6.0%和63.3%±1.7%;回补稀释50×的OD600为0.8时的BPH-S33(2.1×106cfu/mL)可使存活率分别上升至64.5%±7.0%和52.5%±2.5%(图4)。研究结果提示,抗生素的处理可以显著降低褐飞虱的存活率,而芽孢杆菌的回补有助于恢复褐飞虱的存活率。
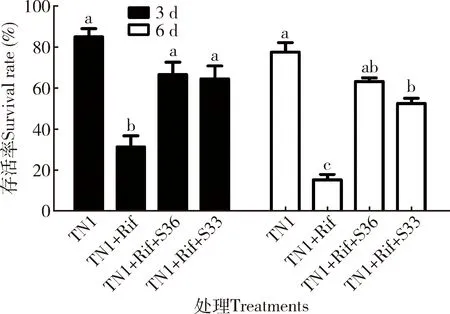
图4 芽孢杆菌的饲喂对抗生素利福平处理褐飞虱若虫存活率的影响Fig. 4 Effects of feeding with Bacillus spp. on the survival rate of Nilaparvata lugens nymphs after treatment with the antibiotic Rif3 d: 为褐飞虱在人工饲料饲养后转接至水稻饲养3 d时的若虫存活率Survival rate of nymphs when transferred to rice TN1 for 3 d after being fed on artificial diet; 6 d: 为褐飞虱在人工饲料饲养后转接至水稻TN1饲养6 d时的若虫存活率Survival rate of nymphs when transferred to rice TN1 for 6 d after being fed on artificial diet. TN1: TN1种群的若虫在人工饲料持续饲养4 d Nymphs of TN1 population were fed on artificial diet for 4 d; TN1+Rif: TN1种群若虫在添加利福平的人工饲料饲养2 d后用正常饲料继续饲养2 d Nymphs of TN1 population were fed on the artificial diet supplemented with Rif for 2 d and then fed on the normal diet for 2 d; TN1+Rif+S36: TN1种群若虫在添加利福平的人工饲料饲养2 d后,用添加BPH-S36菌液(OD600为0.8,50×稀释)的人工饲料继续饲养2 d Nymphs of TN1 population were fed on the artificial diet supplemented with Rif for 2 d, and then fed on the artificial diet supplemented with BPH-S36 bacterial suspension (OD600=0.8, diluted 50×) for 2 d]; TN1+Rif+S33: TN1种群若虫在添加利福平的人工饲料饲养2 d后,用添加BPH-S33菌液(OD600为0.8, 50×稀释)的人工饲料继续饲养2 d Nymphs of TN1 population were fed on the artificial diet supplemented with Rif for 2 d, and then fed on the artificial diet supplemented with BPH-S33 bacterial suspension (OD600=0.8, diluted 50×) for 2 d. 图5同。The same for Fig.5. 所有起始虫均为经6 h饥饿处理的TN1种群2龄末若虫。All the initial nymphs were the late 2nd instar nymphs of TN1 population and starved for 6 h. 柱上不同字母示经Tukey氏多重比较检验在0.05水平上有显著差异。图5和8(D)同。Different letters above bars indicate significant difference at the 0.05 level (Tukey’s multiple comparisons). The same for Figs.5 and 8(D).
取抗生素处理2 d和稻苗上饲养6 d的褐飞虱,提取DNA。利用qPCR方法分析不同样本中共生菌总相对丰度以及肠杆菌科、芽孢杆菌和YLS相对丰度。抗生素处理2 d可以使褐飞虱体内共生菌总相对丰度以及肠杆菌科和芽孢杆菌相对丰度分别显著降低77.3%, 73.8%和70.2%(共生菌:P=0.003; 肠杆菌科:P=0.004; 芽孢杆菌:P=0.013)(图5: A-C),但对YLS相对丰度无显著影响(P>0.05)(图5: D)。抗生素减菌处理2 d的褐飞虱回补饲喂含芽孢杆菌BPH-S33和BPH-S36的饲料2 d,并在稻株上饲养至6 d时,抗生素处理后共生菌BPH-S36和BPH-S33的回补饲喂没有显著增加共生菌总相对丰度和肠杆菌科相对丰度(图5: A, C)(P>0.05),但使芽孢杆菌相对丰度显著高于对照抗生素处理组(BPH-S36:P=0.001; BPH-S33:P=0.003)(增加了16~18倍)(图5: B)。

图5 抗生素和芽孢杆菌的饲喂对褐飞虱共生菌相对丰度的影响Fig. 5 Effects of feeding with antibiotic and Bacillus spp. on the relative abundance of symbionts in Nilaparvata lugensA: 共生菌总相对丰度Total relative abundance of symbionts; B: 芽孢杆菌相对丰度Relative abundance of Bacillus spp.; C: 肠杆菌科相对丰度Relative abundance of Enterobacteriaceae; D: YLS相对丰度Relative abundance of YLS. YLS: 类酵母共生菌Yeast-like symbiont. 图7和10同。The same for Figs. 7 and 10. 2 d: 样品取自于抗生素处理2 d的褐飞虱Sample was from N. lugens treated with antibiotic for 2 d; 6 d: 样品取自于水稻上饲养6 d的褐飞虱 Sample was from N. lugens raised on rice for 6 d.
2.4 芽孢杆菌的饲喂对褐飞虱致害力以及共生菌丰度的影响
上述实验表明芽孢杆菌BPH-S36和BPH-S33的回补对抗生素处理后褐飞虱的生长发育有利,实验进一步给敏感种群TN1额外添加该共生菌验证是否会提高其致害力。为此,将饥饿处理6 h的TN1种群的3龄若虫分别饲养在添加稀释50×和100×的共生菌BPH-S36和BPH-S33的人工饲料中,连续饲养2 d后转接至抗虫水稻IR56上。其中在正常饲料饲养2 d的TN1种群若虫作为阴性对照,饲养2 d的IR56种群若虫作为阳性对照。所有处理用饲料饲喂2 d后转至IR56水稻上继续饲养10 d后计算存活率。结果表明: IR56种群若虫在IR56水稻上的存活率(70.6%±4.2%)显著高于TN1种群的(52.1%±1.5%)(P=0.002)。BPH-S36的添加有助于提高褐飞虱TN1种群在IR56水稻上的存活率,用稀释50×和100×的BPH-S36菌液饲喂后其存活率显著提高(50×:P=0.023; 100×:P=0.046),分别达到64.2%±3.0% (P=0.023)和62.5%±2.6%(P=0.046)(图6)。BPH-S33的添加对TN1种群若虫在IR56水稻的存活率无显著提高作用(P>0.05)。
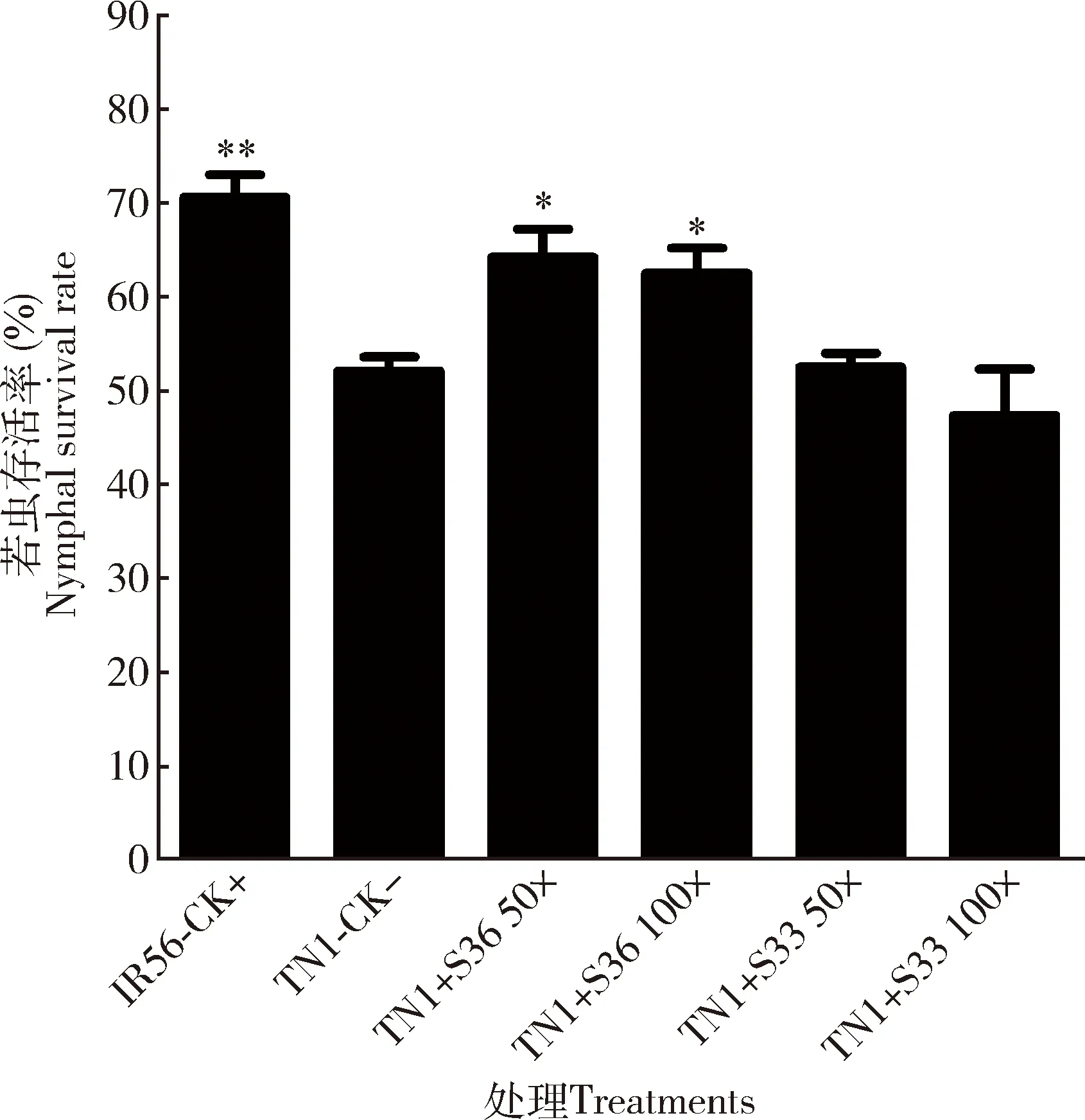
图6 芽孢杆菌的饲喂对褐飞虱TN1种群若虫在IR56水稻上存活率的影响Fig. 6 Effects of feeding with Bacillus spp. on the survival rate of nymphs from TN1 population of Nilaparvata lugens reared on IR56 riceTN1-CK-: 正常人工饲料饲喂的若虫,为阴性对照Nymphs fed on the normal artificial diet as the negative control; TN1+ S36 50×: 添加稀释50×的BPH-S36菌液的人工饲料饲喂的若虫Nymphs fed on the artificial diet added with BPH-S36 bacterial suspension in 50-fold dilution; TN1+ S36 100×: 添加稀释100×的BPH-S36菌液的人工饲料饲喂的若虫Nymphs fed on the artificial diet added with BPH-S36 bacterial suspension in 100-fold dilution; TN1+ S33 50×: 添加稀释50×的BPH-S33菌液的人工饲料饲喂的若虫Nymphs fed on the artificial diet added with BPH-S33 bacterial suspension in 50-fold dilution; TN1+ S33 100×: 稀释100×的BPH-S33菌液的人工饲料饲喂的若虫Nymphs fed on the artificial diet added with BPH-S33 bacterial suspension in 100-fold dilution; IR56-CK+: 饥饿6 h的IR56种群3龄若虫,作为阳性对照3rd instar nymphs from IR56 population starved for 6 h, as the positive control. 除阳性对照样品为饥饿处理6 h的IR56种群3龄若虫外,其余处理的虫源均为饥饿处理6 h的来源于TN1种群的3龄若虫。在不同的人工饲料上饲养2 d后转接在IR56水稻持续饲养10 d时统计存活率。每个重复的初始若虫数量为40头,每个处理重复3次。图中数据均为平均值±标准误;柱上星号和双星号分别表示与阴性对照相比在P<0.05和P<0.01水平上有显著和极显著差异(Student氏t检验)。The sample in the positive control was the 3rd instar nymph from IR56 population after 6 h starvation, while those in other treatments were the 3rd instar nymphs from TN1 population after 6 h starvation. After N. lugens nymphs were fed with different artificial diets for 2 d and then transferred to IR56 rice, the survival rate was calculated when reared for 10 d. The initial number of nymphs per repeat was 40 and each treatment was repeated for 3 times. Data in the figure are mean±SE. Asterisk and double asterisk above bars indicate significant difference (P<0.05) and extremely significant difference (P<0.01), respectively, from the negative control based on Student’s t-test. 图7同。The same for Fig.7.
“十一五”开始,我国以刚性约束手段对大气主要污染物实行总量控制,在全国范围内开展了SO2总量减排实践,“十二五”在SO2基础上增加了NOx减排指标,“十三五”已将大气环境质量改善目标作为减排考核中心[14]。而火电行业作为大气污染物的重点排放源,是总量控制重点监管的领域。2006年国家环保部颁布的《二氧化硫总量分配指导意见》中加强和规范了SO2总量分配的落实工作,按照区域和时段(《火电厂大气污染物排放标准》)划分,统一规定排放绩效值,将排放绩效引入电力行业的二氧化硫总量分配中,其中东部地区第Ⅲ时段机组SO2排放绩效为0.7 g/kWh,详见图1。
利用qPCR方法检测了BPH-S36和BPH-S33的饲喂对褐飞虱TN1种群若虫体内共生菌相对丰度的影响,结果发现:50×稀释的BPH-S36和BPH-S33的饲喂可使褐飞虱共生菌总相对丰度分别显著提高(24.6±0.7)和(7.3±0.0)倍(BPH-S36:P=0.014; BPH-S33:P=0.023)(图7: A),使芽孢杆菌相对丰度分别显著提高(23.2±33.0)和(24.5±2.6)倍(BPH-S36:P=0.0417; BPH-S33:P=0.0001)(图7: B),使肠杆菌科相对丰度分别提高(18.7±8.6)和(7.2±1.0)倍(BPH-S36:P=0.016; BPH-S33:P=0.001)(图7: C),使YLS相对丰度也分别显著上升(12.0±8.0)和(5.6±2.3)倍(BPH-S36:P=0.005; BPH-S33:P=0.027)(图7: D);而100×稀释的BPH-S36和BPH-S33的饲喂没有提高褐飞虱TN1种群若虫体内芽孢杆菌相对丰度(图7: B)。结果表明高浓度的芽孢杆菌的引入改变了褐飞虱体内共生微生物的相对丰度。

图7 芽孢杆菌的饲喂对褐飞虱TN1种群若虫中中共生菌丰度的影响Fig. 7 Effects of feeding with Baccillus spp. on the abundance of symbionts in nymphs of TN1 population of Nilaparvata lugens
利用LB梯度稀释培养的方法对源于TN1种群、IR56种群和饲喂共生芽孢杆菌后TN1种群雌成虫体内可培养共生菌进行了菌落数量的比较。结果发现IR56种群体内可培养共生菌的数量(6.4×105cfu/雌)要显著高于TN1种群体内的(2.7×105cfu/雌)(图8: A, D)。引入稀释50×和100×的BPH-S36后,可使褐飞虱雌成虫体内可培养共生菌的数量从2.7×105cfu/雌分别增加到11.5×105和6.0×105cfu/雌(图8: B, D)。而BPH-S33的引入未显著改变可培养共生菌的数量(图8: C, D)。
2.5 褐飞虱若虫显微注射芽孢杆菌对其致害力和共生菌丰度的影响
通过显微注射的方法,将不同含量的共生菌BPH-S36和BPH-S33注入褐飞虱TN1种群若虫体内。相当于每虫注射细菌数量BPH-S36为2.1×104或1.0×103cfu, BPH-S33为2.1×103或1.0×102cfu。统计5 d时的存活率,结果表明:IR56种群在IR56水稻上5 d时的若虫存活率(80.7%±0.7%)显著高于TN1种群若虫在IR56水稻上的存活率(57.3%±5.5%)(P=0.0162)。显微注射两种共生菌菌液后并没有显著提升TN1种群若虫在IR56水稻上的存活率(P>0.05)(图9)。qPCR检测结果表明,通过显微注射的方法BPHS36和BPH-S33对褐飞虱共生菌总相对丰度(图10: A)、芽孢杆菌相对丰度(图10: B)、肠杆菌科细菌相对丰度(图10: C)均没有显著影响(P>0.05),但高浓度芽孢杆菌BPH-S33的注射可使褐飞虱YLS相对丰度有显著的上升(P<0.05)(图10: D)。

图9 芽孢杆菌的显微注射对褐飞虱TN1种群若虫在IR56水稻上存活率的影响Fig. 9 Effects of microinjection of Bacillus spp. on the survival rate of nymphs from TN1 population of Nilaparvata lugens on IR56 riceIR56-CK+: IR56种群3龄若虫被注射水,作为阳性对照3rd instar nymphs from IR56 population injected with water, as the positive control; TN1-CK-: TN1种群3龄若虫被注射水,作为阴性对照3rd instar nymphs from TN1 population injected with water, as the negative control; TN1+S36 50×: TN1种群3龄若虫注射稀释50×的BPH-S36菌液3rd instar nymphs from TN1 population injected with BPH-S36 bacterial suspension in 50-fold dilution; TN1+ S36 100×: TN1种群3龄若虫注射稀释100×的BPH-S36菌液3rd instar nymphs from TN1 population injected with BPH-S36 bacterial suspension in 100-fold dilution; TN1+ S33 50×: TN1种群3龄若虫注射稀释50×的BPH-S33菌液3rd instar nymphs from TN1 population injected with BPH-S33 bacterial suspension in 50-fold dilution; TN1+ S33 100×: TN1种群3龄若虫注射稀释100×的BPH-S33菌液 3rd instar nymphs from TN1 population injected with BPH-S33 bacterial suspension in 100-fold dilution. 每个处理重复3次,每个重复40头。图中数据为平均值±标准误; 柱上双星号表示与阴性对照相比在P<0.01水平上有显著差异(Student氏t测验)。Each treatment has 3 replicates, each with 40 individuals. Data in the figure are mean±SE. Double asterisk above bars indicate significant difference (P<0.01) from the negative control based on Student’s t-test. 图10同。The same for Fig. 10.

图10 芽孢杆菌的显微注射对褐飞虱TN1种群共生菌丰度的影响Fig. 10 Effects of microinjection of Baccillus spp. on the abundance of symbionts in TN1 population of Nilipavata lugens芽孢杆菌注射后在IR56水稻上饲养5 d时的活若虫为采集样本。Samples were collected from live nymphs reared on IR56 rice for 5 d after injection of Baccillus spp.
3 讨论
从褐飞虱两种不同致害性种群中分离培养出9个属的15株不同共生细菌。以其中1株芽孢杆菌的DNA为模板合成探针用于检测以芽孢杆菌为主的共生细菌的分布,发现共生细菌在褐飞虱的唾液腺、脂肪体、肠道和雌虫生殖器中均有分布(图3),这与前人报道的结果(Zhangetal., 2018, 2019)一致。抗生素等的处理会使昆虫体内共生菌的丰度或组成发生变化,这种微生态的变化会进而影响其生存和繁殖(Zhangetal., 2020)。当褐飞虱取食喷施了丰加霉素、戊唑醇和中生霉素的水稻时,其死亡率分别达到35.5%, 33.1% 和 19.4%。不同抗生素处理对不同属的共生菌丰度的影响也不完全一致(Shietal., 2021; Songetal., 2021)。在蜜蜂中抗生素处理会对肠道微生物组的大小和组成产生持久影响,进而导致存活率的降低(Raymannetal., 2017)。我们通过人工饲料的方式给褐飞虱若虫饲喂抗生素利福平,发现其体内共生菌的总相对丰度显著降低,而对YLS相对丰度没有显著影响(图5);褐飞虱表现为若虫存活率下降(图4);通过饲喂回补共生细菌,发现共生芽孢杆菌有助于恢复抗生素处理后褐飞虱的存活率(图4)。这些结果直接证明了共生芽孢杆菌在褐飞虱生长发育中具有的重要作用。
费里斯州立大学西密歇根英语语言学院的强化英语课程分为初级(Beginning Level)、一级(Level 1)、二级(Level 2)和三级(Level 3),共四个水平等级。所有强化英语课程的新生在学期开始之前必须参加入学英语能力考试。学生将根据考试成绩分配到不同等级水平的班级。通过强化英语课程的学习,学生通过考试达到学院的语言要求可在下一学期转入专业学习。一般中国学生需要一至两个学期的时间达到专业学习的语言要求。学院还开设过渡期英语课程(Academic Bridge Course)。满足专业学院语言能力要求的学生可以同时选修强化语言课程与专业课程。
褐飞虱IR56种群具备较强的致害抗性水稻IR56的能力,能够在IR56上正常生长、发育和繁殖,可以通过若虫发育历期、初羽化雌雄虫体重、蜜露量以及成虫寿命、单雌产卵量等指标与敏感的TN1种群进行明显区分(郑瑜等, 2016)。通过饲喂的方式将源于褐飞虱致害性强的IR56种群体内的共生芽孢杆菌引入敏感种群TN1,不仅改变了TN1种群的共生菌的数量及组成,同时提高了敏感种群取食抗性水稻IR56的能力。本研究发现在TN1种群中饲喂引入稀释100× BPH-S36,在抗虫水稻IR56上饲养10 d后芽孢杆菌的数量未显著增加(图7: B),但其对IR56水稻的致害力却有显著增加(图6)。这种对抗性水稻致害力的变化可能源于共生芽孢杆菌的代谢产物,也可能源于共生芽孢杆菌与体内其他共生菌互作。有研究表明在褐飞虱中引入共生菌Cardinium后会提高中肠中不动杆菌属的相对密度,从而引起褐飞虱主要微生物功能的变化(Lietal., 2020)。本研究发现在TN1种群中饲喂引入稀释50× BPH-S36或50× BPH-S33,在抗虫水稻IR56上饲养10 d后qPCR检测显示芽孢杆菌、总共生菌、肠杆菌科以及YLS的相对丰度都有显著增加(图7)。我们推测,芽孢杆菌的增加引起的整个微生态的重塑和褐飞虱的转录组变化,进而导致了与抗性水稻IR56互作的变化,这有待进一步深入研究。有研究者通过显微胚胎注射的方式给褐飞虱成功引入了外源共生细菌Cardinium(Lietal., 2020)。本实验通过显微注射若虫的方法来引入外源共生菌,结果发现显微注射共生菌的方式不能够改变褐飞虱体内共生菌的丰度。
本研究从褐飞虱强致害性种群IR56中分离获得了两株芽孢杆菌,对褐飞虱致害能力的影响从目前数据看表现不完全一致,其中BPH-S36的增加可以提高TN1种群在IR56水稻上的存活率,而BPH-S33的增加并没有显著提升其在IR56水稻上的存活率(图6)。这可能与菌株差异有关,也有可能与引入密度不同有关。其中BPH-S33表现为菌落大、扁平,在培养至OD600同样浓度的时候,其细胞数量要远远少于BPH-S36。因此,在同样稀释倍数后的引入可能导致BPH-S33的数量不足以引起褐飞虱体内整个微生态平衡的重大重塑。定量PCR结果显示BPH-S33和BPH-S36的增加可使褐飞虱若虫体内共生细菌的总相对丰度,肠杆菌科和YLS的相对丰度发生显著上升(图7);同时BPH-S36的增加还可以显著提高褐飞虱若虫体内可培养共生菌的相对丰度(图8)。由此可见,两种不同的芽孢杆菌的引入对褐飞虱体内微生态的影响在丰度和种类方面有所不同。
目前,对褐飞虱共生菌的研究以YLS的研究居多,该菌的功能主要表现为提供必需氨基酸和尿素的循环。研究发现与取食感虫品种水稻TN1的褐飞虱相比,连续取食IR26(含Bph1抗性基因)二代后褐飞虱体内YLS丰度显著降低,第3代后虫体内共生菌丰度又有所回升(陈发军等, 2006)。Horgen和Ferrater(2017)的研究结果表明,YLS丰度的变化在褐飞虱的抗性水稻适应和宿主植物转换过程中几乎没有作用。本研究发现连续饲养百代以上适应了抗虫水稻IR56的种群(IR56种群)中YLS的丰度显著高于TN1种群,通过饲喂稀释50×的BPH-S36和BPH-S33后可使褐飞虱体内YLS的丰度也显著增加。高浓度芽孢杆菌的显微注入同样使YLS的丰度显著上升,但对IR56水稻的致害力的改变不尽一致。这表明YLS丰度的增加与褐飞虱对IR56水稻的致害力的增加之间无相关性。
本研究为进一步深入研究褐飞虱共生微生物的生理功能及其与宿主的互作机制、充分利用共生微生物来调控其生长发育提供参考。

