人工智能在乳腺癌影像诊断中的研究及应用进展
王贇霞,谭红娜
0 前言
2020年全球癌症统计数据报告显示[1],乳腺癌是目前造成女性癌症死亡最常见的原因之一,其发病率及死亡率逐年增长。在中国,乳腺癌占女性所有新发癌症的15%,发病率居于首位[2-3]。早期发现是提高乳腺癌患者生存率的关键,乳腺癌的早期诊断很大程度上依赖于影像学和病理学。目前,乳腺最常用的影像学检查方法包括超声、乳腺X 线和MRI。目前我国乳腺癌筛查体制的不完备,乳腺影像诊断专业医师缺乏,早期乳腺癌的整体诊断率偏低[4],且影像检查结果大多基于放射医师对病灶的征象评估,主观性较强,而病理学属于有创诊断,这均在一定程度上阻碍了无创精准诊疗的发展。近年来,随着机器学习(machine learning, ML)、卷积神经网络(Convolutional Neural Networks, CNN)等算法的开发应用,影像AI发展迎来了新的阶段,其应用于乳腺影像的研究也在持续深入。相关研究[5]表明这将在一定程度上提高早期乳腺癌的诊断效能,但乳腺影像人工智能(artificial intelligence, AI)研究同时面临诸多问题和挑战。本文就AI在乳腺影像诊断的应用及研究进展做一综述,旨在介绍该领域AI发展现状并试图分析当前面临的问题,以期推进乳腺癌AI 诊断技术的临床转化,为临床精准无创诊疗提供最佳影像辅助。
1 AI概述
“人工智能”一词最早出自于1956年达特茅斯学院研讨会上,后被广泛采用并被不断扩展。AI 是一个通用术语,它意味着使用计算机,以最小的人工干预来模拟人脑的思维逻辑、学习记忆和推理过程等,以此达到辅助人类思考、运算及反应的目的[6]。在AI影像领域,目前最具应用前景的是深度学习(deep learning, DL),DL无须预先定义影像特征,通过多层神经网络构建端到端的模型,自动利用价值信息实现对疾病的预测。其中用于图像分析的DL网络包括多层反馈循环神经网络(recurrent neural network,RNN)、CNN、深信度网络(deep belief networks, DBN)以及各自对应的改进模型,尤其以CNN在医学影像方面的研究及应用最为广泛[7-8]。此外,影像组学的临床应用也是近些年研究的热点。影像组学是从影像图像中提取高通量的定量特征,深层次挖掘能够反映病变特点的信息,通过创建和验证包含有高维数据集的模型,以此辅助临床决策[9-10]。而AI 技术则为影像组学提供多种ML 算法,在特征提取和模型创建的过程中发挥着重要作用。因此,影像组学可以看作是将影像定量分析与ML 算法相结合的产物,其与AI 技术存在差别但又紧密相关,二者结合能够有效推动影像诊断的智能化发展[11]。医学影像的AI 技术主要包括DL 和影像组学。其核心机制在于利用ML算法实现对图像的特征分析,建立图像特征与生物学信息之间的定量关系模型,以期实现对临床结局的自动识别和定量评估[12]。相比人工分析,AI 可以全面地利用海量数据间的关联,超越个体经验的限制,实现规范化和可重复的诊断或治疗方案设计。
2 AI技术在不同临床任务中的应用
2.1 AI技术在乳腺良恶性病变鉴别中的应用
2.1.1 AI 结合乳腺X 线摄影在识别恶性病变中的应用
乳腺X线摄影是最常用的乳腺癌筛查方法之一,尤其擅长检出钙化性病变。但其诊断性能易受腺体类型的影响,容易漏诊致密型腺体的非钙化病变。将AI 技术应用于乳腺X 线可大幅提高早期癌检出率[13-14]。早在1996 年,SAHINER 等[15]将DL 技术首次应用于乳腺X线以检出病变并进行良恶性分类,验证了AI 在乳腺X 线中的应用可行性。近年来随着乳腺X线DL 模型的不断发展,其对乳腺病变自动分类的性能有了显著提升。AL-MASNI 等[16]研发了一种新型乳腺X 线计算机辅助诊断(computer aided diagnosis,CAD)系统,即基于感兴趣区(region of interest,ROI)的深度CNN提取病灶特征,最后使用全连接神经网络对病灶进行良恶性分类,结果显示该系统鉴别良恶性的准确度为97.0%,识别肿块位置的总体准确度达到99.7%;该系统甚至适用于一些具有挑战性的病例,例如识别位于胸肌附近或腺体致密区域的病变。因此,AI技术应用于乳腺X线有助于提高早期癌的检出率,但检出致密型腺体病变的能力还需更多研究支持。
2.1.2 AI结合超声在评估乳腺恶性病变中的应用
超声具有便携、操作简单、无创等优点,是乳腺癌筛查的常用方法之一,相比于乳腺X 线摄影,超声更适合亚洲女性的致密型腺体。最近针对国内乳腺癌群体开发的深度神经网络模型SonoBreast(open.baai.ac.cn/sonobreast)在部分医院试用,结果显示其评估病灶恶性可能性较乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)更精确[17]。另有QI 等[18]建立了由专业乳腺外科医师和超声医师标注的大规模超声图像数据集(数量达8145),采用CNN 构建恶性肿瘤网络(malignant tumors-net, Mt-Net)和实性结节网络(solid nodules-net, Sn-Net)两个子网络,并引入新型区域增强机制及交叉训练算法来提高子网络间的协同性,研究结果显示该模型能够有效识别乳腺肿块的良恶性,且准确度与人类专家水平相当。ZHANG 等[19]则探索了B 型超声和剪切波弹性成像(shear wave elastography, SWE)基于DL 的影像组学方法的整合模型对乳腺肿块的鉴别性能,结果表明其分辨能力优于定量SWE 参数和BI-RADS 评估,该模型在外部验证集中的鉴别能力达到了较高的水平(AUC 为1.0)。但该研究纳入数据有限(仅291 例),故研究结果还需扩大数据集进一步验证。
2.1.3 AI结合MRI在乳腺良恶性病变鉴别中的应用
MRI 因软组织分辨率高,可多序列成像,在乳腺癌诊断中价值较大,鉴于动态对比增强MRI(dynamic-contrast enhanced MRI, DCE-MRI)可反映癌灶血流动力学等功能信息,AI 研究多基于此开展[20-21]。ZHOU 等[22]通过133 例病例的DCE-MRI 图像探索瘤内及瘤周组织,利用基于不同ROI的影像组学及DL 方法对鉴别良恶性病变的准确度进行比较,结果表明基于ResNet50 构建的DL 模型实现了较高的准确度(达91%),且与瘤内及不同范围的瘤周组织相比,包含近端瘤周组织的最小边界框构建的模型具有更高的准确性。该研究考虑到瘤内和不同范围瘤周区域的差异,证实了近端瘤周区域在鉴别乳腺良恶性病变中的价值。TRUHN 等[23]通过影像组学和CNN方法对447 例乳腺DCE-MRI 中增强病灶的良恶性进行预测,发现CNN 较影像组学预测效能更好(CNN 的AUC 为0.88,两种组学模型AUC 分别为0.81、0.78),但均低于放射医师的诊断水平(AUC为0.98),这可能与纳入患者的恶性占比较高有关。该研究还对小病灶的诊断效能进行了亚组分析,结果仍是CNN模型预测效能较好。HU 等[24]基于616 例多参数磁共振成像(multiparametric magnetic resonance imaging,mpMRI)开发了一种深度迁移学习CAD 来区分乳腺良恶性病变,并比较了三种在不同水平上整合序列(图像融合、特征融合和分类器融合)的诊断性能,结果显示特征融合方法较单独序列(DCE-MRI 及T2 序列)和其他融合方法诊断效能高(AUC 为0.87),基于mpMRI的DL模型可降低假阳性率从而提高诊断性能。
总之,近年来利用AI 技术无创鉴别乳腺良恶性病变的研究颇多,其鉴别能力和工作效率通常优于放射科医师,势必成为未来早期乳腺癌精准诊断的重要突破。此外,瘤周区域及影像多参数整合等对早期乳腺癌的诊断价值较大。目前临床应用的乳腺AI 系统主要基于X 线成像,国内外模型诊断效能相当,但真正落地应用仍较少,更多模型的临床转化还需不断地研究验证[5]。
2.2 AI技术在乳腺癌分类及分级中的应用
不同类型的乳腺癌在临床表现、治疗反应性和预后评估上存在差异。通过AI技术确定具体的乳腺癌病理类型也是目前研究的热点,有研究[25]发现在AI 算法的辅助下,浸润性乳腺癌是最容易被正确识别的病理类型,且在更大范围的ROI 下准确度更高,这可能解释为规模更大的ROI 具有更多的形态学特征,从而达到正确的分类。此外,组织学分级是乳腺癌一个成熟的临床指标,它反映肿瘤的形态和增殖信息,具有独特的预后意义。有研究[26]探索了DCE-MRI和DWI放射组学对组织学分级进行预测的能力,结果显示两种序列结合的多任务预测模型较单任务模型提高了性能,当进一步结合表观扩散系数后,多任务预测模型的AUC可达到0.816,具有较高的预测价值。也有研究[27]建立了基于T2W-MRI 的影像组学对浸润性乳腺癌的组织学分级进行术前预测的模型,并取得了不错的效果。该模型在训练集和验证集中的AUC分别达到了0.802和0.812。
应用AI技术对乳腺癌的病理类型及组织学分级的准确预测可以有效避免有创性手术,减少医疗消耗。但关于乳腺癌类型的预测多是基于AI 病理学,少有研究通过影像的深度学习或组学等AI技术预测乳腺癌病理类型,因此这也是未来研究需要关注的方向。此外,多参数模型对于乳腺癌组织学分级的预测效果更佳,但是关于AI 技术在乳腺癌分类及分级中的临床应用还有待更多研究推进。
2.3 AI 技术在乳腺癌生物标记物及分子亚型中的应用
人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)是乳腺癌的主要分子治疗靶点之一,乳腺癌中约20%~25% 呈HER-2 高表达,此类乳腺癌具有增生快、侵袭性强等特点[28],临床上主要通过曲妥珠单抗等抗HER-2 治疗来改善该类患者预后。因此准确判断HER-2 状态对靶向治疗和预后评估意义重大[29]。而常规病理检测HER-2 表达状态多因有创及穿刺范围小不能代表整体癌灶而存在局限性。近年来,利用影像组学和DL等AI 方法术前预测乳腺癌HER-2 状态的研究较多。ZHOU 等[30]通过研究306 例基于单参数和多参数乳腺MRI 的组学模型对HER-2 状态的预测能力,结果显示验证集中多参数模型的AUC达到了0.81,明显高于分别基于T2 序列和DCE-T1 序列的单参数模型(AUC 分别为0.70 和0.68),有望成为评估HER-2 状态的有效替代工具。XU 等[31]通过144 例乳腺超声图像建立了基于3 块DenseNet 的DL 模型,通过超声图像预测HER-2 表达,并将其与影像组学模型进行对比,结果显示DL模型在训练集(准确度为85.79%,AUC为0.87)和验证集(准确度为80.56%,AUC为0.84)中取得了较好的预测性能,有效性大大超过了影像组学和常规超声征象模型。此外,鉴于乳腺癌的高度异质性,多方位信息的整合对更精确预测HER-2状态有一定帮助,有研究显示组学特征结合临床危险因素指标时,对HER-2状态的预测效能有进一步的提高[32]。
依据乳腺癌分子分型进行个体化治疗已在临床实现共识,不同分子分型的乳腺癌在治疗和预后方面存在较大差异[33-34]。所以治疗前确定分子分型十分重要。基于大数据的AI技术辅助诊断分子分型是近年来的研究热点。LEITHNER 等[35]基于多参数MRI影像组学回顾性分析了91 例乳腺癌患者,发现该方法在鉴别三阴和非三阴型乳腺癌以及Luminal A 型和三阴型乳腺癌的AUC 分别为0.86 和0.80,准确度分别为0.852 和0.682。另有研究[36]建立了基于多中心大样本(训练集达2822)的超声图像DL 模型,对乳腺癌的3种分子亚型(包括三阴型、HER-2阳性和激素受体阳性)进行预测,结果显示DL模型具有较好的预测效能(AUC 依次为0.811、0.837 和0.864),尤其在BI-RADS 4A 亚组患者中能够很大程度减少不必要的活检,具有较高的临床价值(诊断准确度达92.9%)。WANG 等[37]仅通过51 个病例的DCE-MRI 的纹理特征(熵值、不均匀性和峰度)预测雌激素受体(estrogen receptor, ER)阳性的乳腺癌,对应的AUC 分别为0.891、0.859 和0.832。由此可见,单纯的纹理特征也具有一定的预测价值,但结合多阶特征的效果可能会更好。另有研究[38]发现基于增强乳腺X 线摄影的影像组学模型预测激素受体阳性乳腺癌具有较高的准确度(达95.6%),明显高于基于MRI 影像组学模型的预测能力(准确度为82.6%),这为存在MRI 检查禁忌的患者提供了更多选择。
虽然基于多种检查方法的AI 技术预测乳腺癌HER-2表达及分子分型均有相关研究[36,39],但DCE-MRI凭借着多参数成像及软组织分辨率高等优点可能在AI 诊断方面更有价值[40]。另外,基于CNN 的DL 模型预测乳腺癌分子分型的研究目前并不多,仍需要进一步探索。
2.4 AI技术在评估腋窝淋巴结转移中的应用
腋窝淋巴结(axillary lymph node, ALN)是乳腺癌最常见的转移部位,早期确定ALN状态对乳腺癌患者的个体化治疗及预后评估十分关键[41-42],目前,诸多学者积极探索影像组学和DL模型在ALN转移中的应用,以更好指导临床决策。SHAN 等[43]通过145 例DCE-MRI第2时相的影像组学特征和动力学曲线构建了一个术前检测浸润性乳腺癌ALN状态的列线图,训练集和验证集AUC分别达到了0.91和0.86,准确度分别为84%和82%。也有研究[44]选取了296 例DCE-MRI最明显一期的影像组学特征,结合MRI 报告的ALN 状态构建了预测ALN 转移的列线图,并在MRI 报告的ALN 阴性亚组中验证,该模型在验证集和亚组中的AUC 分别为0.90 和0.79,这在一定程度上降低了漏诊率。此外,对于已发生ALN 转移的患者,AI 技术能否判断转移ALN的数量也是一大热点。ZHENG等[45]基于584 例常规超声和SWE 的深度学习影像组学(deep learning &radiomics, DLR)特征,并结合临床信息预测ALN 转移负荷,该模型在预测ALN 阴性(N0)和阳性(N+≥1)方面具有最佳诊断性能(测试集AUC 达0.902),在高(N+≥3)低(N 为1~2)ALN 转移负荷间也表现良好(测试集AUC 为0.905),且准确度均≥85%。这也为选择合适的手术方案提供了新方法,即N+为1~2 患者选择前哨淋巴结活检,N+≥3 患者选择腋窝淋巴结清扫,N0患者可免除手术,在一定程度上避免过度诊疗。
目前,基于DCE-MRI 构建ALN 转移预测模型的研究中,不少学者正在探讨如何选择最佳增强时相的DLR特征。有研究[43]显示第2时相能够保证肿瘤与背景的强相关对比,也有研究[46]利用第3 时相构建模型并获得了较佳预测效能(测试集准确度为77%)。但DCE-MRI 最佳增强时相目前没有统一标准,需要进一步研究。此外,无创预测ALN转移负荷有望实现更精准的个体化治疗决策。
2.5 AI技术在乳腺癌放射基因组学中的应用
乳腺癌发生发展过程中,相关基因突变起主导作用,约15%的患者有遗传倾向[47]。乳腺癌易感基因的确定为其早期诊断提供新的方案[48-49]。随着技术发展,通过DLR 特征预测乳腺癌易感基因备受关注,较原有基因检测技术更无创便捷[50]。BRCA1/2 基因是最重要的遗传性乳腺癌易感基因,致病性BRCA1/2变异者终生患乳腺癌风险分别为65% 和45%[51]。VASILEIOU 等[52]纳入41 名高遗传风险患者,利用MRI纹理分析和临床信息预测BRCA突变,AUC达0.86,但样本量有限,有待进一步研究。磷脂酰肌醇激酶-3催化亚基α 基因(phosphoinositide-3-kinase catalytic alpha polypeptide gene, PIK3CA)突变通过PI3K/AKT/mTOR 通 路 参 与 乳 腺 癌 发 生 发 展[53]。SHEN 等[54]基于312 例超声图像,并通过CNN 方法预测PIK3CA 突变,结果显示所有模型的平均AUC为0.775,整体准确度为0.745,为早期诊断乳腺癌提供帮助。综上,AI方法结合影像特征预测乳腺癌易感基因,为无创性基因预测提供新方法,更为早期诊断乳腺癌和精准治疗打下基础。同时,乳腺基因序列包含预后信息,基于基因数据的影像组学研究是新的发展方向,值得长期关注。
本研究将以上不同预测任务的典型AI模型进行效能汇总,详见表1。
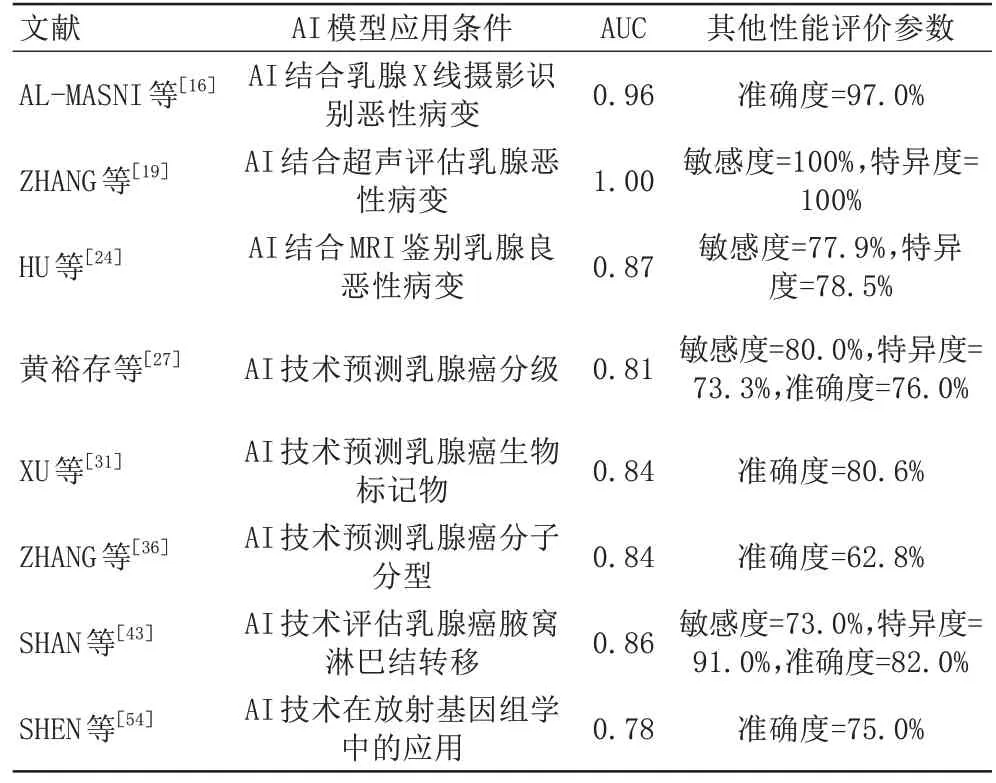
表1 不同预测任务的典型AI模型的预测效能Tab.1 Prediction performance of typical AI models for different prediction tasks
3 AI技术在乳腺癌诊断中的展望与挑战
目前,基于AI 技术在乳腺癌诊断方面的研究以影像组学方法为主,DL 的研究较少。影像组学和DL均能提取医学图像中的高维信息。但DL通过端到端的网络结构实现自动化特征提取和模型训练,不受人为影响,且可利用大样本进行模型优化,具有高效、稳定、可靠的优点[55]。因此,DL 方法是AI 辅助诊断的发展趋势。目前研究以单中心、回顾性为主,但此类研究未能考虑到地域和人群等差异,多中心和外部验证的研究更让人信服,也是AI 诊断研究的未来趋势。瘤周影像组学特征能够反映肿瘤生长微环境的差异,结合肿瘤本身特征具有更好的诊断效能[56]。此外,反映肿瘤相关信息的方式并不只有单一的影像图像,DCE-MRI 的药代动力学参数和组学特征的整合模型,或多序列特征的融合有助于模型预测效能的提高[57]。相比于单模态,多参数和多模态的AI诊断模型更具发展优势。
尽管AI 技术在乳腺癌诊断方面有较好的发展,但从研究向临床应用转化还面临挑战。首先,构建高效的DL 模型需要大规模且高质量的数据集,能够涵盖临床实践中可能遇到的目标病变的微妙范围,以便能够充分学习病变特征的变化,从而确保模型在实际应用中的鲁棒性,这使数据收集工作略具难度。其次,基于AI 的CAD 系统性能会受到纳入图像质量的影响,不同成像设备及图像处理软件造成的差异限制了系统的广泛应用[58]。最后,AI 算法的复杂性和不可解释性,也使临床医生和患者对其建议的可信程度有待考验。
总之,运用AI 算法对乳腺癌进行早期诊断及预后评估一直是研究的热点。本文介绍了AI在乳腺良恶性病变的鉴别诊断,乳腺癌的分类及分级、生物标记物及分子亚型、淋巴结转移及易感基因预测等方面的应用。尽管现有研究的AI模型已表现出较佳的预测效果,但距临床推广应用尚有距离,相信在广大影像医师及科技工作者共同努力下,AI 辅助诊断系统将在乳腺癌的诊疗中发挥更大作用。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:谭红娜设计本研究的方案,对稿件的重要内容进行了修改,并获得河南省自然科学基金项目、河南省医学科技攻关计划项目的资金资助;王贇霞起草和撰写稿件,分析和解释本研究的内容。全体作者都同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

