尼古丁和酒精依赖者自发性大脑活动静息态fMRI研究
王凌飞,张勇,牛晓玉,高昕宇,张孟哲,汪卫建,程敬亮
0 前言
吸烟和饮酒这两种成瘾行为对于健康的危害已经被广泛地认知和研究,它们之间有着许多相似之处。据统计,超过85%的饮酒者也依赖尼古丁[1]。吸烟者中酗酒的患病率是不吸烟者的10倍[2],这两种行为往往会相互激发,这可能是由于吸烟及饮酒均能产生类似的刺激和放松效应研究发现,个人吸烟和饮酒的结合会协同增加心血管疾病和肺癌等疾病的风险,导致更高的死亡率[3-4]。研究表明,吸烟和饮酒损害了默认网络(default mode network, DMN)的功能[5],同时,奖赏回路的功能连接增强[6-7]。但有争议的是,研究人员ADAMS[8]指出,酒精和尼古丁经常一起滥用,是由于尼古丁可以减轻酒精引起的认知障碍以及记忆损伤。目前,针对单一的吸烟及酒精成瘾均有大量的研究,但是至今尚未有关于尼古丁与酒精共同成瘾在静息状态下脑功能改变的研究数据。
低频振幅(amplitude of low-frequency fluctuation, ALFF)作为衡量脑神经活动强度和代谢水平的关键指标,通过测量一定频率范围内血氧水平依赖(blood oxygen level dependent, BOLD)信号的振幅,反映了脑区的自发神经活动程度。该指标的优势在于能够全面、客观地测量整个脑区的神经活动,避免了以往假设的分析方法所带来的局限性,因此能更准确地评估吸烟和饮酒成瘾行为对脑部的影响。通过ALFF 值的分析,我们能够更全面地了解吸烟和饮酒状态对大脑功能和代谢的影响程度,从而为探究成瘾行为的神经生物学机制提供重要线索。本研究采用2×2 因子设计,同时考虑了吸烟和饮酒状态,以探究这两个因素之间共病关联的神经生物学机制,深入了解吸烟和饮酒对大脑的影响,有助于针对性地制订干预措施,提高成瘾行为的预防和治疗效果,从而对公众的健康水平产生积极影响。
1 材料与方法
1.1 研究对象
本研究为前瞻性研究,于2018 年9 月至2020 年1月期间在互联网上招募饮酒吸烟者35人,单纯吸烟者27人,单纯饮酒者21人,非吸烟非饮酒者24人,均为成年男性、汉族、右利手。受试者被分为四组,包括:(1)饮酒吸烟者(n=35);(2)非饮酒的吸烟者(n=27);(3)饮酒非吸烟者(n=21)和(4)非饮酒非吸烟者(n=24)。本研究遵守《赫尔辛基宣言》,通过了郑州大学第一附属医院医学伦理委员会批准(批准文号:2019-KY-297),所有受试者均签署了知情同意书。
吸烟者纳入标准:(1)每天吸烟不少于10 支,烟龄2 年以上;(2)符合美国精神障碍诊断统计手册第5 版关于物质依赖的诊断标准;(3)戒烟时间不超过3个月;(4)年龄20~55岁。饮酒者纳入标准:通过酒精依赖量表(Alcohol Dependence Scale, ADS)来确定,ADS评分不少于4分。非饮酒非吸烟者纳入标准:(1)一生中吸烟少于5支;(2)ADS评分少于4分;(3)性别、年龄、受教育年限等与吸烟及饮酒者相匹配。吸烟饮酒者同时满足吸烟者及饮酒者的纳入标准。非饮酒的吸烟者仅满足吸烟者的纳入标准。饮酒非吸烟者仅满足饮酒者的纳入标准。所有受试者的排除标准:(1)患神经精神疾病;(2)患全身性疾病(如糖尿病、肿瘤、脑血管疾病等);(3)正在使用精神药品或者同时滥用海洛因等物质;(4)MRI检查禁忌证。
由2 名具有10 年以上工作经验的主治医师收集受试者人口学资料、吸烟相关临床资料,包括尼古丁依赖量表(Fagerstrom Test of Nicotine Dependence,FTND)评分、烟龄、吸烟指数[即(每天吸烟数量×吸烟年数)/20,1 包=20 支香烟],用来评估烟草依赖程度;ADS用来评估酒精依赖程度。
1.2 MRI检查方法
采用3.0 T MRI 扫描仪(型号:MAGNETOMSkyra,德国西门子)和配套的16 通道头部线圈。受试者仰卧位,头先进,闭眼,头部固定以减少头部运动。嘱咐受试者扫描时保持清醒、尽量不要过多思考。静息态BOLD fMRI利用回波平面成像序列,扫描参数如下:TR 2000 ms, TE 30 ms,翻转角80°,以颅内前后联合(anterior commissure-posterior commissure,AC-PC)为轴位扫描定位线,扫描层数36 层,FOV 240 mm×240 mm,层厚4 mm,时间点180,整个扫描时长为360 s。
1.3 影像数据处理
预处理在Matlab 平台上使用DPASFA 软件(版本号v4.3,advanced edition)进行,具体操作如下:(1)去除前5 个时间点,对余下的175 个时间点进一步预处理分析。(2)时间校正。(3)头动校正。(4)空间标准化,所有受试者图像配准到蒙特利尔神经研究所(Montreal Neurological Institute, MNI)3 mm×3 mm×3 mm标准空间。(5)回归,对24个头动参数、全脑信号、脑脊液信号、脑白质信号进行线性回归。此过程计算出平均框移(frame displacement, FD),平均FD>0.5 mm 的受试者被排除。(6)去线性趋势。(7)低频滤波。(8)清洗。(9)平滑:使用高斯核为6 mm3的全宽半高(full width at half maximum,FWHM)对所有图像进行空间平滑。
1.4 ALFF的计算
在REST(rs fMRI数据分析工具包)中计算ALFF。使用快速傅里叶变换(FFT)对Scrubbing后的时间序列进行变换(参数:锥形百分比=0,FFT 长度=最短),然后获得功率谱。由于给定频率的功率与原始时间序列时域中该频率分量振幅的平方成比例,因此在给定频率范围内计算功率谱的平方根,并在每个体素处获得0.01~0.08 Hz的均方根,称为ALFF。为了标准化的目的,每个体素的ALFF 除以全局平均ALFF值得到标准化ALFF值。
1.5 统计学处理
对四组患者的人口学和临床特征进行评估。人口统计学特征(年龄和受教育年限)和临床评分(吸烟年限、吸烟指数和FTND 评分)采用两样本t检验或Mann-WhitneyU检验。P<0.05 时认为差异具有统计学意义。使用SPM12中的全因子模型,进行了双向方差分析(ANOVA),以分析吸烟(吸烟者和非吸烟者)和饮酒状况(饮酒和非饮酒者)这两个因素对全脑ALFF 的影响。受教育年限、年龄和平均FD 作为协变量输入。将吸烟饮酒者ALFF 值明显升高的团块设置为ROI。从ROI 中提取ALFF 值,然后使用两样本t检验进行事后比较,用于相互作用效应分析(P<0.0125, Bonferroni校正)。
为了检验ALFF变化与吸烟严重程度和饮酒情况的相关性,我们对相关脑区(交互作用分析中的变化)和临床数据(烟龄、吸烟指数、FTND 评分和饮酒依赖量表分值)进行了Spearman相关性分析。
2 结果
2.1 人口统计学资料比较
人口学和临床特点如表1 所示。吸烟者与非吸烟者在年龄、受教育年限、平均FD 及酒精依赖量表分值差异无统计学意义(t=-0.031,P=0.963;t=-1.723,P=0.089;t=0.451,P=0.635;t=0.287,P=0.759;Z=-1.723,P=0.089)。饮酒者和非饮酒者在年龄、受教育年限和平均FD方面差异无统计学意义。饮酒吸烟者与非饮酒吸烟者在FTND 评分(t=0.289,P=0.757)、烟龄(t=1.857,P=0.069)和吸烟指数(t=1.916,P=0.057)差异无统计学意义。
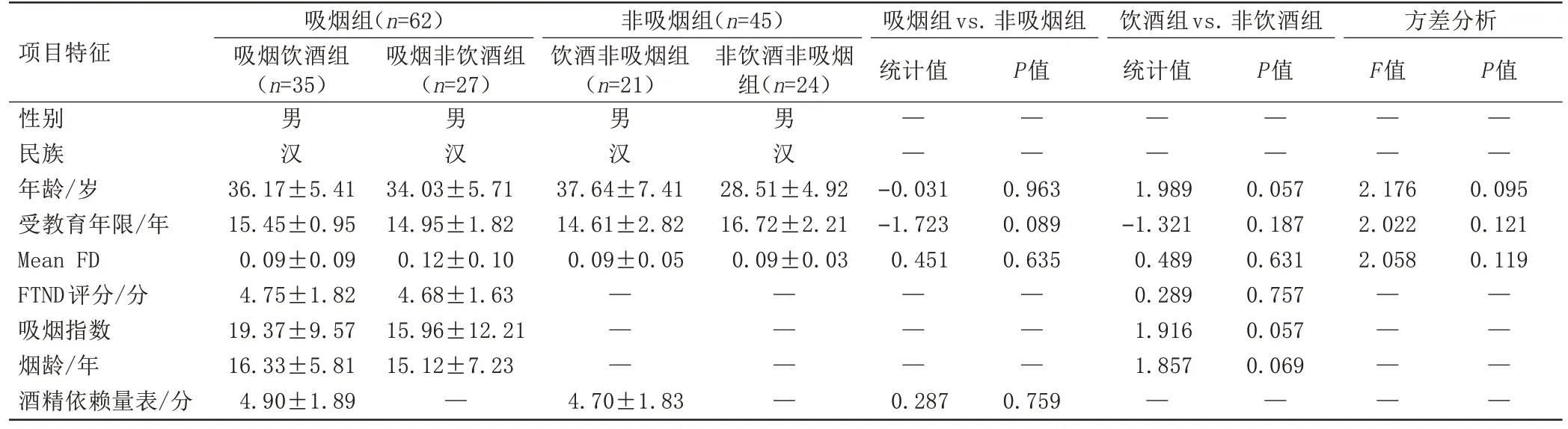
表1 人口统计学和临床特征信息表Tab.1 Demographic and clinical characteristics
2.2 ALFF差异
吸烟的主要影响区域在双侧楔前叶、右侧楔叶。与非吸烟者相比,吸烟组在上述区域的ALFF 值都有所增加(图1A 和表2)。饮酒组在左侧小脑后叶的ALFF值有所增加(图1B)(t=3.422,P=0.001)。
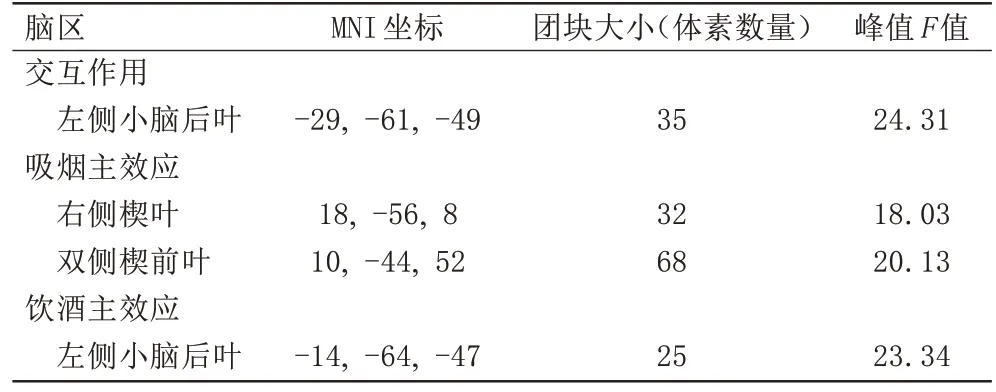
表2 低频振幅的显著组别差异Tab.2 Significant group differences in amplitude of low-frequency fluctuation
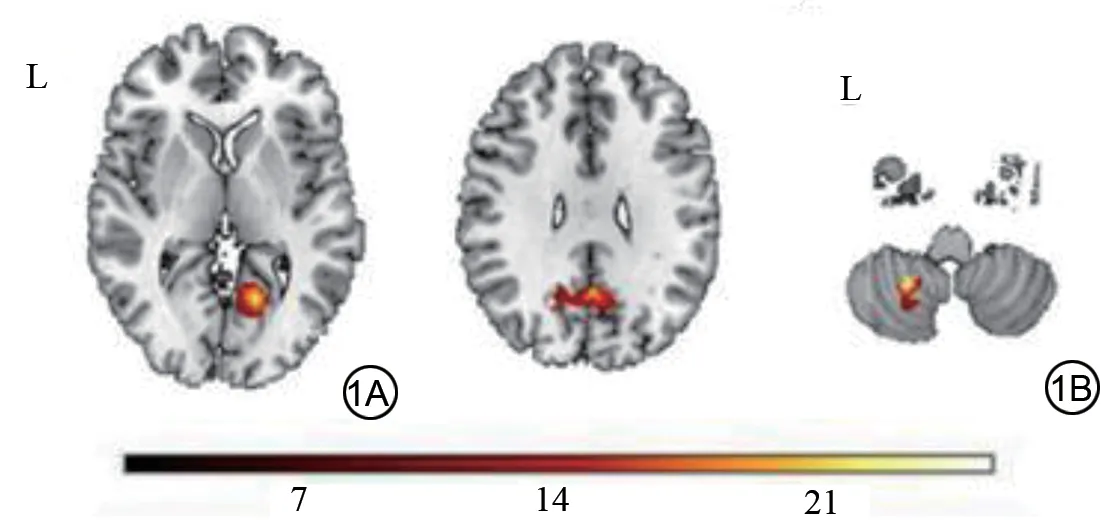
图1 吸烟及饮酒组ALFF差异脑区。1A显示吸烟组在右侧楔叶、双侧楔前叶ALFF 值升高,使用双向方差分析(GRF 校正,体素水平P<0.005,团块水平P<0.05);1B 显示饮酒组在左侧小脑后叶ALFF 值升高。L表示左侧;ALFF:低频振幅。Fig.1 Brain regions differential ALFF between smoking and drinking groups.1A shows increased ALFF values in the right cuneus and bilateral precuneus in the smoking group, using a two-way analysis of variance(GRF-corrected, voxel-level P<0.005, cluster-level P<0.05); 1B shows increased ALFF values in the left posterior cerebellum in the alcohol drinking group.L indicates the left side; ALFF: amplitude of low-frequency fluctuation.
吸烟与饮酒之间的交互作用出现在左侧小脑后叶(图2)。事后分析显示,与非饮酒的非吸烟者相比,吸烟者在左侧小脑后叶的ALFF 值增加(t=3.212,P=0.001)。然而,饮酒吸烟者和非饮酒的非吸烟者之间的左侧小脑后叶的平均ALFF 值更为相似(图3)。
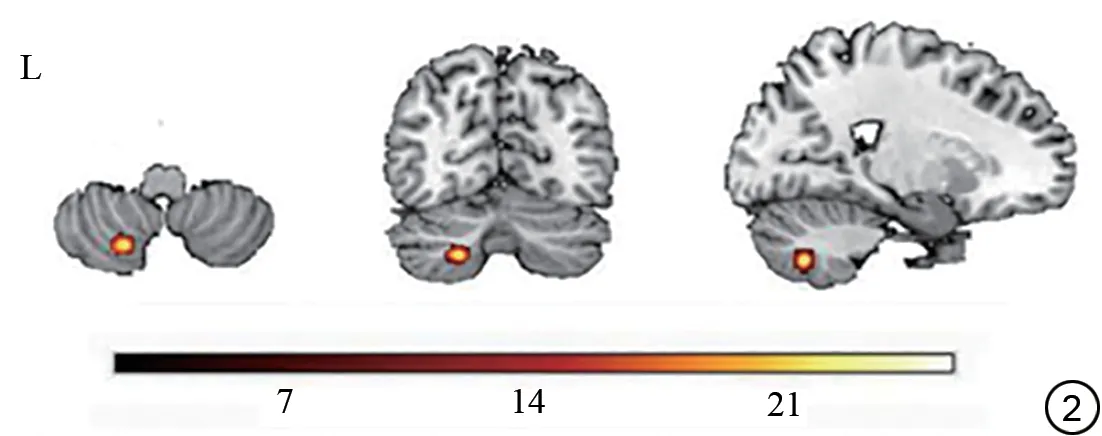
图2 吸烟、饮酒交互作用影响脑区。统计显著性水平设置为体素水平P<0.005,团块水平P<0.05,GRF校正。Fig.2 Interaction of smoking and alcohol consumption affects brain regions.The statistical significance level set at voxel-level P<0.005 and cluster-level P<0.05, GRF-corrected.
Spearman 相关分析发现,吸烟者左侧小脑后叶中ALFF值与烟龄、吸烟指数、酒精依赖量表分值呈负相关(r=-0.367,P=0.025;r=-0.267,P=0.033;r=-0.293,P=0.026),具体结果见图4。
3 讨论
本研究使用ALFF方法确定了四组受试者的自发大脑活动,并采用了2×2的因子设计用于分析吸烟、饮酒两者的交互作用。与非吸烟者相比,吸烟者的双侧楔前叶、右侧楔叶的大脑活动都有所增加。此外,饮酒者在左侧小脑后叶ALFF值较高。然而,更重要的是,本研究发现吸烟和饮酒由于相互作用共同影响了左侧小脑后叶的自发大脑活动,这为它们的共同成瘾提供了可能的解释。
3.1 尼古丁成瘾者ALFF改变
吸烟的主要影响表现为右侧楔叶、双侧楔前叶的ALFF值升高,这与先前的研究[9-11]结果一致。
楔叶与视觉注意力、工作记忆、空间感知和语言理解等有关[12-13]。右侧楔叶与视觉注意力有关,能够帮助人们集中注意力在重要的视觉信息上,并且能够忽略无关的信息。研究表明,当人们需要集中注意力完成某项任务时,右侧楔叶的活动水平会增加[14]。对于尼古丁依赖者,看到与吸烟有关的物体或场景(例如香烟、烟灰缸、烟斗等)可能会引发强烈的渴望吸烟的感觉,这被称为“诱因反应”。这种“诱因反应”与吸烟习惯的形成和维持有关[15-16]。当人们在某些情境下吸烟时,例如社交场合或工作休息时,他们会形成与这些情境相关的条件反射。这些情境和视觉刺激成为了吸烟的触发器,使得当人们遇到这些情境和视觉刺激时,他们会感到强烈的吸烟渴望。一些研究[17]表明,尽管吸烟者可能已经决定戒烟,但看到与吸烟有关的视觉刺激仍然可能导致他们重新开始吸烟。因此,本研究表明,烟草暴露和与吸烟有关的视觉刺激对于尼古丁成瘾有重要意义。
楔前叶是默认网络的核心区域之一,主要在人体的认知和行为方面发挥作用。先前的研究[18]发现,相比健康对照组,尼古丁依赖者的楔前叶对奖赏刺激的反应减弱。这种反应减弱是由于尼古丁的摄入引起的多巴胺和尼古丁受体上调,耐受性提高,导致大脑对尼古丁的需求不断增加,最终使尼古丁成瘾者从物质成瘾转变为行为成瘾。楔前叶的这种功能失调反映出尼古丁对于神经元的重塑作用[19-20]。
3.2 酒精成瘾对于ALFF的改变
饮酒的主要影响表现在左侧小脑半球后叶。既往研究[21-22]中,把这种表现和酒精依赖者记忆力下降联系在一起。但本研究中,饮酒者小脑后叶的自发活动增强,这种现象说明酒精对于小脑的作用不仅仅局限于记忆方面,这种影响具有复合性。长期饮酒会上调谷氨酸受体功能,改变代谢型谷氨酸受体、大麻素CB1 受体和阿片类药物受体。这些变化可能在成瘾行为形成中发挥作用[23]。
3.3 尼古丁与酒精成瘾的交互作用
在先前的研究[24-26]中,吸烟和饮酒主要影响的是左侧额叶,随着成瘾程度提高,额叶的体积缩小,神经活动减弱,这主要反映了尼古丁和酒精对于大脑的损害。但本研究发现吸烟和饮酒的交互作用主要出现在左侧小脑后叶的下半月小叶。
目前,小脑已经不再被认为是只具有单一的运动平衡协调功能,同时,还具备许多非运动功能,这些区域大部分集中在小脑后叶及蚓部[27],作用包括认知能力、空间推理、情绪调控以及对工作相关记忆的判断、处理[28-29]。此外,小脑与大脑之间存在广泛的功能连接,尤其是在与奖赏相关的认知输入方面具有重要作用。小脑通过攀爬纤维接受来自大脑皮层的奖励信号,这些信号由小脑后叶的颗粒细胞接受,经过加工处理后,投射回包括通过丘脑的皮质、腹侧被盖区和包括下橄榄在内的脑干核团[30]。当小脑后叶的活动增强时,这一反馈过程被加强,奖赏回路被过度激活,而加剧了成瘾行为[31]。这反映出小脑后叶对于大脑皮层传递的信号有记忆和学习能力,并作为奖赏回路的重要中继发挥作用[32-34]。既往研究[35-36]中,强调了药物诱导的小脑功能和结构变化是由最开始的刺激性物质服用模式向强迫性行为使用模式转变的核心。由于小脑具有复杂的神经递质系统,其中包括多巴胺和γ-氨基丁酸神经元,它们是尼古丁和酒精作用的主要细胞靶点,尼古丁通过与多巴胺神经元上的烟碱受体结合,增强了神经元对尼古丁的耐受性,提高了多巴胺神经元的活性。而酒精也能够引起多巴胺的过度释放,但是酒精是通过引起γ-氨基丁酸受体的下调,间接解除了对多巴胺神经元的抑制作用,由于这种交互作用,先前的研究[37-39]指出,对于酒精成瘾者,尼古丁是一种极其有效的增强剂。在本研究中,与非饮酒非吸烟组相比,吸烟饮酒组小脑后叶ALFF值的升高,一方面,说明了小脑的非运动性功能;另一方面,结合既往研究[40],说明小脑可能影响了DMN 的大脑自发活动,小脑ALFF值的升高可能与成瘾者DMN 的过度激活以及相关脑区的功能紊乱相关。
3.4 事后分析
此外,本研究对左侧小脑后叶的事后分析表明,与非饮酒的非吸烟者相比,非饮酒的吸烟者的ALFF值增加,这与之前的研究[41]一致。然而,与非饮酒的吸烟者相比,饮酒吸烟者左侧小脑后叶的ALFF 值更接近非饮酒的非吸烟者。这可能说明了酒精对于尼古丁对于神经元的影响有一定的拮抗作用,但是在所有吸烟者中,左侧小脑后叶中的ALFF 值与吸烟年限、吸烟指数和酒精依赖量表分值均呈负相关,说明这种影响具有局限性,随着吸烟、饮酒程度的加剧,这种影响效果不足以代偿吸烟、饮酒对于神经元的损伤[42]。这可能需要今后更多的实验包括药代动力学的研究来证明。
3.5 研究的局限性
本研究也有一些局限性:(1)本研究只包括男性受试者,这是因为男性的吸烟率比女性高。此外,性别对吸烟者的大脑功能有影响,为了控制影响因素,本研究只包括男性。(2)本研究纳入的饮酒志愿者和吸烟者缺乏一些临床数据(例如饮酒者的行为、认知改变情况),这些数据对不同的大脑区域进行相关性分析非常重要。未来的研究需要更全面地考虑这些因素。(3)本研究是横断面研究,样本量较小。在未来的研究中需要收集更多的数据以提高统计效力和结论的可靠性。
4 结论
本研究发现吸烟和饮酒都会影响自发性大脑活动,它们的交互作用出现在左侧小脑后叶。吸烟和饮酒会产生一种新的拮抗相互作用。这表明在研究吸烟者的自发大脑活动时,需要将饮酒作为一个变量进行控制。此外,吸烟和饮酒在小脑后叶的相互作用说明了小脑在尼古丁和酒精成瘾中发挥了作用,在一定程度上说明了尼古丁和酒精成瘾者在认知、行为以及记忆方面产生的缺陷,为共同成瘾提供神经学解释,并为多种药物共同成瘾的治疗提供新的方向。
作者利益冲突声明:全体作者均声明无利益冲突。
作者贡献声明:张勇设计本研究的方案,对稿件的重要内容进行了修改;王凌飞起草和撰写稿件,获取、分析或解释本研究的数据;牛晓玉、张孟哲、高昕宇、汪卫建、程敬亮获取、分析或解释本研究的数据,对稿件的重要内容进行了修改;张勇获得了河南省重点研发与推广专项(科技攻关)项目资助。全体作者均同意发表最后的修改稿,同意对本研究的所有方面负责,确保本研究的准确性和诚信。

