通过宏基因组二代测序技术辅助诊断慢性肾功能不全相关耶氏肺孢子菌合并曲霉肺部感染1例
潘 雨 重庆市沙坪坝区中医院放射科 400030
肺部感染包括社区获得性肺炎(CAP)、医院获得性肺炎、支气管炎、细支气管炎和气管炎,是第五大死亡原因[1]。肺部感染是由多种病原体引起的,如细菌、病毒、支原体和真菌,这些病原体的临床表现难以区分,尽管进行了全面的诊断检查,但高达62%的CAP病因仍未确诊。曲霉菌和耶氏肺孢子菌是真菌病原体,均为机会性感染,常常发生在免疫功能低下的患者中,且病情发展迅速、病死率高,尤其是曲霉菌感染,已经成为免疫功能低下患者中与感染相关的主要死亡原因[1]。细菌培养作为微生物鉴定的金标准,具有耗时长、灵敏度低、需要对病原微生物类型的先验知识或假设的缺点,尤其对少见的微生物。宏基因组二代测序(metagenomics next-generation sequencing,mNGS)也被称为高通量或大规模并行测序,是一种可进行数千到数十亿个DNA片段同时和独立测序的技术类型[2],是一种用来检测病原体的无偏倚方法。它可以广泛识别已知和意外的病原体,可以同时识别样本中的所有潜在感染因子,避免预先确定诊断目标,mNGS是一种检测新型或稀有微生物的有用技术[3],也有效地提高了鉴定挑剔微生物和诊断肺部合并感染的分析灵敏度。本文探讨1例慢性肾功能不全患者耶氏肺孢子菌合并曲霉肺部感染,患者病情重,发展快,病死率高,预后差,随着宏基因二代测序技术的发展,对免疫缺陷伴重症肺炎患者提供的新的诊断依据,大大提高了患者的存活率。
1 病例资料
1.1 入院情况 患者为老年男性,69岁,8d前无明显诱因出现腹泻,3~4次/d,清水样便,轻微腹痛,无呕吐、发热、畏寒、晕厥等症状,自行口服“消炎药及止泻药”效果不佳,于4d前开始出现发热,最高体温可达39.8℃,于2022年6月26日在重庆市江津某医院感染科住院治疗,其间完善大便常规检查未见明显异常,胸部CT提示肺部感染较重,给予亚胺培南抗感染治疗。现患者仍有间断发热,需要无创呼吸机辅助通气治疗,2022年6月28日我院门诊以“重症肺炎”收入住院。患者既往有慢性肾功能不全病史1年,长期口服他克莫司胶囊、阿魏酸哌嗪片、肾炎康复片、醋酸泼尼松片维持治疗。入院查体:体温36.4℃,心率91次/min,呼吸37次/min,血压113/76mmHg(1mmHg=0.133kPa),外周指氧饱和度90%。轮椅推入病房,神志清楚,口唇发绀,气促明显,双肺呼吸音低,双下肺可闻及湿啰音。
1.2 诊疗经过 入院完善相关检查:2022年6月28日肝功:总蛋白41g/L、白蛋白23.7g/L、乳酸脱氢酶549U/L。血气分析:二氧化碳分压 26.00mmHg、氧分压 119.0mmHg、实际碳酸氢盐15.00mmol/L。血常规:白细胞数10.54×109/L、中性粒细胞数 10.35×109/L、淋巴细胞数 0.09×109/L、嗜酸性粒细胞数0.01×109/L ,C反应蛋白 123.07mg/L。胸部CT提示双肺间质性改变、伴双肺弥漫感染,见图1,建议治疗后复查。入院诊断:(1)重症肺炎,(2)重度免疫缺陷,(3)呼吸衰竭,(4)冠状动脉粥样硬化性心脏病,(5)心功能Ⅱ~Ⅲ级,(6)慢性肾功能不全,(7)低蛋白血症,(8)凝血功能异常。治疗予以无创呼吸机辅助呼吸,予注射用美罗培南1g q12h联合氟康唑0.2g qd解痉平喘,吸入用乙酰半胱氨酸溶液0.3g+吸入用沙丁胺醇5mg祛痰扩张支气管,由于患者严重白蛋白降低,予人血清白蛋白20g静脉输注。2022年7月1日复查胸部CT显示肺部感染较前新增加重,见图2。2022年7月2日宏基因二代测序外检结果:真菌类:耶氏肺孢子菌、烟曲霉感染,病毒类均阴性。结合肺部影像学表现考虑耶氏肺孢子菌及烟曲霉感染导致。根据药敏结果停用美罗培南+氟康唑,调整抗感染方案为:替加环素+复方磺胺甲噁唑+伏立康唑+西多福韦。调整治疗方案后2022年7月3日血常规:白细胞数6.42×109/L,中性粒细胞数5.73×109/L、淋巴细胞数 0.43×109/L、嗜酸性粒细胞数0.01×109/L ,C反应蛋白 24.49mg/L。患者感染症状较前减轻,喘累较前好转。2022年7月6日复查胸部CT,对比2022年7月1日 CT双肺散在感染,较前病灶大部分吸收,提示患者肺部情况较前明显好转,见图3。继续当前支持治疗,患者精神较前明显改善,无喘累不适,偶有咳嗽,患者于2022年7月17日病情好转出院。
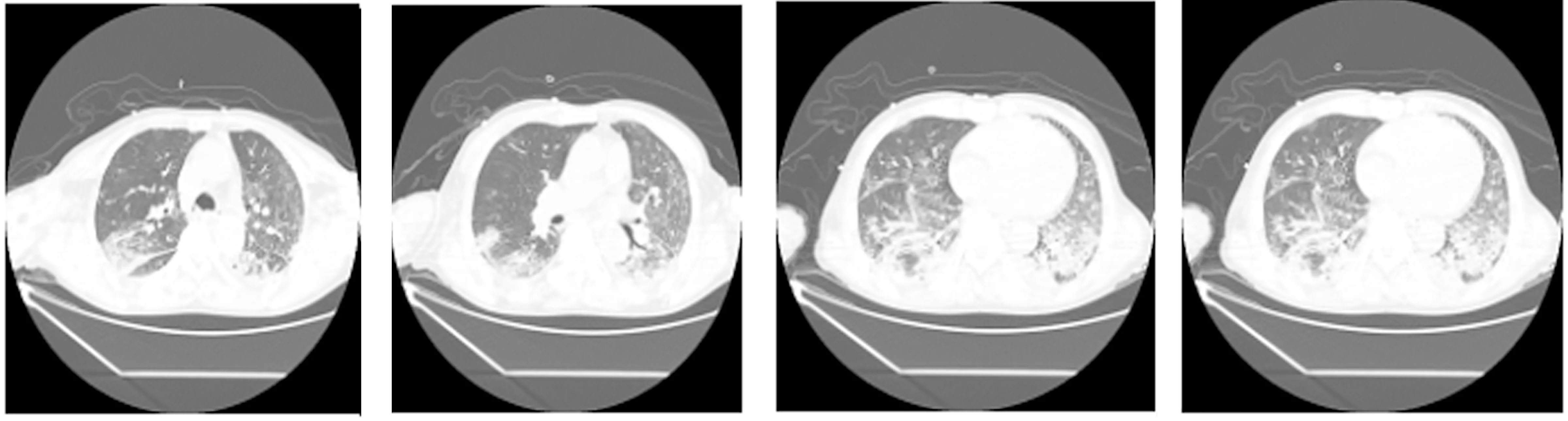
图2 患者治疗后7月1日复查胸部CT双肺上叶病灶部分吸收,双肺下叶病灶实变,新增双侧少量胸腔积液
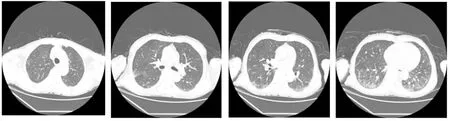
图3 患者宏基因DNA检测调整用药方案后复查胸部CT双肺大部分病灶吸收,遗留双肺部分间质性改变
2 讨论
在没有明确微生物学诊断的情况下,严重肺部感染患者通常在初始治疗期间使用经验性广谱抗生素来缓解症状[4]。一旦发现病原体,临床医生应调整或停止经验性治疗。然而,如果患者反映良好或未检测到致病病原体,则通常会继续这种治疗,这导致了广谱抗生素的滥用。此外,在缺乏微生物病原学的情况下,临床医生可能会错误地将症状归类为非传染性炎症状态,并经验性给予皮质类固醇进行治疗,这可能导致再次感染。糖皮质激素及免疫抑制剂的广泛使用,造成非HIV免疫功能低下患者日益增多,免疫功能低下患者伴发的感染常常具有病情重、病情反复、病原学不典型、混合感染等特点,给临床的诊断与治疗带来极大困难[5]。免疫功能低下患者肺部感染中,耶氏肺孢子菌合并曲霉感染少见,近年来随着诊断技术的改良发展,陆续有个案报道。快速和准确地识别病原体可以实现针对性的治疗,减少广谱抗生素的滥用,并促使患者最终康复。宏基因组下一代测序(mNGS)成为克服传统诊断方法缺点的一种新工具。mNGS的主要优势在于其无偏采样,可以同时识别样本中的所有潜在感染因子,避免预先确定诊断目标。因此,它在诊断不明原因和合并感染的肺部感染方面具有明显的优势。mNGS是一种检测新型或稀有微生物的有用技术,也有效地提高了鉴定挑剔微生物和诊断肺部合并感染的分析灵敏度。与依赖培养的方法[6]相比,mNGS的结果不太可能受到先前抗生素暴露的影响。除了病原体鉴定外,mNGS还为气道微生物组分析、人类宿主反应分析和耐药性预测提供了额外的基因组信息,所有这些都有助于肺部感染患者的临床管理[7]。mNGS作为一种不依赖培养、无偏倚和无假设的方法,近年来已成为呼吸道感染的诊断方法[8-9]。目前用于肺部感染诊断的分子检测通常是病原体特异性的,临床医生根据患者的症状选择相关检测,当出现新的或意想不到的病原体时,造成临床诊断的困难。相比之下,mNGS可以提供给定样本中病原体的全面视图,从而能够在原因不明的肺炎诊断中检测出新的和罕见的致病病原体。mNGS可以为识别罕见病原体和减少不明原因肺炎诊断的延迟提供线索。传统的培养方法对难以培养或需要长时间培养的病原体检出率较低。mNGS检测范围广,且对疑似致病菌不需要假设,是诊断耶氏肺孢子菌、曲霉感染肺炎的有效工具。mNGS作为一种不依赖培养的检测方法,有望在较短的反馈时间内检测出这些挑剔的生物。mNGS的分析性能优于培养,特别是对挑剔的生物,如结核分枝杆菌、病毒、厌氧菌和真菌。据报道,与组织病理学方法[10-11]相比,mNGS在评估肺活检组织中的真菌时达到100%的特异性。结核分枝杆菌(MTB)培养时间长,检出率低。目前,大多数mNGS平台从样本接收到最终结果的平均典型周转时间(tat)为48h[12-13]。目前,mNGS已越来越多地应用于临床感染患者样本的病原体无偏检测。肺部感染是mNGS可以发挥作用的领域。随着自动化技术的发展,包括复杂的人工操作、复杂的数据分析和高成本在内的障碍将被消除。mNGS将在未来十年成为传染病诊断领域的重要工具。
综上所述,对于免疫功能低下的患者来说,混合感染及机会性感染的可能性都大,并且此类患者往往病情发展迅速,进展快,病死率高,临床诊断却十分困难。对于此类患者临床在考虑混合感染的同时,也要考虑到机会性感染的可能,对于微生物的鉴别应考虑得更广泛,在应用mNGS 检测的同时,也需要结合患者的宿主因素、临床症状、实验室检查、影像学表现等综合考虑。

