阻抑动力学光度法测定水样中的痕量铝
高先明
(河南神马尼龙化工有限责任公司,河南 平顶山 467013)
铝元素的含量约占地壳总量的8%[1],广泛用于太阳能电池、涂料和电线、电缆等行业。过量的铝元素对人类和动植物会造成极大危害,扰乱人的大脑,可使患者成为痴呆[2];使植物细胞脱水,抑制植物对钙磷的吸收和累积,使水生动物缺乏营养而死。因此环境水样中铝含量的测定愈加受到重视。
铝的测定方法主要包括荧光光度法[3],石墨炉原子吸收光谱法[4],火焰原子吸收光谱法[5],电化学分析法[6],电感耦合等离子体原子发射光谱法(ICP-AES)[7],高效液相色谱法[8],滴定法[9]及分光光度法[10]等。分光光度法因其灵敏度高、成本低、操作简单等诸多优点成为目前检测铝最常用方法之一。
1 实 验
1.1 主要仪器及试剂
DF-101S集热式恒温加热磁力搅拌器,河南省予华仪器有限公司;UV-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;CP224C电子天平,上海奥豪斯仪器有限公司;723 s可见分光光度计,上海精密科学仪器有限公司。
甲基紫(AR),天津市盛奥化学试剂有限公司;硫酸铝(AR),天津市博迪化工有限公司;过氧化氢(AR),天津市大茂化学试剂厂;十六烷基三甲基氯化铵(AR),天津纯晟精细化工科技有限公司。
1.2 试剂配制
甲基紫溶液:准确称取0.197 0 g甲基紫倒入200 mL烧杯中,溶解稀释后,转移到500 mL容量瓶中,加蒸馏水至刻度线,摇匀。则溶液中甲基紫的浓度为0.001 0 mol/L,进行实验时再稀释10倍。
硫酸铝溶液:准确称取Al2(SO4)3·18H2O 0.306 2 g倒入烧杯中,溶解稀释后,转移到250 mL容量瓶中,加蒸馏水至刻度线,摇匀,则溶液中Al3+的浓度为100 μg/mL的溶液,进行实验时再稀释10倍。
过氧化氢溶液:用移液管准确移取100 mL 30%的过氧化氢到1 000 mL的容量瓶中,稀释至刻度,摇匀。
CTAC溶液:准确称取0.800 0 g十六烷基三甲基氯化铵,在烧杯中溶解稀释后,转移到250 mL容量瓶中,加蒸馏水至刻度线,摇匀,所得溶液的浓度为0.01 mol/L。
1.3 实验方法
选用两个25 mL的容量瓶,分别加入4.0 mL甲基紫溶液,0.8 mL过氧化氢溶液,0.5 mL CTAC溶液。在其中一个容量瓶内加入2.0 mL Al2(SO4)3溶液(起催化反应,溶液吸光度为At);另一个容量瓶内不加Al2(SO4)3溶液(非起催化反应,吸光度为A0)。摇匀,在80 ℃时,迅速放入恒温水浴中,加热25 min,之后取出容量瓶,在流动的冷水中冷却5 min。以蒸馏水为参比,在最大吸收波长584 nm处,体系吸光度用1 cm比色皿测定。
2 结果与讨论
2.1 最佳吸收波长的选择
根据实验要求配制溶液,以蒸馏水为参比,在400~800 nm之间用1 cm比色皿测吸光度,绘制体系的吸收光谱,结果如图1、图2所示。其中,a是甲基紫的吸收谱线,b是甲基紫+CTAC+Al3+的吸收谱线,c是甲基紫+CTAC+Al3++H2O2的吸收谱线,d是甲基紫+Al3++H2O2的吸收谱线,e是甲基紫+H2O2的吸收谱线,f、g、h、i分别是溶液中Al3+浓度为0.04、0.12、0.20、0.32 mg/L时的吸收谱线。
由图1看出,甲基紫(线a)的最大特征吸收峰在584 nm处。在过氧化氢的作用下(线e),甲基紫褪色明显,说明过氧化氢对甲基紫具有明显的氧化作用。在甲基紫溶液中加入Al3+(线b),甲基紫几乎不褪色,说明Al3+与甲基紫几乎不反应。在线e对应的溶液中加入Al3+(线d),甲基紫溶液褪色但不明显,说明Al3+可以阻止过氧化氢氧化甲基紫褪色,效果比较明显。在线d对应的溶液中加入CTAC(线c),甲基紫溶液褪色更加不明显,说明CTAC和Al3+可以共同阻止过氧化氢氧化甲基紫褪色,效果更加明显。

图2 不同浓度Al3+体系的吸收谱线Fig.2 Absorption spectra of systems with different concentrations of aluminum ions
由图2看出,当溶液中改变Al3+的用量后,甲基紫的褪色发生规律性的变化,随着溶液中Al3+浓度的增加(线i、h、g、f),溶液吸光度的减少量依次降低,且吸光度的减少量与Al3+浓度成线性关系,说明确实是Al3+进行了阻抑过氧化氢氧化甲基紫褪色的反应,而且在584 nm处,这几组曲线存在最大吸收峰,所以本实验的测定波长为584 nm。
2.2 最佳反应条件的选择
2.2.1 溶液酸碱度环境的选择
依据实验方法,以蒸馏水为参比,考查在H2SO4、HCl、HNO3、十二烷基苯磺酸钠、十六烷基三甲基氯化铵、十六烷基三甲基溴化铵、聚乙二醇不同的介质中,溶液在584 nm处吸光度的变化,并计算ΔA。结果如表1所示。

表1 不同介质溶液的吸光度Table 1 Absorbance of different medium solutions
由表1可以发现:在酸性介质中,ΔA的值相当小,因此应选碱性介质,在十六烷基三甲基氯化铵的碱性介质中,ΔA值最大,铝离子阻抑甲基紫褪色作用比较明显。所以本实验选择十六烷基三甲基氯化铵作为碱性介质。
根据实验方法,以蒸馏水为参比,考察CTAC的用量为0.1 mL、0.3 mL、0.5 mL、0.8 mL、1.0 mL、1.5 mL、2.0 mL时体系吸光度的变化,结果见表2。
由表2可以发现,随着CTAC溶液加入量的增加,ΔA逐渐增大,即甲基紫的褪色反应被阻抑的较为明显,在0.5 mL时最明显,之后CTAC用量再增加,ΔA减小。因此该实验CTAC的最适合加入量为0.5 mL。

表2 CTAC的用量对体系吸光度的影响Table 2 Effect of the amount of CTAC on the absorbance of the system
2.2.2 试剂用量的选择
按照实验方法,以蒸馏水为参比,考察甲基紫溶液用量为1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL、6.0 mL、7.0 mL时对体系吸光度的影响,并计算ΔA。结果见表3。
由表3可以发现,随着甲基紫溶液加入量的增加,ΔA逐渐增大,甲基紫的褪色反应被阻抑的越发明显。当甲基紫溶液的加入量超过5.0 mL时,溶液的ΔA增大过快,影响数据的准确度。因此,甲基紫溶液最适合加入量定为4.0 mL。
按照实验方法,以蒸馏水为参比,考察过氧化氢溶液用量为0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL对体系吸光度的影响,并计算ΔA。结果见表4。

表4 过氧化氢用量对体系吸光度的影响Table 4 Effect of hydrogen peroxide dosage on absorbance of the system
由表4可以发现,随着过氧化氢用量的增加,ΔA也随之增加,说明甲基紫的褪色反应被明显抑制。当过氧化氢溶液用量为0.8 mL时,ΔA维持恒定。之后随着试剂用量的增加,吸光度减小。故选择过氧化氢溶液最适宜加入量为0.8 mL。
2.2.3 反应温度的选择与表观活化能

表5 反应温度对体系吸光度的影响Table 5 Effect of reaction temperature on absorbance of the system
根据实验方法,以蒸馏水为参比,改变反应温度,考查反应温度为60 ℃、65 ℃、70 ℃、75 ℃、80 ℃、85 ℃、90 ℃对体系吸光度的影响。结果见表5。
由表5可以发现,随着反应温度的增大,ΔA先迅速增加,在80 ℃时最大,甲基紫褪色反应明显被抑制,之后吸光度逐渐减小。因此本实验选择在80 ℃的恒温水浴中进行。
根据Arrhenins公式可计算出反应活化能。
log k=log Z-E/2.303RT
V=kπ
式中:π为所有参与反应物浓度的函数。因为参加反应的物质浓度为常数,所以π也为常数,则为:
log V=log Zπ-E/2.303RT
因此,根据Arrhenins公式,在50~80 ℃范围内,以褪色反应速率log(At/A0)对1 000/T作图得到一条直线,如图3所示。

图3 log(At/A0)与1/T关系图Fig.3 Relation between log(At/A0)and 1/T
由图3可知,该直线的回归方程为:
log(At/A0)=-5.302 9×1/T×103+16.197,相关系数 r=0.9975
通过斜率求出表观活化能:
E=5.302 9×2.303×8.314=101.535 kJ/mol
2.2.4 反应时间与反应速率常数
按照实验方法,以蒸馏水为参比,改变反应时间,考查反应时间为5 min、10 min、15 min、20 min、25 min、30 min、35 min对体系吸光度的影响,结果见表6。
由表6可以发现,随着反应时间逐渐增长,ΔA随之增大,即甲基紫的褪色反应被阻抑的较为明显,在25 min时最明显,ΔA最大,之后 ΔA 逐渐变小,甲基紫被逐渐氧化。本实验选择在25 min的反应时间进行。
由于反应速率与反应时间在25 min以前基本上是线性关系。因此,以反应速率对反应时间作图,可得一条直线,如图4所示。
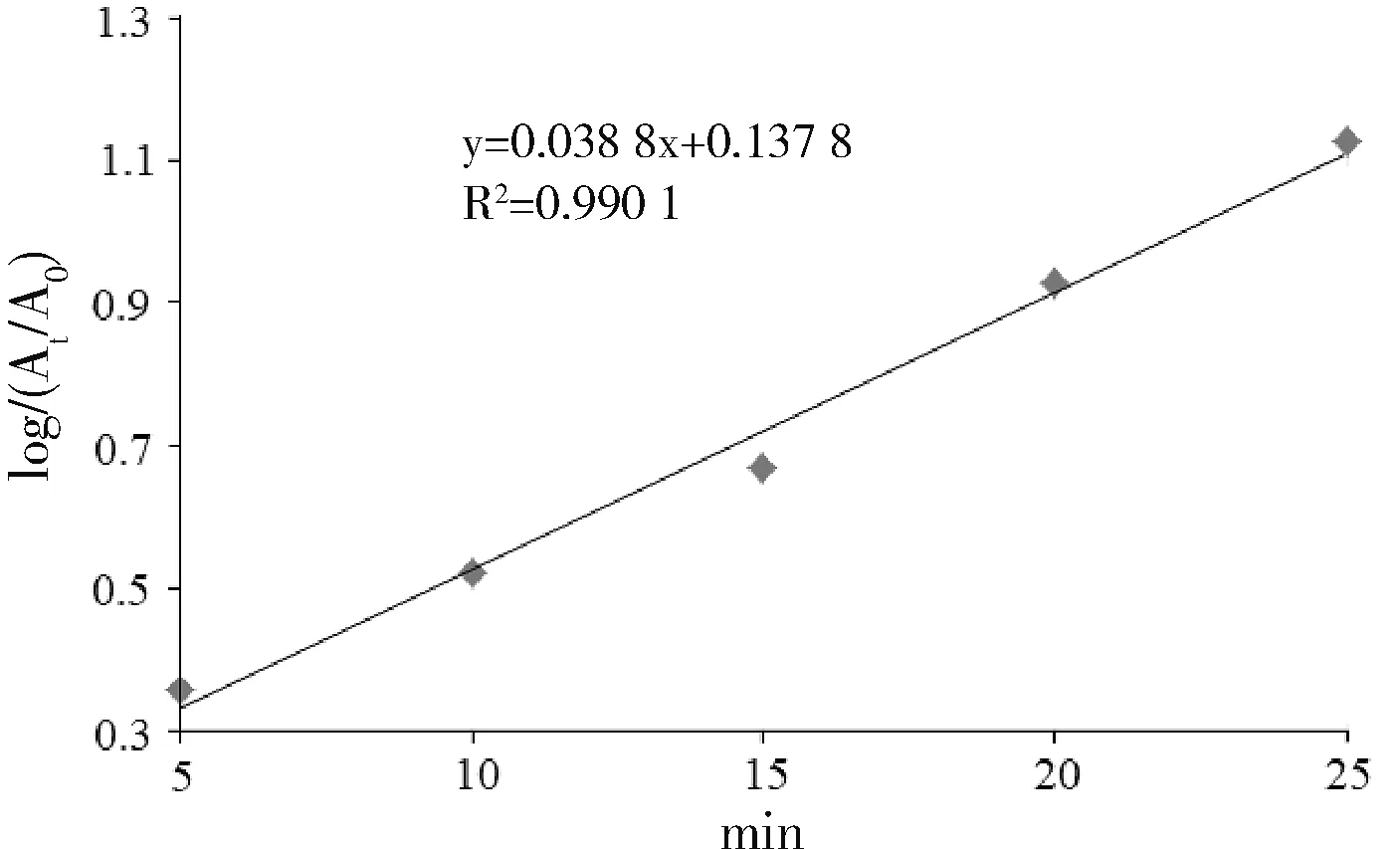
图4 动力学曲线Fig.4 Curve of dynamics
由反应的动力学曲线 log(At/A0)=0.038 8t+0.137 8可以看出,此阻抑褪色反应系一级反应,相关系数r=0.990 1,反应的表观速率常数k=1.50×10-4/s,根据表观速率常数k可求出半衰期t1/2=0.693 2/0.038 8=17.866。
2.2.5 工作曲线
在最佳实验条件下,依据实验方法,改变硫酸铝溶液的加入量,测定体系的吸光度。所得到的ΔA绘制工作曲线。如图5所示。
由图5可以看出,Al3+浓度在0.04~0.4 μg/mL范围内符合比尔定律,回归直线方程为ΔA=0.722 7c+0.068 7(c的单位为μg/mL),相关系数r=0.9638。
2.2.6 精密度和检出限的测定
在最佳实验条件下,依据实验方法,以蒸馏水为参比,对Al3+含量为0.4 μg/mL的反应体系共测定11份,得到相对标准偏差(RSD)为1.355%;以蒸馏水做参比,平行测定11份试剂空白溶液,将其标准偏差的3倍除以工作曲线拟合方程的斜率作为检出限,得到方法的检出限为0.063 μg/mL。
2.2.7 干扰离子的影响
按照实验方法,对17种共存离子进行了干扰实验。在最佳实验条件下,对于含Al3+为0.4 μg/mL的反应体系进行测定,当相对误差控制在±5%以内时,下列共存离子或物质的允许倍数为:1倍的Sn4+、Ca2+、NH4+、Bi3+、Fe2+;2倍的Cr3+;3倍的Co2+;5倍的Ag+;8倍的Mg2+;10倍的Ba2+、Zn2+、Ni2+;12倍的Mn2+;15倍的Li+;23倍的Na+;38倍的Cd2+;64倍的Sr2+。
2.3 样品测定
采集地表水样和工业污水,经离心过滤,除去不溶性杂质,按文献方法进行处理后,在本实验方法下进行测定,同时做加标回收实验,结果见表7。

表7 样品含量测定结果(n=5)Table 7 The sample determination results (n=5)
3 结 论
本文依据Al3+对H2O2氧化甲基紫褪色反应具有阻抑作用的原理,建立了测定微量Al3+含量的动力学分光光度法,最大吸收波长为584 nm,实验中对反应条件进行了优化。该方法用于工业污水水样的测定,效果良好。

