一种基于NanoBiT 互补以发现SARS-CoV-2 S 蛋白与ACE2 结合抑制剂的高通量筛选方法
张志恒,刘建喜
(南通大学 特种医学研究院,江苏 南通 226019)
由严重急性呼吸综合征冠状病毒2 型感染引起的新冠感染(CoronaVirus Disease 2019,简称SARS-CoV-2),给世界各地的医疗服务和经济发展带来了困扰[1-2]。目前,新型冠状病毒感染肺炎已纳入我国传染病防治法规定的乙类传染病,世卫组织也宣布新冠疫情不再构成“国际关注的突发公共卫生事件”。但数据表明,65 岁以上人群,特别是男性,新冠感染后还有可能出现严重的症状[3]。再者,辉瑞公司注册的新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(即Paxlovid)价格昂贵,难以普及。因此,还需研发治疗新冠感染的新型药物。已有研究确认,ACE2 是SARS-CoV 的功能性受体[4],SARS-CoV-2 RBD 和ACE2 结合模式与SARS-CoV RBD 几乎相同[5]。因此,一个备受关注的治疗靶点是SARS-CoV-2 刺突蛋白与宿主受体ACE2 之间的相互作用[6],本文主要围绕ACE2 和RBD 设计实验方案展开研究。
药物再利用是为已批准或正在研究的药物确定新用途的过程,与新药发现过程相比,因其大大节约了时间和成本,而被视作一种非常有效的药物发现策略。包括植物提取物在内的传统中药具有潜在的抗冠状病毒能力,可用于治疗药物的开发[7-12]。因此,本文高通量筛选的化合物库包括自然活性化合物库和FDA 批准的药物库,其中一些化合物是中药材中的有效成分,以期为中药用于治疗新冠感染提供有益探索。
目前,对于发现SARS-CoV-2 的抗病毒药物的高通量筛选方法很多,包括虚拟筛选[13-14]、荧光共振能量转移(FRET)[15-16]、GFP 互补分裂方法[17]、基于ELISA 的高通量筛选[18]等。生物发光反应广泛用于高通量筛选,NanoLuc(NLuc)作为一种新型生物发光平台,与其他荧光素酶发光体系相比,具备更好的酶学稳定性、更小的分子量和更强的发光强度。此外,NLuc 的底物表现出更高的稳定性和更低的背景活性。因此,本文拟运用NLuc 发光系统开发新的高通量筛选方法,以发现SARSCoV-2 RBD 和ACE2 互作的抑制剂。
1 实验方法
1.1 化合物库
本研究中用于高通量筛选SARS-CoV-2 RBD 和ACE2 相互作用抑制剂的化合物库是FDA 批准的药物库(Targetmol 公司)和天然生物活性化合物库(Targetmol 公司)。化合物溶解于DMSO,浓度为10 mM,保存温度-80 ℃。
1.2 实验细胞
健康的人胚胎肾细胞HEK 293 购于Obio 公司,其细胞状态与培养条件都符合实验基本要求。
1.3 主要仪器和试剂
仪器:普通PCR 仪(Life Technology 公司)、琼脂糖凝胶电泳系统(六一公司)、电泳仪和转膜仪全套(Bio-Rad Laboratories 公司)、CO2细胞恒温培养箱(Thermo 公司)、核酸蛋白定量检测仪(Eppendorf 公司)、激光共聚焦显微镜SP8(Leica公司)、色红外激光成像系统(ODYSSEY 公司)、自动移液工作站(Apricot 公司)、多功能酶标仪(Tecan公司)、化学发光凝胶成像系统(Bio-Rad 公司)。
1.4 方法
1)细胞模型制备。DNA 片段RBD、ACE2、SmBiT 和LgBiT 由Genecreate 公司合成。在50 μL体系中用100 ng DNA 片段进行PCR 扩增,退火条件为60 ℃、20 s,延伸条件为72 ℃、10 s。在1 %琼脂糖凝胶中电泳,恒压150 V,22 min。在化学发光凝胶成像仪紫外照射下将目的片段切下并用MonarchDNA Gel Extraction Kit 回收DNA 片段。将载体pLVX-IRES-hyg 用XhoI 和XbaI 双酶切,100 μL 体系中各2 μL 酶,37 ℃,2 h。将目的片段与载体连接,10 μL 体系中加入2 μL DNA片段和1 μL 载体,50 ℃,15 min。在50 μL 感受态细胞中加入2 μL 连接产物,冰浴30 min 后42 ℃水浴热激40 s,用玻璃三脚架均匀涂抹在LB 固体培养基中,倒置于30 ℃培养箱内12~16 h。出现单菌落时用枪尖挑单克隆菌置入2 mL LB 液体培养基中,在摇床上培养,条件为30 ℃,220 r/min,12~16 h。用快速质粒DNA 小量提取试剂盒提取目标质粒后,进行酶切鉴定并送Genecreate 公司测序,确保序列正确。将目标质粒对应的菌进行大量培养,根据需求用高纯度质粒小提中量提取试剂盒或无内毒素质粒中量提取试剂盒进行大量提取质粒。将目标质粒转染HEK 293 细胞,将质粒与Lipofectamine 2000 以1∶3 比例混合均匀,静置20 min 后加入细胞培养基Opti-MEM 中,6 h 后换成完全培养基。
2)细胞免疫荧光。在12 孔细胞培养板中加入细胞爬片,每孔加入500 μL PDL 进行包被,用dd H2O 清洗后晾干。将转染24 h 后的细胞消化后铺至12 孔细胞培养板。第二天用PBS 将细胞清洗三次,摇床最慢速,每次3 min,再用4 %PFA 固定细胞,固定20 min,吸掉PFA,用PBS 清洗3 次,每次3 min,用1 % BSA 室温封闭2 h,将1 % BSA 吸出,加入配好的一抗,保持4 ℃过夜。第二天在室温复温1 h,细胞用PBS 在摇床上清洗3 次,每次清洗3 min,用0.01 M PBS 稀释二抗,在室温避光孵育2 h,用PBS 在摇床上清洗3 次,每次清洗3 min,避光,将细胞晾干,将载玻片从培养板中取出,盖玻片上加入封片剂,将载玻片反扣在盖玻片上。晾干后,在共聚焦显微镜下拍片。
3)蛋白质印迹。将转染24 h 后的细胞用预冷的PBS 洗2 遍,加入200 μL 配制好的裂解液,用细胞刮从皿底刮下细胞后,吸入1.5 mL EP 管中,冰浴30 min,14 000 r/min、20 min、4 ℃离心,将上清液吸至1.5 mL EP 管。蛋白定量后,确定每孔蛋白上样量为30 μg,配制蛋白上样体系后,100 ℃,5 min,进行蛋白变性。配制10 %下层分离胶和5 %上层浓缩胶,加样,开始电泳,恒压80 V,把电流调到最大,待marker 分开后电压调到110 V,待溴酚蓝到分离胶的底部时停止电泳。根据目的蛋白的分子量对照marker 的条带切割需要的部分,浸泡在转膜液中。PVDF 膜在甲醇中激活2 min,按照负极→多孔滤垫→滤纸→凝胶→PVDF 膜→滤纸→多孔滤垫→正极的顺序进行转膜,恒流300 mA,90 min。用5 %脱脂奶粉或者5 % BSA 在摇床上封闭2 h,用5 %脱脂奶粉或者5 % BSA稀释抗体,4 ℃孵育一抗过夜。第二天将膜从冰箱中取出,室温放置1 h,回收抗体,膜用TBST 缓冲液缓慢摇动洗涤15 min,共洗3 次,用5 %脱脂奶粉或者5%BSA 稀释二抗,室温避光孵育2 h,回收抗体,膜用TBST 缓冲液缓慢摇动洗涤15 min,共洗3 次,使用Odyssey 红外成像机器显影。
4)优化药物筛选条件。将转染RBD-SmBiT和LgBiT-ACE2 24 h 和48 h 的细胞上清收集起来,分别用DMEM 稀释2 倍、4 倍、8 倍、16 倍和32倍,每孔加入10 μL RBD-SmBiT 和10 μL LgBiTACE2,离心。将5 μL 含有0%、0.25%、0.5%、1%等不同浓度DMSO 的DMEM 加到孔中以构成25 μL 体系,离心。加入25 μL Nano-GloHiBiT Extracellular Detection System 检测试剂。离心,用Tecan Spark 多功能酶标仪读板。荧光检测时间分别为加检测试剂后1 min、5 min、10 min、15 min。
5)筛药流程。用移液工作站在384 孔板每孔中加入10 μL 稀释的RBD-SmBiT。将5 μL 100 μM的化合物加入板中,混合并离心到孔底。将板在室温下放置30 min,以使化合物与RBD 完全结合。A2-D2 为0.5 % DMSO,M23-P23 为100 nM 未标记的RBD。加入10 μL 稀释的LgBiT-ACE2,混合并离心。所有板在室温下放置30 min。每孔加入25 μL Nano 荧光检测试剂,混匀,离心。室温孵育10~20 min 后,读板。
1.5 统计学分析
使用GraphPad Prism(version 8.01)进行数据统计分析和绘图。计算Z′因子,公式为Z′=1-,其中:σ 为标准差,μ表示平均值,c+是阳性对照,c-是阴性对照。
2 实验与结果
2.1 实验设计
NanoBiT 的检测原理是将荧光素酶亚基LgBiT 和低亲和力SmBiT 融合至两个能够相互作用的蛋白质末端。推测SmBiT 和LgBiT 间亲和力较低,不易互相结合,只有当RBD 和ACE2 结合时,才能将SmBiT 和LgBiT 带到一起,互补形成功能复合体,使荧光素酶具备活性,此时加入底物将会有荧光。当有理想的小分子化合物阻断RBD和ACE2 相互作用时,荧光素酶将不具备活性,加入底物将不会有荧光(如图1),从而可筛选出小分子化合物。
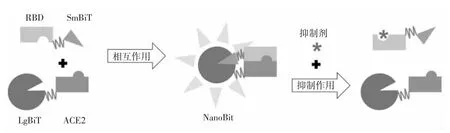
图1 ACE2/RBD-NanoBiT 检测设计
图1 中,ACE2 和RBD 与NanoBiT 融合,三角形部分是SmBiT 的短肽,圆形部分是LgBiT 的长肽,长方形部分分别是RBD 和ACE2。当ACE2和RBD 的相互作用被理想的抑制剂阻断时,两个荧光素酶亚基分离,失去酶活性,不会催化底物产生荧光。
2.2 RBD-SmBiT 和LgBiT-ACE2 荧光素酶活性的表达
构建LgBiT-ACE2,SARS-CoV-RBD-SmBiT和SARS-CoV-2-RBD-SmBiT 的过表达质粒,过表达质粒在10 %琼脂糖凝胶电泳中的成像如图2。为确定设计的RBD-SmBiT 和LgBiT-ACE2能分泌至细胞培养基中并具有荧光素酶活性,在12 孔板中将少量pLVX-RBD-SmBiT-hyg 和pLVX-LgBiT-ACE2-hyg 转染HEK 293 细胞。转染48 小时后,在细胞膜上检测到少量绿色荧光信号,如图3a)、b)、c)。
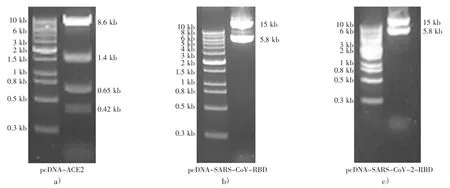
图2 LgBiT-ACE2,SARS-CoV-RBD-SmBiT和SARS-CoV-2-RBD-SmBiT 过表达质粒
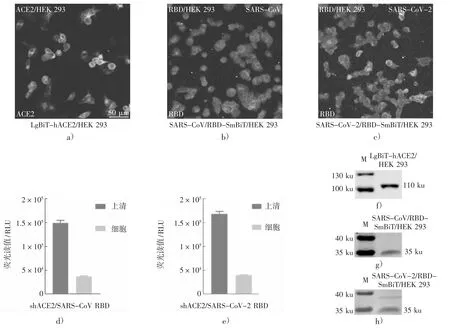
图3 ACE2/RBD-NanoBiT 的表达
转染48 h 后分别收集细胞培养基和细胞。用PBS 洗涤细胞两次以去除培养基中任何可能的分泌荧光素酶。测量20 μL 上清液和20 μL 完全培养基中10 k 细胞的荧光素酶活性。结果表明,RBD-SmBiT 和LgBiT-ACE2 主要分泌至细胞培养基,RLU 为150 k,而在细胞中表达较少,只有37 k RLU,如图3d)。对于SARS-CoV-2,RLU 值分别为170 k 和40 k,如图3e)。未转染的细胞和相应上清液的发光背景为50~200 RLU。
用25 μL 上清液进行进一步免疫印迹实验,检测到大小约110 ku 的蛋白质条带,接近LgBiTACE2 的预期值,如图3f)。检测到的大小为35 ku的蛋白质接近于RBD-SmBiT 的预期值,如图3g)、h)。表明所设计的ACE2/RBD-NanoBiT 实验满足进一步测定的要求。
综上可知:图3 中a)—c)显示在转染48 h后细胞表面检测到少量LgBiT-ACE2 和RBDSmBiT;d)、e)表明LgBiT-ACE2 和RBD-SmBiT主要分泌到细胞培养基中;f)—h)表明细胞表达的LgBiT-ACE2 和RBD-SmBiT 的分子量接近预期大小。
2.3 ACE2/RBD-NanoBiT 检测的优化
用于筛选数千种化合物的高通量筛选分析方法需要广泛优化和评估,以验证分析其性能是否满足要求。RBD-SmBiT 和LgBiT-ACE2 的小样本实验经过荧光素酶测试后,用慢病毒转导的HEK 293细胞产生了大量的RBD-SmBiT 和LgBiT-ACE2。
首先,对RBD-SmBiT 和LgBiT-ACE2 进行稀释倍数的优化。纯化的RBD-SmBiT 和LgBiTACE2 分别稀释2、4、8、16 和32 倍,荧光素酶的信号最高达1000 k RLU 左右,见图4a)。根据发光值确定RBD-SmBiT 稀释4 倍,LgBiT-ACE2 稀释2 倍。
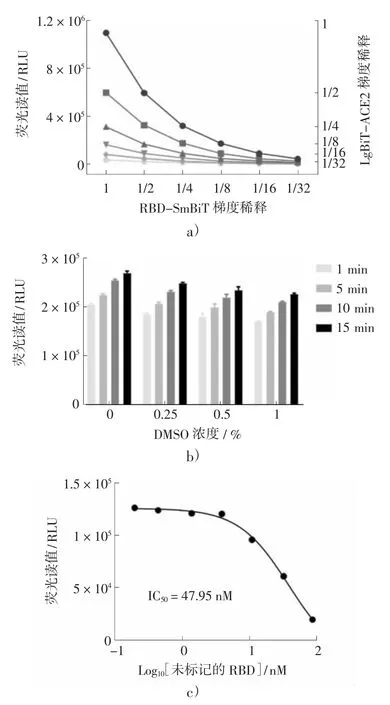
图4 ACE2/RBD-NanoBiT 检测的优化
图4 中,a)为优化RBD-SmBiT 和LgBiTACE2 的稀释倍数。将纯化的蛋白质分别稀释2,4,8,16 和32 倍,然后以1 ∶1 的体积比加入检测试剂,试剂添加1,5,10,15 min 后收集信号;b)为优化DMSO 浓度。将稀释的RBD-SmBiT、LgBiT-ACE2 与0,0.25 %,0.5 %,1 % DMSO 混合后加至384 孔板,再加入检测试剂,1,5,10,15 min 后测量发光值;c)为在稀释好的RBDSmBiT、LgBiT-ACE2 和0.5 % DMSO 体系中,测量未标记RBD 的IC50。
其次,优化反应体系中合适的DMSO 浓度。将2 倍稀释的LgBiT-ACE2 和4 倍稀释的RBDSmBiT 与0 %,0.25 %,0.5 %,1 % DMSO 混合,加至384 孔板内检测。结果表明,0.5 % DMSO 既使化合物保持良好溶解,又能保持酶活性不受明显影响,见图4b)。
最后,为了验证酶的特异性,在2 倍稀释的LgBiT-ACE2、4 倍稀释的RBD-SmBiT 和0.5 %DMSO 体系中,用未标记的RBD 在384 孔板中进行评估。未标记RBD 的IC50为47.95 nM,如图4c)。结果表明,所建立的ACE2/RBD-NanoBiT 检测适用于高通量筛选以发现ACE2 和RBD 互作的抑制剂。
2.4 采用ACE2/RBD-NanoBiT 方法高通量筛选药物
在优化测定关键条件后,将小型的预实验转为以384 孔板的格式进行药物筛选。原始化合物库以384 孔格式购买,浓度为10 mM。子化合物库用含2.5 % DMSO 的DMEM 稀释为100 μM。在第3 列和第22 列之间测试了化合物。详细过程见图5。
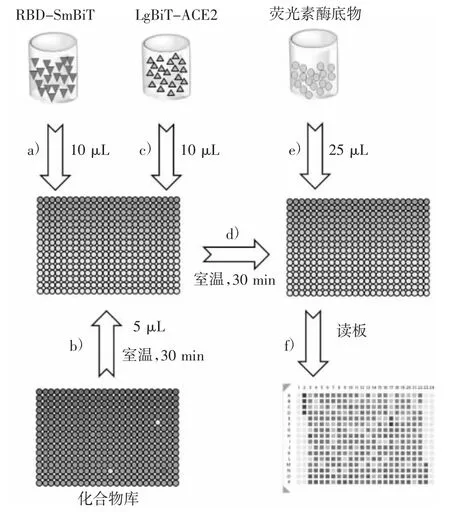
图5 SARS-CoV-2 RBD 与ACE2 互作抑制剂的高通量筛选过程
图5 中:a)用移液工作站在384 孔板每孔中加入10 μL 稀释的RBD-SmBiT;b)将5 μL 100 μM的化合物加入板中,混合并离心到孔底,将实验板在室温下放置30 min,以使化合物与RBD 完全结合,A2-D2 为0.5 % DMSO,M23-P23 为100 nM未标记的RBD;c)加入10 μL 稀释的LgBiTACE2,混合并离心;d)所有实验板在室温下放置30 min;e)每孔加入25 μL 检测试剂,混匀,离心;f)室温孵育10~20 min 后,读板。
使用优化的ACE2/RBD-NanoBiT 测定法共筛选6 400 种化合物,其中10 块板药物来自FDA批准的药物库,另外10 块来自天然生物活性化合物库。每板设置4 孔阳性对照(100 nM 未标记的RBD)和阴性对照(0.5 % DMSO)进行质量控制。对照实验显示,阴性和阳性对照间产生了较大的分离带,HTS Z′=0.7。结果证明了该方法的可靠性,见图6a)。所有数据点都用对应实验板中的阴性对照进行归一化处理,散点分布如图6b)所示。

图6 ACE2/RBD-NanoBiT 检测的评估
图6a)为每块板设置4 孔阳性对照(100 nM未标记的RBD)和4 孔阴性对照(0.5 % DMSO),共筛选了20 块化合物板所绘制的散点图。由图6b)可见,共测试了6 400 种化合物,多数是不影响RBD 和ACE2 的沉默化合物,样品值与对照值的比值在1 左右,比值小于0.5 的化合物被认为具有抑制作用。
3 结论
本文所开发的NanoBiT 互补方法对蛋白—蛋白相互作用具有更加突出的准确性,小蛋白标签对目的蛋白构象干扰小。大多数实验室可开展类似实验,对一些化合物进行小批量蛋白互作抑制剂活性分析。该测定法具有灵敏度高、速度快、信号强、成本可控等优点,检测相对简单、经济,也可用于高通量筛选,具有一定的普遍适应性。
NLuc 能很好地应用于高通量筛选受体或蛋白相互作用的激动剂和抑制剂。如使用NLuc作为报告基因来检测细胞膜上受体内在化的情况[19],利用NLuc 荧光素酶高通量筛选抗体[20]。NLuc 可以分成HiBiT 和LgBiT 两个亚基[21],或SmBiT 和LgBiT两个亚基。其区别是,HiBiT 与LgBiT 的亲和力比SmBiT 与LgBiT 的亲和力高,前两者能自发形成NLuc 功能性复合物,而后两者因较低的亲和力,不易自发形成完整的NLuc 荧光素酶。SmBiT 与LgBiT 的结合需要借助外力,当两个蛋白相互作用时,才能把两个NLuc 亚基带到一起,此时距离足够近,两个亚基才能互补形成NLuc。
通常在初次高通量筛查中存在许多假阳性命中。在多数情况下,主要命中率约为2 %~3 %[22]。在ACE2/RBD-NanoBiT 分析中,剔除明显的假阳性命中后[23],如果将抑制效果为60 %的化合物作为潜在抑制剂,则有136 个(2.12 %)命中,表明命中百分比相对合理。假阴性和假阳性命中可能由多种因素引起,包括但不限于以下原因:第一,与NLuc 结合并抑制NLuc 活性的化合物可能模拟ACE2 和RBD 的抑制剂;第二,激活NLuc 荧光素酶的化合物可以模拟ACE2 和RBD 的激活剂。因此,NLuc 报告基因检测也有局限性。与萤火虫荧光素酶不同[24],目前还没有NanoLuc 抑制剂的参考资料。但是这种情况可以通过采用类似策略的平行筛选来避免。因此使用ACE2/RBD-NanoBiT和Mpro-NanoBiT 两种NanoBiT 的检测方法,一方面是对SARS-CoV-2 多靶点的筛选,另一方面是采用平行筛选来排除假阳性。
下一步将对筛选到的潜在抑制剂进行抗病毒有效性验证。将用新冠病毒假病毒(义翘)侵染hACE2 表达的HEK 293 细胞验证小分子的抗病毒有效性[25]。当确定抗病毒活性后,在给药与不给药的条件下,利用病毒感染小鼠肺组织,并通过组织切片来评估化合物抑制SARS-CoV-2 病毒侵染小鼠肺上皮细胞的能力,评估药物对SARSCoV-2 诱导肺损伤的疗效,并检测给药后小鼠体重、肺损伤和致死率。

