高活性石灰烧制过程的热力学与动力学分析
钟玲萍,张庆年,陈小鹏,覃玲意,陈 奇,3
(1.广西碳酸钙产业化工程院有限公司,广西 南宁 530004;2.崇左南方水泥有限公司,广西 崇左 532200;3.广西大学化学化工学院,广西 南宁 530004)
石灰在无机纳米材料、钢铁冶金、电石工业、造纸业、制糖业、建筑业、农牧渔业和环境保护等行业均被广泛使用[1-4]。石灰质量的优劣常用活性度来衡量,活性度反映了石灰与其他物质的反应能力[5-8]。根据行业标准中测定石灰活性度的方法即盐酸滴定法,于3000mL 烧杯中,取50g 石灰加入2000mL 温度为40℃的水中,用4mol·L-1盐酸滴定,在10min 内所消耗的盐酸体积(mL)即为石灰的活性度[9-10]。当石灰中CaO 的含量为100%时,滴定消耗的44mol·L-1盐酸量为446.5mL,即为石灰的理论活性度最高值。用传统工艺烧制的石灰,其活性度一般在180~360mL 左右,工业生产的石灰,活性度较难达到400mL 以上,因此石灰的价格为人民币300~1200 元·t-1。钢铁冶金、水处理、纳米碳酸钙制造等行业对石灰活性度的要求较为苛刻[11-13]。为了解决高活性石灰烧制的理论问题,本文对石灰烧制过程中的热力学与动力学进行了分析研究。
1 不同活性度石灰的应用效果
为了阐明石灰活性度在实际应用中的重要性,对不同活性度的石灰进行了中和反应和碳化反应的实验研究,实验结果见表1。

表1 不同活性度的Ca(OH)2 溶液的中和反应和碳化反应的实验结果
由表1 可知,不同活性度的石灰与酸性污水的中和反应,以及石灰与CO2的碳化反应的能力差异非常大。若以活性度为180mL 的Ca(OH)2进行酸性污水处理的中和反应,不仅反应时间长,还会剩余22.46%的“生烧”或“过烧”的石灰残渣,造成污水处理过程的二次污染。若以活性度仅为180mL、浓度为8%的Ca(OH)2溶液与CO2进行碳化反应制备轻质碳酸钙(PCC),由于反应速度很慢,初始反应生成的碳酸钙晶核很少,则后继生成的碳酸钙会不断沉积在原有的晶核上,使得碳酸钙固体颗粒逐渐长大,因此制备得到的碳酸钙粒径为40μm。若以活性度为425mL 的高活性度石灰进行酸性污水处理的中和反应,反应时间仅为1.2min,且无剩余残渣生成。以活性度为425mL 的高活性Ca(OH)2为原料进行碳化反应,由于反应速度很快,会瞬间生成大量的碳酸钙晶核,因此制备得到的纳米碳酸钙粒径为30~80nm。纳米碳酸钙是一种新型固体多功能材料,广泛应用于橡胶、塑料、涂料、油墨、润滑油、食品和医药等行业[14-16]。由于纳米碳酸钙的生产成本低,原料来源广,生产过程基本无“三废”排放,所得产品具有纯度高、白度高、无毒、无臭、无味、分散性好、热稳定性高、吸油率低、价格低廉等优良特性,因此多功能纳米碳酸钙是一种绿色环保材料。
2 热力学分析
2.1 CaCO3 热分解生成 CaO
石灰石的主要成分为 CaCO3,CaCO3热分解生成 CaO 的反应式为:
式中,KP为平衡常数;T为反应温度;为反应标准摩尔焓;R为气体摩尔常数。
因为CaCO3的热分解反应为吸热反应,则ΔHθ>0,而RT2也为正值,由式(2)可得即提高温度T,KP也随之增大,因此温度升高对CaCO3的热分解有利。
为了防止CaCO3“生烧”或“过烧”,控制CaCO3的煅烧温度和时间是关键,为此必须从热力学角度分析CaCO3的热分解起始温度。
由van’t Hoff 等压方程积分式可推导出热分解反应温度计算式为:
式中,T1为标准态温度,298.15K;和为热分解反应的标准焓和标准自由焓。
由文献[18]可查得CaCO3(s,方解石)、CaO (s)和CO2的标准焓和标准自由焓,则:
将上述数据代入式 (3),计算得到 CaCO3热分解生成 CaO 的起始温度为:
采用热重分析仪(TG)测定石灰石(CaCO3含量为98.8%)的热分解温度,结果见图1。由图1 可知,CaCO3的实际起始分解温度为880K(607℃),反应速率峰值温度为1088K(815℃)。
2.2 CaCO3 热分解直接生成Ca(OH)2
假设 CaCO3热分解直接生成 Ca(OH)2,则反应式为:
从文献[18]可查得 CaCO3、Ca(OH)2、H2O 和 CO2的标准焓和标准自由焓,则:
由上述计算可知,反应式(4)的吸热量比反应式(1)少,若采用反应式(4)直接制备 Ca(OH)2(熟石灰),则可节省能量:178.321-69.139=109.182kJ·mol-1。
将数值代入式 (3),计算得到反应式(4)热分解生成Ca(OH)2的起始反应温度为:
虽然采用反应式(4)直接制备熟石灰可节省能量 109.182kJ·mol-1,但由上述计算可知,反应式(4)的热分解温度高达4183℃,在实际生产中难以实现。
3 动力学分析
由反应式(1)可知,CaCO3的热分解反应是气(g)-固(s)非均相反应,因此CaCO3的热分解反应动力学涉及气-固传递问题,只有促进CaCO3的热分解传递过程,才能加快CaCO3热分解的反应速率。
3.1 CaCO3 热分解传递过程分析
CaCO3热分解传递过程见图2。由图2 可知,CaCO3热分解气-固反应系统必须经历如下步骤:
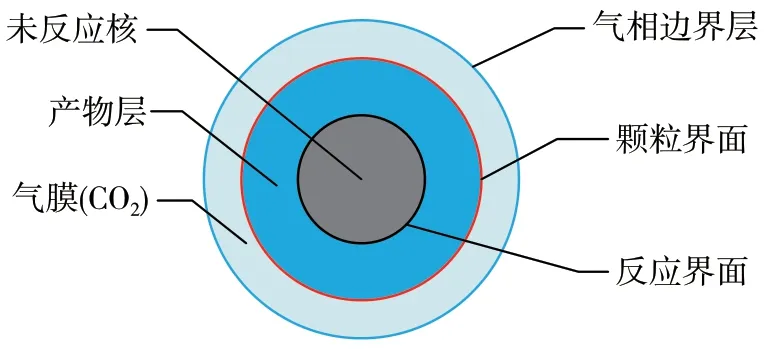
图2 CaCO3 热分解传递过程
1)热流主体经气膜传递到CaCO3颗粒界面(外扩散),再从颗粒界面经产物层传递到反应界面(内扩散);
2)当传递的热量使得反应界面达到热分解温度时,CaCO3发生热分解反应,生成CaO(s)和CO2(g)(表面反应);
3)CO2从反应界面经产物层扩散到颗粒界面(内扩散),再经气膜扩散到热流主体(外扩散)。由于气膜中富含CaCO3热分解生成的CO2,不仅造成了外扩散阻力,还会因反应产物CO2积累而引起对CaCO3热分解的反馈抑制作用,因此消除气膜阻力非常重要。
CaCO3热分解反应步骤也可简化描述为:外扩散→内扩散→热分解反应→内扩散→外扩散。根据CaCO3热分解反应历程,若要提高CaCO3热分解反应的速率,必须消除内、外扩散阻力的影响。消除外扩散阻力影响的方法是减少气膜层的厚度,而减少气膜层厚度的办法是加快石灰窑内气体的流动速度,由此减薄固体颗粒表面的滞流层厚度。消除内扩散阻力影响的方法是减少产物层的厚度,把CaCO3颗粒粒径变小,缩短内扩散的路径,即可消除内扩散阻力的影响。
3.2 CaCO3 热分解反应速率方程
由反应式(1)可得 CaCO3热分解反应速率方程为:
根据 Arrhenius 方程,式(5)中的热分解反应常数k为:
由式(5)可见,固体CaCO3的浓度CCaCO3很难改变,只有增大反应速率常数k值,才能提高CaCO3热分解反应的速率。由式(6)可知,提高CaCO3热分解反应温度T,则k值增大, CaCO3热分解反应速率随之加快。
4 CaCO3 热分解反应条件的优化
CaCO3热分解反应的影响因素主要有温度、CO2压力、气体流动速率(外扩散阻力)和CaCO3粒径(内扩散阻力)。增大石灰窑内气体的流动速率,石灰石颗粒外表面的滞流层厚度会减薄,有利于消除外扩散阻力,降低CO2分压;CO2压力减小,有利于CaCO3热分解反应的化学平衡;石灰石(CaCO3)的粒径减小时,内扩散的路径缩短了,有利于消除内扩散阻力。CaCO3热分解反应为吸热反应,则反应焓变为正值,由式(2)可得,温度对化学平衡的影响为:
即反应温度提高时,CaCO3热分解反应的平衡常数KP增大,有利于CaCO3热分解反应朝着生成CaO 的方向移动。由式(6)可知,当CaCO3热分解反应的温度T提高时,有利于增大 CaCO3热分解反应的速率常数k值;k值增大,由式(5)可知,CaCO3热分解反应的速率加快。采用热力学和动力学理论对CaCO3热分解反应温度进行分析可知,升高温度有利于提高化学平衡和反应速率,即反应温度越高越好,但受到石灰窑体制造材料的限制,选择 CaCO3热分解反应温度为1000 ℃左右较适宜。
5 结论
1)采用van’t Hoff 等压方程得到的CaCO3热分解为CaO 的理论温度为1109.5K (836.35℃),通过热重分析测得的石灰石(CaCO3含量为98.8%)的实际热分解温度为1088K (815℃)。若CaCO3直接热分解为Ca(OH)2,则可节能109.182kJ·mol-1,但其最低热分解温度为4456.1K (4183℃),在实际生产中难以实现。
2)石灰石气-固相热分解的步骤为:外扩散→内扩散→热分解反应→内扩散→外扩散。提高石灰窑内的气体流速和减少石灰石(CaCO3)的粒径,可以消除石灰石热分解反应过程的内、外扩散阻力。
3)采用热力学和动力学理论,对CaCO3热分解反应温度进行分析,结果表明,提高 CaCO3热分解反应温度,有利于CaCO3热分解反应的化学平衡,提高热分解反应速率,但受到石灰窑体制造材料的限制,选择CaCO3热分解反应温度为1000℃左右较适宜。

