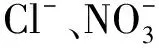大豆GmCLC-d1/d2基因参与盐胁迫适应过程的生理功能
张露,黄巧玥,程聪,2,刘询,於丙军*
(1.南京农业大学生命科学学院植物逆境生物学实验室,江苏 南京 210095;2.新疆农业大学生命科学学院,新疆 乌鲁木齐 830052)

1 材料与方法
1.1 植物材料、菌株和质粒
植物材料包括拟南芥(Arabidopsisthaliana, Col-0野生型,WT)、本氏烟草(Nicotianabenthamiana)、栽培大豆(G.max)品种‘Lee68’。菌株包括大肠杆菌DH5α、根癌农杆菌株GV3101和发根农杆菌株K599。双元表达质粒包括pFGC5941和PBI101。
1.2 方法
1.2.1 基因结构和氨基酸序列特征分析根据本实验室前期研究报道[14],从大豆数据库Phytozome数据库(https://phytozome-next.jgi.doe.gov/phytozome/)下载GmCLC-d1(Glyma.01G239000)和GmCLC-d2(Glyma.11G004600)的基因序列、CDS序列和所编码蛋白的氨基酸序列。利用GSDS在线工具(http://gsds.gao-lab.org/index.php)分析GmCLC-d1和GmCLC-d2的基因结构[18]。利用DNAMAN V9.0软件(https://www.lynnon.com/dnaman.html,Lynnon BioSoft,Quebec)对GmCLC-d1和GmCLC-d2的氨基酸序列进行比对。
1.2.2 大豆幼苗培养、RNA提取和qPCR大豆种子用75%乙醇消毒后浸泡于去离子水中,4 h后将种子转移至铺有湿润吸水纸的塑料盘中,置于培养箱(28 ℃)暗中催芽。挑选发芽良好、一致的种子播种于含蛭石的塑料周转箱中,用1/2 Hoagland营养液浇灌后,放于植物生长室进行培养,培养条件:昼、夜温度分别为(25±2)℃和(18±2)℃,光照强度100 μmol·m-2·s-1,相对湿度60%~70%。待第1三出复叶完全展开后,将大豆幼苗分成2组,一组继续用1/2 Hoagland营养液浇灌(Control),另一组用含150 mmol·L-1NaCl的1/2 Hoagland营养液浇灌(NaCl)[14],分别于1、3、8 h取叶片(均为3组生物学重复),迅速用液氮冷冻后于-80 ℃保存备用。使用RNA提取试剂盒(Spin Column Plant Total RNA Purification Kit,上海生工)提取总RNA。使用ABI 7500型荧光定量PCR仪进行qPCR检测,20 μL反应体系包含10 μL Hieff qPCR SYBR Green Master Mix(YEASEN),8 μL ddH2O,引物F和R各0.5 μL。以大豆TUB(Glyma.08G014200)为内参基因,用2-ΔΔCT法计算相对表达量[19]。引物如表1所示。

表1 本研究中使用的引物Table 1 Primers used in this study
1.2.3 载体构建选择GmCLC-d1和GmCLC-d2起始密码子ATG上游1 500 bp的序列作为基因的启动子区,设计引物,分别克隆得到GmCLC-d1和GmCLC-d2的启动子片段,插入PBI101载体,使其控制GUS基因表达,即得到重组载体GmCLC-d1pro∶∶GUS和GmCLC-d2pro∶∶GUS。基于GmCLC-d1和GmCLC-d2的CDS相似性很高,选择二者完全相同的200 bp序列作为RNAi靶序列,通过正向、反向分别插入pFGC5941载体CHSA内含子的上、下游获得重组RNAi载体RNAi-GmCLC-d1/d2。分别克隆GmCLC-d1和GmCLC-d2的全长CDS序列,插入pFGC5941载体35S启动子下游,分别获得重组过表达载体OE-GmCLC-d1和OE-GmCLC-d2。重组载体GmCLC-d1pro∶∶GUS、GmCLC-d2pro∶∶GUS、OE-GmCLC-d1和OE-GmCLC-d2分别导入根癌农杆菌GV3101用于拟南芥遗传转化,空载体(pFGC5941)、基因沉默载体RNAi-GmCLC-d1/d2和过表达载体OE-GmCLC-d1、OE-GmCLC-d2分别转化发根农杆菌K599用于构建大豆发根组合植株。构建载体所用引物及序列见表1。
1.2.4 烟草叶片瞬时转化和GUS染色将含有重组载体GmCLC-d1pro∶∶GUS或GmCLC-d2pro∶∶GUS的根癌农杆菌GV3101接种于含有50 mg·L-1卡那霉素和50 mg·L-1利福平的LB液体培养基,28 ℃、200 r·min-1振荡培养48 h。待菌液D600=1.0时,离心收集菌体后用含200 μmol·L-1乙酰丁香酮(acetosyrin-gone,AS)的10 mmol·L-1MgCl2溶液重悬,然后于25 ℃黑暗静置2 h。取生长4周的本氏烟草,使用注射器将菌体重悬液注射到其叶片中,注射后的烟草正常生长12 h后,用200 mmol·L-1NaCl溶液处理,正常培养的烟草作为对照(Control)。处理 24 h后取叶片进行GUS染色,最后用无水乙醇除去叶绿素观察着色深浅[20]。
1.3 数据分析
以上各试验均重复3次。应用SPSS 20.0软件对试验数据进行均值、标准差、差异显著性分析。
2 结果与分析
2.1 GmCLC-d1/d2基因及其编码蛋白氨基酸序列特征


图1 GmCLC-d1/d2基因及其编码蛋白氨基酸序列特征Fig.1 Sequence characteristics of GmCLC-d1/d2 genes and their coding protein amino acidsA. 基因结构;B.氨基酸序列多重对齐和保守结构域。T1—T9:跨膜结构域;CBS:胱硫醚-β-合成酶结构域。A. Gene structure;B. Amino acid sequence multiple alignment and conserved domain. T1-T9:Transmembrane domains;CBS:Cystathionine-β-synthase domain.
2.2 GmCLC-d1/d2基因及启动子对盐胁迫的响应模式
qPCR结果显示,正常培养(Control)的大豆幼苗叶片GmCLC-d1和GmCLC-d2基因的表达维持在相对稳定的水平,但在150 mmol·L-1NaCl处理8 h过程中,两者的表达水平均显著上调,上调倍数分别达28.7和15.6倍(图2-A)。分别将GmCLC-d1和GmCLC-d2基因的启动子片段克隆到PBI101载体的uidA(GUS)基因上游,得到重组载体GmCLC-d1pro∶∶GUS和GmCLC-d2pro∶∶GUS。经根癌农杆菌介导烟草叶片瞬时表达后,在200 mmol·L-1NaCl处理24 h时,GmCLC-d1pro∶∶GUS和GmCLC-d2pro∶∶GUS转化的烟草叶片GUS染色程度较转空载明显加深(图2-B)。这说明GmCLC-d1和GmCLC-d2基因及其启动子都能够响应盐胁迫诱导,基因表达水平明显增强。
2.3 GmCLC-d1/d2干扰或过表达大豆发根组合植株耐盐性分析
在正常培养条件下,转空载、RNAi-GmCLC-d1/d2、OE-GmCLC-d1和OE-GmCLC-d2大豆发根组合植株的生长表型、植株鲜重、叶片RWC、叶绿素含量、根和叶REL和MDA含量均无明显差异(图3)。经120 mmol·L-1NaCl处理7 d后,上述4种大豆材料的生长均受到明显抑制,其中RNAi-GmCLC-d1/d2植株受盐害最严重,植株表现矮小,叶片干枯发黄,植株鲜重、叶片RWC和叶绿素含量都显著低于转空载植株,根和叶REL和MDA含量均显著升高;而OE-GmCLC-d1和OE-GmCLC-d2植株生长相对较好,在植株表型和鲜重、叶片RWC、叶绿素含量、REL以及MDA含量等生理指标方面均显著优于RNAi-GmCLC-d1/d2植株(P<0.05),且已恢复到转空载植株的水平,其中OE-GmCLC-d2植株部分指标,如叶片叶绿素含量、根REL及MDA含量已明显优于转空载植株(图3-B、C)。此外,正常培养条件下4种大豆植株根和叶的CAT、POD和SOD活性均无明显差异,但经120 mmol·L-1NaCl处理7 d时,与对照相比,上述植株根和叶的抗氧化酶活性均显著增强,其中RNAi-GmCLC-d1/d2植株增幅最小,并显著低于转空载、OE-GmCLC-d1和OE-GmCLC-d2植株(图3-D)。盐胁迫下OE-GmCLC-d1和OE-GmCLC-d2植株根和叶CAT、POD和SOD活性均明显高于转空载植株,其中OE-GmCLC-d2植株根和叶POD及根SOD活性都显著高于转空载植株(图3-D)。

图3 盐胁迫对RNAi-和OE-GmCLC-d1/d2大豆发根组合植株表型和生理指标的影响Fig.3 Effects of NaCl stress on plant phenotype and physiological indexes of RNAi- and OE-GmCLC-d1/d2 soybean hairy root composite plants A. 生长表型;B. 单株鲜重、叶片相对含水量和叶绿素含量;C.根和叶相对电解质渗漏率和丙二醛含量;D.抗氧化酶(CAT、POD和SOD)活性。A. Growth phenotype;B. Plant fresh weight,leaf RWC and chlorophyll content;C. REL and MDA content in root and leaves;D. Activities of antioxidant enzymes(CAT,POD and SOD).

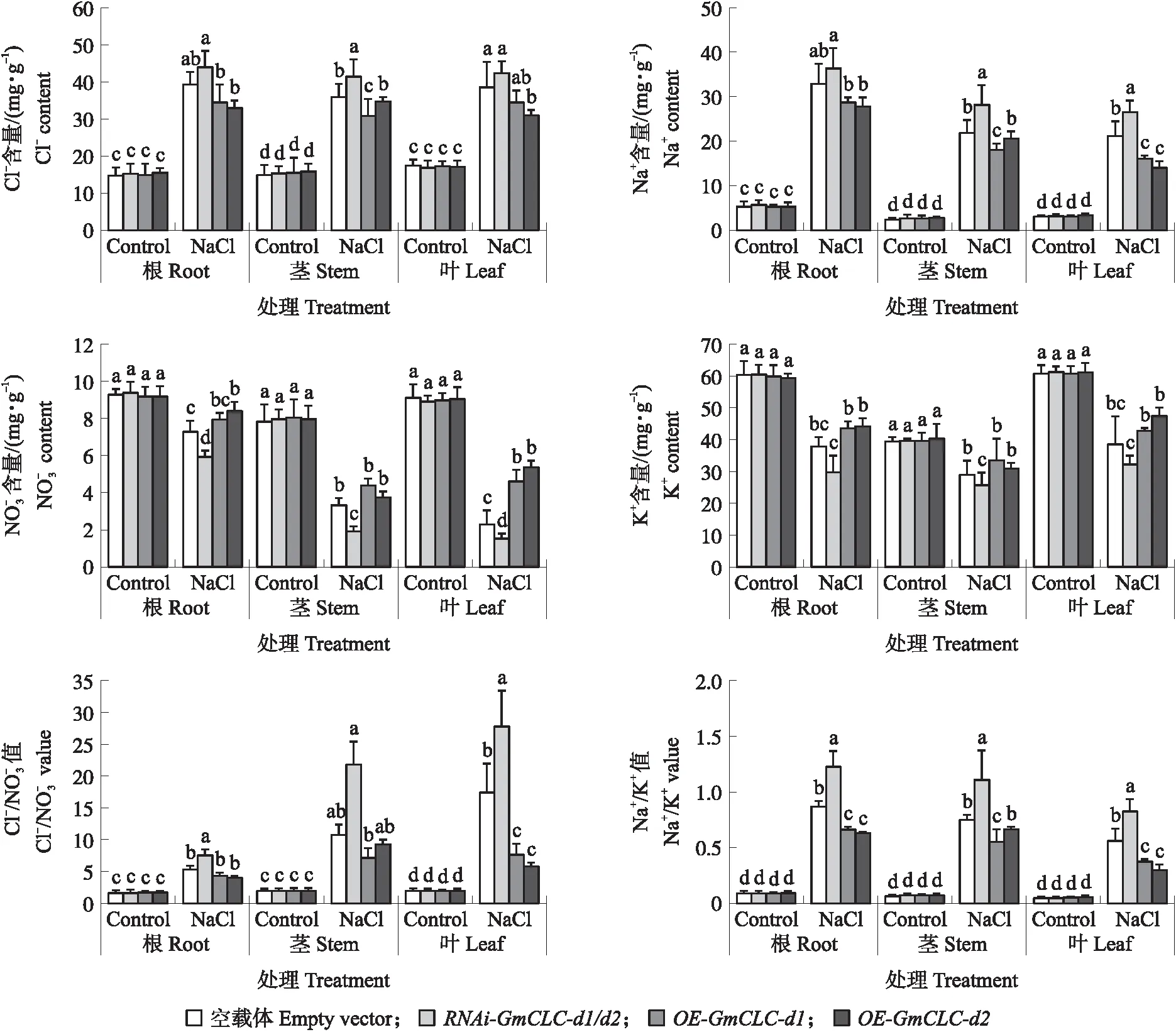
图4 盐处理下RNAi-和OE-GmCLC-d1/d2大豆发根组合植株根、茎、叶中离子含量的变化Fig.4 Changes of ions in roots,stems and leaves of RNAi- and OE-GmCLC-d1/d2 soybean hairy root composite plants under NaCl treatment
2.4 过表达GmCLC-d1/d2拟南芥耐盐性分析
利用根癌农杆菌介导的浸花法转化拟南芥,通过喷洒5 mg·L-1草铵膦溶液获得抗性植株,提取抗性植株叶片DNA进行PCR鉴定,最终分别获得过表达GmCLC-d1或GmCLC-d2基因的拟南芥OE-GmCLC-d1和OE-GmCLC-d2(图5-A),收获并鉴定T3代纯合子进行试验。在正常培养条件下,拟南芥WT、OE-GmCLC-d1和OE-GmCLC-d2的种子萌发率未见明显差异,5 d时都可达96%左右;在100 或125 mmol·L-1NaCl处理下,上述3种拟南芥材料的萌发率都明显下降,5 d时WT萌发率仅分别为26.13%和14.29%,但过表达材料,特别是OE-GmCLC-d2可维持相对于WT较高的萌发率,5 d时可分别达到32.41%和25.91%(图5-B)。正常培养7 d的3种拟南芥幼苗的根长无明显差异;在100或150 mmol·L-1NaCl处理下,OE-GmCLC-d1和OE-GmCLC-d2幼苗的根长均明显大于WT,特别是150 mmol·L-1NaCl处理下,上述过表达材料根长分别是WT的1.86和2.63倍,且差异显著(图5-C)。类似的现象也出现在盆钵土培过表达拟南芥植株中,尤其是OE-GmCLC-d2植株在盐处理下的伤害症状相对较轻,具体可体现在植株表型差异和植株鲜重、叶片RWC、叶绿素含量、REL和MDA含量等指标的变化较小(图6-A、B)。此外,盐处理也导致拟南芥WT、OE-GmCLC-d1和OE-GmCLC-d2植株地上部有关的抗氧化酶(CAT、POD和SOD)活性都明显上升,OE-GmCLC-d1和OE-GmCLC-d2植株的升幅明显高于WT(图6-C)。

图5 盐处理下过表达GmCLC-d1/d2拟南芥种子萌发率和幼苗根长的变化Fig.5 Changes in seed germination rate and root length of seedlings of OE-GmCLC-d1/d2Arabidopsis thaliana under NaCl treatment A. 过表达GmCLC-d1/d2基因拟南芥筛选和PCR鉴定;B. MS和含NaCl的MS培养基上种子萌发率;C. MS和含NaCl的MS培养基幼苗的根长,bar=1.0 cm。A. Screening and PCR identification of OE-GmCLC-d1/d2 A. thaliana lines;B. Germination rate of seeds under MS medium and MS with NaCl;C. Root length of seedlings under MS medium and MS with NaCl,bar=1.0 cm.

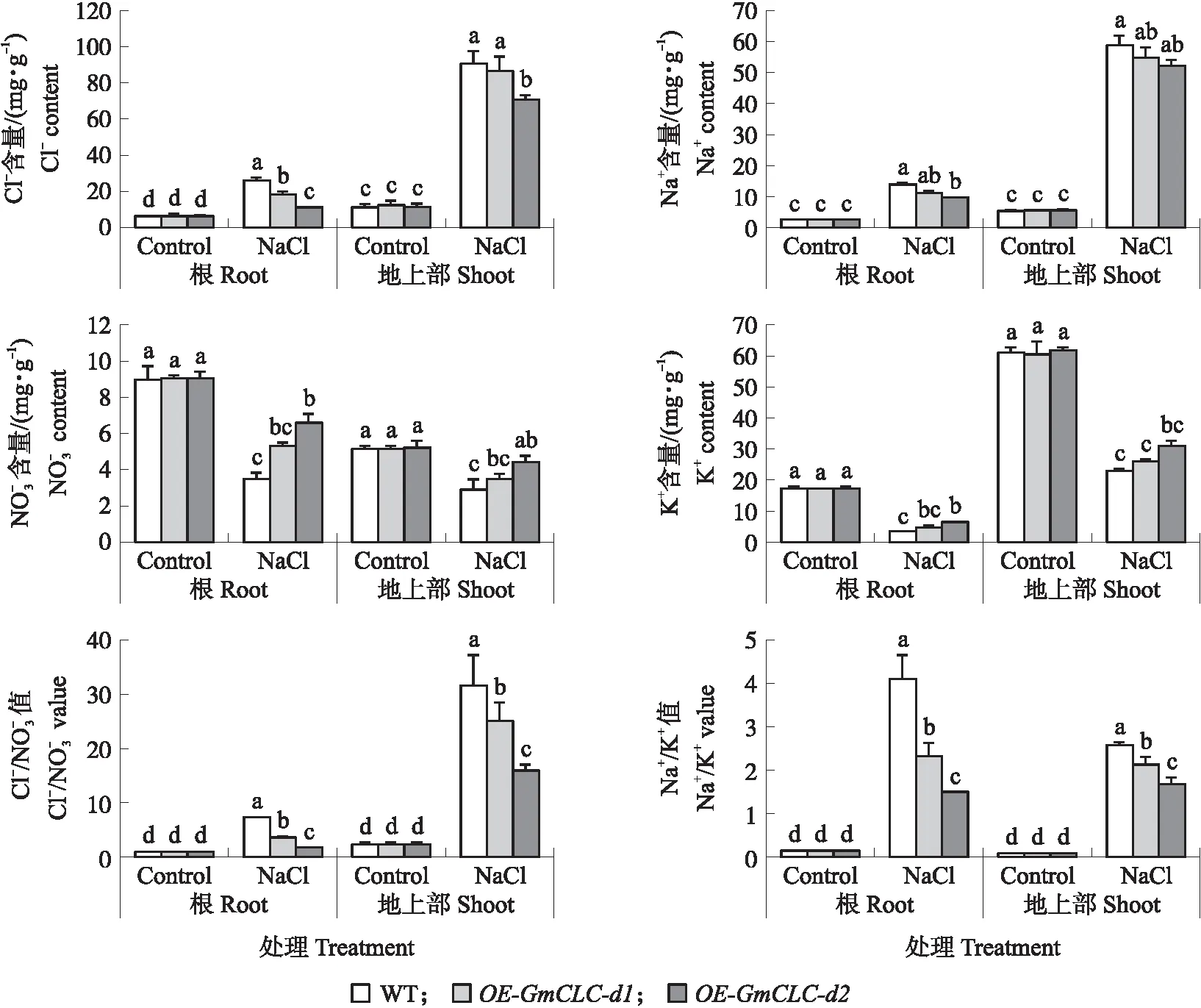
图7 盐处理下过表达GmCLC-d1/d2基因拟南芥根和地上部离子含量的变化Fig.7 Changes of ions in roots and shoots of OE-GmCLC-d1/d2 A. thaliana plants under NaCl treatment
3 讨论与结论