BRE-AS启动子负调控区变异与启动子活性、母猪繁殖力的关系
王杨,王苗苗,单保森,吴望军,杜星,李齐发
(南京农业大学动物科技学院,江苏 南京 210095)
长链非编码RNA(long noncoding RNA,lncRNA)作为一类转录本长度超过200个核苷酸(nt)的功能性RNA分子,通常被认为不具备编码蛋白的能力,而是以RNA的形式在转录和转录后水平上调控基因的表达[1-3]。依据基因组上与邻近蛋白编码基因的位置关系,可将lncRNA分为同义lncRNA(SS-lncRNA)、反义lncRNA(AS-lncRNA)、双向型lncRNA(BD-lncRNA)、基因间lncRNA(LincRNA)和内含子lncRNA(IT-lncRNA)等[1]。随着高通量测序技术的应用,哺乳动物中越来越多的lncRNA被发现,其功能也被注释,lncRNA在哺乳动物许多生理和病理过程中的重要调控作用也逐渐引起人们的关注[4]。在雌性生殖系统中,lncRNA在多种相关组织(如下丘脑、垂体、卵巢和子宫等)中分布,通过多种机制参与卵泡发育、卵母细胞成熟、排卵、妊娠和胚胎发育等多个生殖过程的调控[5]。例如,在人卵巢颗粒细胞(granulosa cell,GC)中高表达的HLA复合群26(lncRNAHCG26)表达水平与卵泡数有关,敲减HCG26可抑制GC增殖和细胞周期进程,同时影响芳香化酶基因的表达和雌二醇的生成[6];小鼠卵中lncRNA类固醇受体RNA激活剂(SRA)能够刺激GC的生长,增加雌激素和孕激素水平[7];在猪闭锁卵泡中高度表达的lncRNANORHA能够通过miR-183簇/FoxO1轴诱导GC凋亡[8]。此外,lncRNA H19印记母源表达转录本(H19)被证实是影响胚胎发育的主要调节因子,可通过调节miR-675的加工来抑制胎盘发育[9],其失调会引起孕酮生成异常[10],引起胎儿生长[11]以及妊娠[12]中相关疾病的发生;Mira通过将Mll1募集到染色质来激活小鼠胚胎干细胞中同源框A6(Hoxa6)和同源框A7(Hoxa7)的转录,对胚胎早期发育至关重要[13];小鼠卵母细胞特异性表达lncRNA(Rose)在卵母细胞胞质分裂和早期胚胎发育的母源-合子转换(maternal-zygotic transition,MZT)中具有重要的调节作用[14]。这些结果均表明 lncRNA在卵泡发育和雌性生殖中具有重要作用。
不断改善和提高家畜的生产性能是家畜育种的根本目标,而筛选与家畜生产性能有关的重要经济性状的候选基因和遗传标记对于加快实现育种目标具有重要意义。虽然目前鉴定的影响家畜重要经济性状的候选基因基本都是蛋白编码基因,但研究证实lncRNA在家畜重要经济性状相关的细胞功能中也发挥与蛋白编码基因相似的功能,如lncRNA肌肉生长促进因子(lncMGPF)与猪产肉性状候选基因Ⅰ类肌球蛋白(MyoD)(前者是后者的靶标)均可诱导肌细胞的肌源性分化[15],与卵泡闭锁相关lncRNA(NORFA)和母猪繁殖性状候选基因转化生长因子β受体2(TGFBR2)(后者是前者的靶标)均可抑制GC凋亡[16],因此可以看出lncRNA也可以作为家畜重要经济性状的潜在候选基因。Lv等[15]以lncMGPF为潜在候选基因,在美系大白猪lncMGPF基因中发现10个单核苷酸多态性(SNP),这些SNP均与产肉性状(背膘厚和眼肌面积)显著关联,证实lncMGPF是影响猪产肉性状的关键lncRNA基因。Du等[16]以NORFA为潜在候选基因,利用DNA混池测序法在猪NORFA基因中发现6个变异位点,其中启动子19 bp序列拷贝变异表现出品种特异性,在高繁殖力猪种(二花脸猪)中为双拷贝,在国外引进猪种大白猪和长白猪中为单拷贝,认为NORFA是影响高繁殖力性状的候选lncRNA基因。但目前发现的影响家畜重要经济性状的候选lncRNA基因较少。本课题组前期研究证实lncRNABRE-AS是猪卵泡闭锁和GC凋亡的重要调节因子[17],且位于母猪繁殖性状的QTL(quantitative trait locus)内。因此,本试验拟以BRE-AS为潜在候选基因,采用DNA测序法分离其启动子负调控区(PNRR)序列、筛选SNP,采用一般线性模型(GLM)分析SNP与大白猪繁殖性状之间的关系,采用荧光素酶报告系统分析其机制,评估BRE-AS作为母猪繁殖性状候选lncRNA基因的可行性,以期为母猪繁殖性状的分子育种提供遗传标记。
1 材料与方法
1.1 试验样品
用于基因组DNA提取、基因分型及与繁殖性状关联分析的315份大白母猪耳组织样来自常州康乐农牧有限公司种猪场,详细记录每头母猪的繁殖性能。基因组 DNA的提取采用常规的酚/氯仿抽提法。
1.2 引物设计、PCR扩增、测序和生物信息学分析
根据本课题组前期分离的猪BRE-AS基因5′调控区序列和鉴定的PNRR[17],利用Primer Premier 5.0软件设计扩增大白猪BRE-AS基因PNRR序列的引物P1和P2(表1)。PCR反应体系和反应程序见文献[18]。PCR产物经琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)公司测序。从GenBank数据库(https://www.ncbi.nlm.nih.gov)获取杜洛克猪基因组中的目标序列。利用JASPAR(http://jaspar.genereg.net/)预测潜在的转录因子结合位点,利用miRDB((http://mirdb.org/)预测序列中潜在的miRNA结合位点。

表1 猪BRE-AS基因启动子扩增的引物序列Table 1 Sequences of the primers for amplification of the promoter of the porcine BRE-AS gene
1.3 SNP的筛选、分型与关联分析
将16头大白猪基因组 DNA 等量混匀,构建 DNA 池。以池 DNA 为模板,利用表1中的引物进行PCR扩增。扩增产物经检测合格后委托生工生物工程(上海)公司测序,筛选SNP。利用DNA测序法对每头母猪进行分型。根据文献[19]中的方法计算基因型频率等参数,进行哈代-温伯格平衡检验和关联分析。
1.4 载体的构建、细胞培养与转染
不同单倍体型PNRR荧光素酶报告载体由南京擎科生物科技有限公司合成。将液氮罐中储存的人GC系(KGN)取出,放入水浴锅中,37 ℃复苏55 min,再置于15 mL灭菌的离心管中,常温下1 000 r·min-1离心5 min,然后接种于含有10%胎牛血清的1640培养基(Hyclone公司)的T25瓶内,置于5% CO2、37 ℃的细胞培养箱(Thermo公司)中培养。待细胞长至铺满瓶壁约90%时,用胰蛋白酶消化2 min,加入等量1640培养基并终止消化,转移至15 mL离心管,离心后弃上清液,再用1640培养基重悬,均匀接种12孔细胞培养板。待细胞量长满约90%时,用Highgene试剂(ABclonal公司)转染报告载体。
1.5 荧光素酶活性分析
细胞转染24 h后,使用100 μL Passive Lysis Buffer裂解液(Vazyme公司)裂解细胞。在避光条件下,用酶标仪(Bio-Tek公司)测量每个样品的萤火虫荧光和海肾荧光并计算两者的比值。
1.6 数据处理与分析
2 结果与分析
2.1 大白猪BRE-AS基因PNRR扩增与序列分析
大白猪BRE-AS基因PNRR序列长度为792 bp,与参考基因组(杜洛克猪)相应序列的一致性为100%(图1-A、B)。大白猪BRE-AS基因PNRR序列由31.4%的碱基A、26.1%的碱基T、22.2%的碱基G和20.3%的碱基C组成。用JASPAR在线网站预测发现猪BRE-AS基因PNRR含有多个潜在的转录因子(如OTX2、ASCL1、LIN54和MXI1等)结合元件,用miRDB在线工具预测到多个潜在的miRNA(如miR-466、miR-4533和miR-6165等)结合元件(图1-B)。

图1 猪BRE-AS基因PNRR序列Fig.1 Sequence of the porcine BRE-AS PNRR A. 猪BRE-AS基因PNRR结构示意图Schematic diagram of the porcine BRE-AS PNRR;B. 猪BRE-AS基因PNRR序列Sequence of the porcine BRE-AS PNRR. 加粗碱基为顺式作用元件The bold bases indicate cis-acting elements.
2.2 大白猪BRE-AS基因PNRR上SNP筛选与多态性分析
2.2.1 SNP筛选利用DNA混池(n=16)测序法筛选大白猪BRE-AS基因PNRR上的SNP,结果发现共有2个SNP,分别是位于-794 nt处的T>G单碱基突变和位于-756 nt处的A>C单碱基突变。根据规则将这2个SNP分别命名为g.-794T>G位点和g.-756A>C位点。
2.2.2 g.-794T>G位点多态性分析利用DNA测序法对大白猪群体(n=315)g.-794T>G位点进行了基因分型,结果发现3种基因型,分别为TT、TG和GG型,其中TT型为优势基因型,基因型频率为0.752(图2-A、B)。等位基因频率计算结果显示,T为优势等位基因,等位基因频率为0.863(图2-C)。卡方检验显示大白猪群体g.-794T>G位点的基因型分布符合哈代-温伯格平衡定律(P>0.05)。
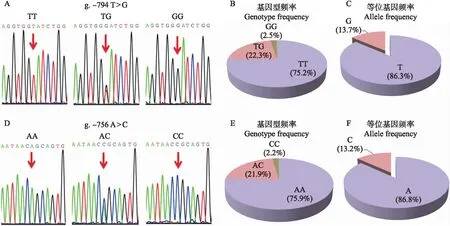
图2 大白猪BRE-AS基因PNRR上SNP多态性分析Fig.2 Polymorphism analysis of SNP in BRE-AS PNRR of Yorkshire pigs A—C. g.-794T>G位点不同基因型峰图(A)、基因型频率(B)和等位基因频率(C)Peaks(A),genotype frequency(B)and allele frequency(C)of different genotypes for SNP g.-794T>G;D—F. g.-756A>C位点不同基因型峰图(D)、基因型频率(E)和等位基因频率(F)Peaks(D),genotype frequency(E)and allele frequency(F)of different genotypes for SNP g.-756A>C.
2.2.3 g.-756A>C位点多态性分析在大白猪群体(n=315)中g.-756A>C位点也存在3种基因型,即AA、AC和CC型,其中AA型为优势基因型,基因型频率为0.759(图2-D、E);A为优势等位基因,等位基因频率为0.868(图2-F)。大白猪群体g.-756A>C位点的基因型分布也符合哈代-温伯格平衡定律(P>0.05)。
2.3 大白猪BRE-AS基因PNRR上SNP多态性与母猪繁殖性状关联分析
2.3.1 g.-794T>G位点多态性与母猪繁殖性状关联分析为了研究BRE-AS基因g.-794T>G位点变异与母猪繁殖性状的关系,利用GLM模型分别对g.-794T>G位点多态性与大白猪群体6个繁殖性状等进行了关联分析。如图3-A所示:g.-794T>G位点多态性与大白猪总产仔数(TNB)、产活仔数(NBA)和健仔数(NSP)等性状显著关联(P<0.05),其中TT型母猪TNB、NBA和NSP均显著高于GG型母猪(P<0.05)。其他性状各基因型间无显著差异(P>0.05)。这些结果说明BRE-AS是大白猪TNB、NBA和NSP等繁殖性状的候选基因。
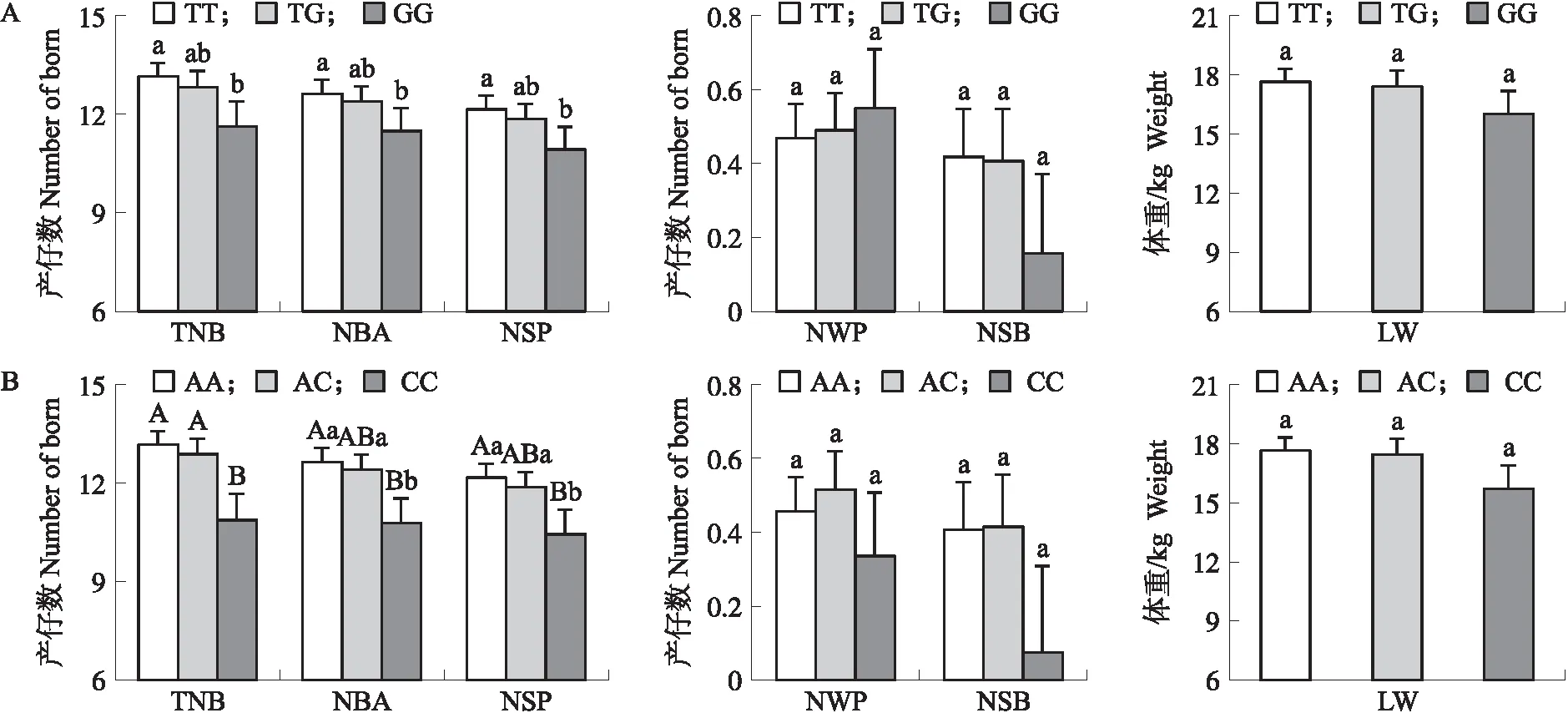
图3 BRE-AS基因PNRR上g.-794T>G突变(A)和g.-756A>C突变(B)与大白猪繁殖性状关联分析Fig.3 Association analysis of the g.-794T>G mutation(A)and g.-756A>C mutations(B) in BRE-AS PNRR with Yorkshire pigs TNB:总产仔数Total number of piglets born;NBA:产活仔数Number of piglets born alive;NSP:健仔数Number of strong pigs;NWP:弱仔数Number of weak pigs;NSB:死胎数Number of stillborn;LW:出生窝重Litter weight.不同大小写字母分别表示差异极显著(P<0.01)和差异显著(P<0.05)。下同。Significant differences among the groups are indicated by different uppercase letters(P<0.01)or lowercase letters (P<0.05). The same below.
2.3.2 g.-756A>C位点多态性与母猪繁殖性状关联分析BRE-AS基因g.-756A>C位点多态性与大白猪群体6个繁殖性状关联分析结果如图3-B所示。BRE-AS基因g.-756A>C位点多态性与大白猪TNB、NBA和NSP这3个繁殖性状间极显著关联(P<0.01),其中AA型母猪的TNB、NBA和NSP极显著高于CC型母猪(P<0.01),AC型母猪的TNB极显著高于CC型母猪(P<0.01),NBA和NSP显著高于CC型母猪(P<0.05)。其他性状各基因型间无显著差异(P>0.05)。这些结果进一步说明BRE-AS是大白猪TNB、NBA和NSP等繁殖性状的候选基因。
2.4 大白猪BRE-AS基因PNRR上SNP合并基因型与母猪繁殖性状的关联分析
2.4.1 SNP位点单倍型分析对BRE-AS基因PNRR上SNP(g.-794T>G和g.-756A>C)进行联合分析,结果在大白猪群体中发现3种合并基因型(TT/AA、TG/AC和GG/CC型),其中TT/AA型为优势合并基因型,合并基因型频率为0.760(图4-A)。此外,在大白猪群体中共发现2种单倍型,T-A型和G-C型,其中T-A型是优势单倍型,单倍体型频率为0.869(图4-B)。
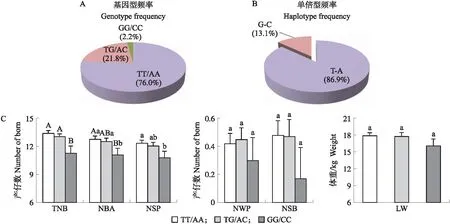
图4 大白猪BRE-AS基因PNRR上SNP合并基因型与大白猪繁殖性状的关联分析Fig.4 Association analysis between combined genotype for SNP in BRE-AS PNRR and reproductive traits in Yorkshire pigs A.合并基因型频率Frequency of combined genotypes;B.单倍型频率Haplotype frequency;C.合并基因型与繁殖性状的关联分析Association analysis between the combined genotypes and reproductive traits.
2.4.2 合并基因型与母猪繁殖性状关联分析关联分析结果如图4-C所示:BRE-AS基因PNRR上2个SNP合并基因型与大白猪TNB、NBA和NSP等繁殖性状显著或极显著关联,其中TT/AA型和GT/CA型母猪的TNB极显著高于GG/CC型母猪(P<0.01);TT/AA型母猪的NBA极显著高于GG/CC型母猪(P<0.01),GT/CA型母猪的NBA显著高于GG/CC型母猪(P<0.05);TT/AA型母猪的NSP显著高于GG/CC型母猪(P<0.05);其他性状间无显著差异(P>0.05)。
2.5 PNRR上SNP对BRE-AS启动子活性的影响
为了分析猪BRE-AS基因PNRR上SNP是否通过调控启动子活性来影响大白猪繁殖性能,本试验构建了BRE-AS基因SNP(g.-794T>G和g.-756A>C位点)的2种单倍体型PNRR荧光素酶报告载体pGL3-T-A和pGL3-G-C(图5-A)。将空载 pGL3-basic 和 pGL3-T-A、pGL3-G-C分别与pRL-TK共转KGN细胞。结果(图5-B)发现,pGL3-G-C的荧光素酶活性极显著高于pGL3-T-A(P<0.01),说明BRE-AS基因PNRR上SNP影响猪GC中促凋亡因子BRE-AS的转录活性。
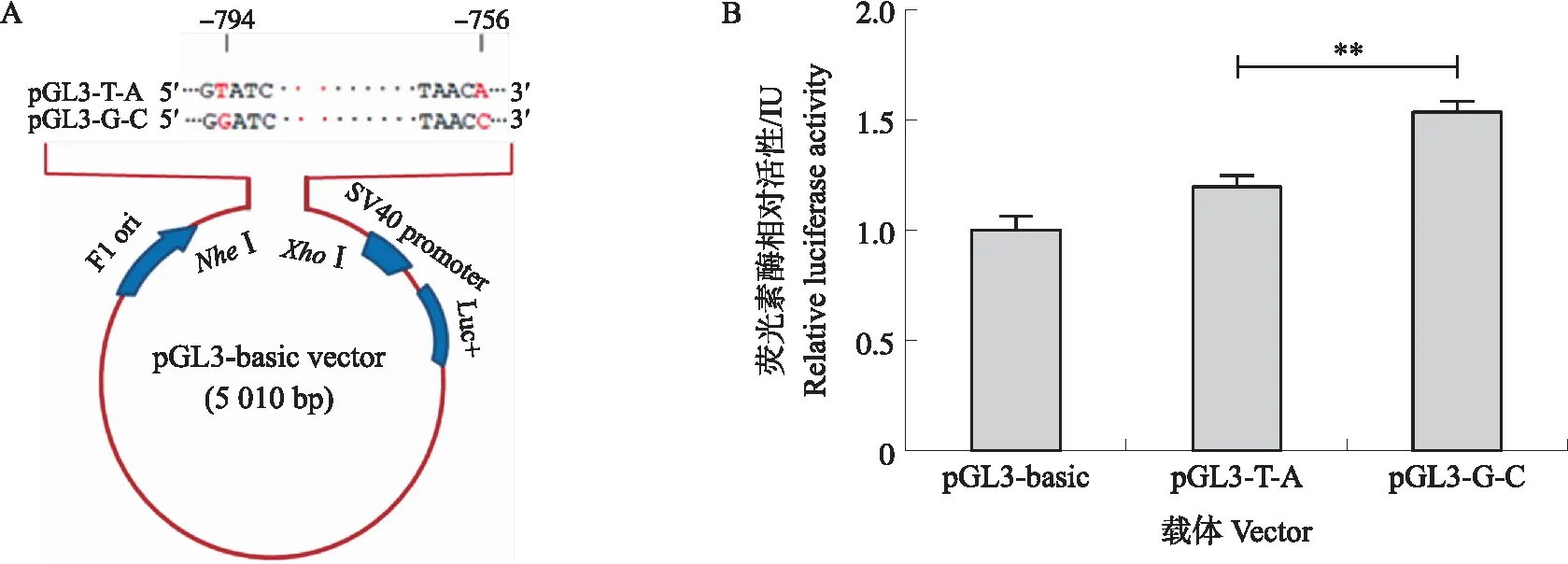
图5 PNRR上SNP对BRE-AS启动子活性的影响Fig.5 The effect of SNP in PNRR on BRE-AS promoter activity A.2个单倍型PNRR报告载体示意图Schematic diagram of reporter vectors of PNRR with different haplotypes;B.荧光素酶活性Luciferase activity.**P<0.01.
3 讨论
SNP主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性,与基因表达、功能、表型和疾病等有关[20]。在畜牧领域,许多重要功能基因上的SNP被证实与畜禽重要经济性状有关,成为畜禽重要经济性状分子育种(如标记辅助选择育种、基因组选择育种和基因编辑育种等)的遗传标记。例如,美利奴羊胰岛素样生长因子1受体(IGF1R)基因第3外显子c.654G>A位点多态性与生长、体型、屠宰和肉质性状显著关联[21];苏淮猪骨形态发生蛋白7(BMP7)基因3′-UTR上c.*273A>G位点多态性与母猪产仔数性状显著关联[22-23];扬州鹅泛素羧基末端水解酶L1(UCHL1)基因启动子c.-652C>T位点多态性与生长性状显著关联[24]。但目前鉴定的与畜禽重要经济性状显著关联的SNP绝大多数都位于蛋白编码基因上,而非编码基因上的极少。本文在本实验室前期证实BRE-AS为猪卵泡闭锁和GC凋亡的重要功能AS-lncRNA的基础上,在其PNRR上鉴定2个与母猪繁殖性状(包括TNB、NBA和NSP)显著关联的SNP(g.-794T>G和g.-756A>C),进一步证实BRE-AS是母猪繁殖性状的候选基因。此前鉴定的影响母猪繁殖力的候选lncRNA只有NORFA[16]。另外,在其他畜禽lncRNA上还发现了一些与重要经济性状关联的SNP,如Yu等[25]发现lncRNA母系表达基因3(MEG3)基因4个SNP与猪肉质性状显著关联;Mi等[26]发现lncRNA祖细胞更新相关非编码RNA(PRANCR)上的1个A>G突变与奶牛金黄色葡萄球菌乳腺炎抗性性状显著关联;Mei等[27]发现lncRNApouBW1基因启动子n.830G>A与鸡的生长性状显著关联;Li等[28]发现lncRNA肝脏甘油三酯合成调节因子(LTR)上c.242G>A与鸡生长和胴体性状显著相关。总之,占基因组序列98%以上的非编码区正在逐渐成为畜禽重要经济性状遗传标记挖掘的热点目标区域。
畜禽重要经济性状相关的关键功能基因5′-调控区上的SNP往往通过调节基因的转录活性来发挥作用[29]。Wang等[24]发现与鹅生长性状显著关联的c.-652C>T突变增强UCHL1基因的启动子活性。骨形态发生蛋白受体1B(BMPR1B)基因第1内含子中与母猪繁殖性状显著关联的4个SNP组成的单倍型中,二花脸猪特异的单倍型调控区活性显著高于杜洛克猪特异的单倍型[30]。5′调控区SNP影响基因转录活性,一般通过改变转录因子与其结合位点的结合亲和力来实现[31-32]。Du等[16]在二花脸猪lncRNANORFA启动子中检测到的双拷贝19 bp序列,主要通过募集更多转录因子核因子I X(NFIX)来增强GC中NORFA的转录活性;Zheng等[33]利用GWAS方法鉴定了奶牛乳脂性状的一个重要的候选基因核糖体蛋白L8(RPL8),发现启动子g.-931G>T突变通过影响转录因子Pax6和RPL8启动子上结合位点的互作来改变RPL8基因的转录活性。本研究发现,PNRR上g.-794T>G和g.-756A>C变异可引起GC中lncRNABRE-AS基因转录活性的改变,其中T-A单倍型启动子活性低于G-C单倍型,这与TT/AA基因型母猪繁殖力高于GG/CC母猪型母猪,以及本实验室前期证实lncRNABRE-AS是母猪繁殖力限制因子[14]等结果是一致的。但本文并未检测到BRE-AS基因PNRR上SNP可引起雌性生殖相关的转录因子结合位点的改变,因此关于SNP影响BRE-AS启动子活性的机制还有待于进一步研究。
总之,本试验获得了大白猪lncRNABRE-AS基因PNRR序列,发现了2个与母猪繁殖性状(如TNB、NBA和NSP等)显著关联的SNP g.-794T>G和g.-756A>C,初步阐明了2个SNP影响母猪繁殖力的分子机制(增强母猪繁殖力抑制因子BRE-AS的转录活性)。结合前期功能研究结果[17],证实BRE-AS是第2个被发现的影响母猪繁殖性状的功能lncRNA,而鉴定出的2个SNP(g.-794T>G和g.-756A>C)均可作为母猪繁殖性状分子育种的潜在遗传标记。

