不同淀粉来源及其糊化程度对团头鲂生长性能、养分消化率和糖脂代谢的影响
陈伟亮,张丽,张玲,刘文斌,李向飞
(南京农业大学动物科技学院江苏省水产动物营养重点实验室,江苏 南京 210095)
糖类是重要的非蛋白能源物质,其不仅可为水产动物提供能量,还具有节约蛋白质和降低鱼体氨氮排放的作用[1]。此外,部分糖类如淀粉等具有较强的黏结性,可以改善水产饲料的制粒效果和水稳性[2],并且饲料中添加适量糖类,可以改善水产动物生长性能,并降低饵料系数[3]。然而,与畜禽相比,水产动物对糖类的利用率相对较低。绝大多数鱼类在葡萄糖负荷或摄食糖类后,常表现出持续的高血糖症状[4],被认为是先天性的“糖尿病患者”[5]。此外,水产动物对糖类的利用率与其食性密切相关。通常,杂食性和草食性动物对糖类的耐受程度和利用能力均显著高于肉食性动物[6]。除自身因素外,水产动物对糖类的利用率还受到糖类来源、种类、加工工艺及添加量等诸多营养因素的影响。因此,对鱼体糖代谢机制及其营养调控技术的研究具有较大的现实及科学意义。
淀粉是配合饲料中的主要糖源,其来源及糊化程度均会显著影响鱼体生长性能和代谢机能[7]。研究表明,淀粉的物理特性,如一级结构、颗粒形状、颗粒直径和直链淀粉与支链淀粉比率等,均存在较大差异[8],可显著影响其营养价值和可利用率[9]。例如,黄鲈(Percaflavescens)适宜糖源为土豆淀粉和玉米淀粉,其摄食小麦淀粉后出现肝体比升高、肝脏脂肪沉积与肝细胞肿大等病理症状[10]。然而,在金头鲷(Sparusaurata)中的研究发现,小麦淀粉组的生长性能和淀粉消化率显著高于玉米淀粉,且升糖指数较低[11]。相较于生淀粉,预糊化淀粉可以显著提高大口黑鲈(Micropterussalmoides)的增重率,降低饵料系数[12]。这表明不同物种的适宜糖源存在较大差异。此外,蒸煮和挤压等处理方式均会改变淀粉的物理特性或复杂程度,继而影响水产动物对其的利用率[13]。通常情况下,糊化可显著增加淀粉的溶解度和吸水能力,使淀粉分子中的糖苷键充分暴露,进而增加淀粉与消化酶的接触面积,并提高水产动物对其的消化率[14]。例如,糊化处理可显著提高斑点叉尾鮰(Ictaluruspunctatus)对玉米淀粉的消化率[13]。然而,淀粉的糊化度并非越高越好。例如,完全使用糊化淀粉时,金头鲷幼鱼的生长性能和饲料利用率均明显下降,而肝糖原含量显著升高[15-16]。此外,日粮中添加35%的糊化淀粉,可显著改善胡鲇(Clariasbatrachus)的生长性能并上调肌源性调节因子的表达,而45%的糊化淀粉可显著促进脂肪生成并抑制鱼体生长[17]。由此可见,淀粉来源及其糊化程度均会对水产动物生长性能与饲料利用率造成较大影响,且这种影响存在较大物种差异性。然而,相关研究大多仅局限于生长性能、养分利用率和消化酶活性等表观指标,对鱼体糖脂代谢机制的研究尚较缺乏。
团头鲂(Megalobramaamblycephala)又名武昌鱼,是我国特有的淡水名优经济鱼类。与杂食性和肉食性鱼类相比,其对糖类的耐受能力相对较高。因此,饲料中往往添加较多糖类以节约蛋白质用量,进而降低饲料成本。实际生产中,淀粉是其饲料中的主要糖源,但不同淀粉来源及其糊化程度对鱼体生长性能和糖脂代谢的影响尚不明确。基于此,本试验旨在探讨不同淀粉来源及其糊化程度对团头鲂生长性能、养分消化率和糖脂代谢的影响,为鱼类糖代谢机制研究提供指导。
1 材料与方法
1.1 试验设计
试验饲料中的蛋白质由鱼粉、豆粕、菜粕和棉粕等提供,脂肪由等量的豆油和鱼油提供,糖类主要由纯小麦淀粉和纯玉米淀粉提供。试验所用小麦淀粉与玉米淀粉均购自南京华牧动物科技研究所有限公司,纯度≥99%。糊化淀粉的生产工艺为挤压法,2种淀粉糊化程度相同。根据淀粉来源及其糊化程度的不同,将试验饲料分为生小麦淀粉组(raw wheat starch,RW)、糊化小麦淀粉组(gelatinized wheat starch,GW)、生玉米淀粉组(raw corn starch,RC)和糊化玉米淀粉组(gelatinized corn starch,GC),分别添加20%相应淀粉。饲料原料粉碎后经60 mm筛网过滤。将饲料原料与外源指示剂-氧化钇(Macklin,纯度≥99.9%)逐级混合均匀,喷洒适量的水,使用实验室制粒机(MUZL 180,江苏扬州牧扬集团有限公司)制粒。试验饲料干燥后置于-20 ℃冰箱中冷藏备用。饲料配方及其概略养分含量如表1所示。
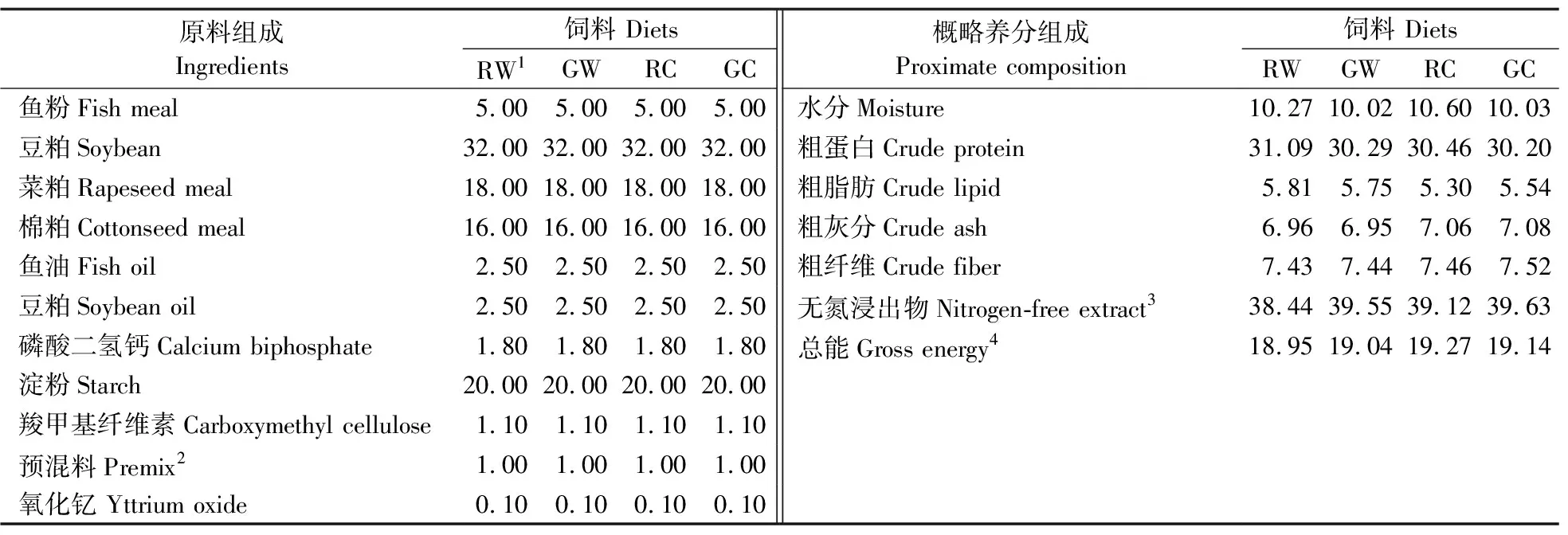
表1 饲料配方及其概略养分含量(风干基础)Table 1 Formulation and proximate composition of the experimental feeds(air-dry basis) %
1.2 养殖试验
试验鱼购自湖北鄂州团头鲂原种场。试验前,用商品料(32%蛋白质和5%脂肪)饲喂2周,使其适应养殖条件。驯化后,选取初始体重为(19.95±0.14)g的团头鲂320尾,随机分为4组,每组5重复,每个水箱16尾鱼。养殖试验在南京农业大学水产教学科研基地室内循环系统中进行,为期10周。期间,每日饱食投喂3次(07:00、12:00和17:00),并在投喂0.5 h后检查残饵剩余情况,进而对饵料系数进行校正。自来水养殖,全程微流水循环(2 L·min-1),水温保持在(28±1)℃,溶解氧为5.0 mg·L-1,pH值7.0~7.5,总氨氮和亚硝酸盐含量分别为0.2和0.01 mg·L-1,全天24 h充氧。
1.3 样品采集
养殖试验结束后,将鱼禁食24 h以排空肠道内容物。使用浓度为100 mg·L-1的间氨基苯甲酸乙酯甲磺酸盐(Sigma,美国)将鱼麻醉,称取每个水箱鱼的质量并记录尾数。每箱随机取5尾鱼(即每个处理25尾鱼),尾静脉采集血液置于肝素抗凝管中,离心(4 ℃,3 000g)10 min,吸取上清液转移至离心管,保存于-20 ℃冰箱。此外,采集肝脏保存于-80 ℃冰箱中备用。
1.4 生长指标计算
生长性能计算公式如下:
存活率(survival rate,SR)=试验结束时鱼的尾数/初始鱼的尾数×100%
(1)
增重率(weight gain rate,WGR)=(Wt-W0)/W0×100%
(2)
特定生长率(specific growth rate,SGR)=(lnWt-lnW0)/T×100%
(3)
采食量(feed intake,FI)=总采食量/鱼的尾数
(4)
相对摄食率(relative feed intake,RFI,)=总采食量×2/[(W0+Wt)×T]×100%
(5)
饵料系数(feed conversion ratio,FCR)=总采食量/总增重
(6)
蛋白效率比(protein efficiency ratio,PER)=增重/蛋白摄入量
(7)
式中:W0为鱼体初重(g);Wt为鱼体末重(g);T表示试验时间(d)。
1.5 饲料概略养分分析
饲料称重后置于105 ℃烘箱中烘至恒重,计算水分含量;采用凯式定氮仪(FOSS KT260,瑞士)测定饲料中氮含量,并将其乘以6.25换算成粗蛋白含量;采用索氏抽提器于60~75 ℃水浴条件下使乙醚冷凝回流约12 h,测得粗脂肪含量;将饲料置于坩埚中灰化后,转移至马弗炉中550~600 ℃灼烧6 h,得出灰分含量;将样品进行酸碱处理后,采用粗纤维分析仪(ANKOM A2000i,美国)测得饲料粗纤维含量;采用全自动量热仪(PARR 1281,美国)测定饲料总能。
1.6 血浆生化指标测定
血浆葡萄糖(GLU)和甘油三酯(TG)含量测定所用试剂盒均购自南京建成生物工程研究所,编号分别为A154-1-1与A110-1-1。其中,血糖测定采用葡萄糖氧化酶法[18],甘油三酯测定参照McNamara等[19]的方法。
1.7 粪便收集及养分消化率测定
养殖试验结束前7 d,进行收粪试验。投喂结束1 h后,用尼龙网收集新鲜、成型且完整的粪便,将粪便自然风干后,置于-20 ℃冰箱中保存备用。饲料和粪便中概略养分含量参照1.5节所示方法测定,Y2O3含量参考《稀土金属及其氧化物中稀土杂质化学分析方法第1部分:镧中铈、镨、钕、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥和钇量的测定:GB/T 18115.1—2020》的方法并采用电感耦合等离子体原子发射光谱仪(Thermo iCAP 7000,美国)测定。养分消化率计算公式如下:
干物质的表观消化率=(1-Dy/Fy)×100%
(8)
营养物质的表观消化率=[1-(Dy/Fy)/(F/D)]×100%
(9)
式中:Dy为饲料中Y2O3的含量(%);Fy为粪便中Y2O3的含量(%);D为饲料中营养物质的含量(%);F为粪便中营养物质的含量(%)。
1.8 肝脏糖原和脂肪含量测定
肝糖原含量参照Keppler[20]的方法测定,肝脂含量采用Folch等[21]的方法测定。
1.9 基因表达相关检测方法
称取肝脏样品,按照Plus RNA Purification Kit(Invitrogen,美国)操作说明提取样品中总RNA,并用吸光度法分别在260和280 nm处测定所提取RNA的纯度和含量。
采用RT-PCR试剂盒(TaKaRa,日本)按照SYBR®Prime ScriptTM的操作说明将总RNA反转录。反转录后,对cDNA进行稀释,用SYBR Green Ⅱ荧光试剂盒(TaKaRa,日本)进行RT-PCR扩增。使用QuantStudio7 Flex荧光定量PCR仪(Thermo Fisher,美国)测定糖脂代谢相关基因的转录水平。最后,用内参基因ef1α对目的基因的CT值进行均一化处理[22],并使用2-ΔΔCT方法计算样品中各基因的mRNA相对表达量。引物由上海Invitrogen公司合成,序列见表2。

表2 RT-PCR引物序列Table 2 Nucleotide sequences of the primers used by real-time PCR
1.10 数据统计与分析

2 结果与分析
2.1 不同淀粉来源及其糊化程度对团头鲂生长性能的影响
如表3所示,淀粉来源对存活率、终末体重、增重率、特定生长率、采食量、相对采食量、饵料系数和蛋白效率比等均无显著影响(P>0.05),而糊化程度显著影响除饵料系数和蛋白效率比外的其他指标(P<0.05)。其中,生淀粉组的增重率、特定生长率和采食量均显著高于糊化淀粉组(P<0.05)。此外,二者交互作用显著影响增重率、特定生长率和采食量(P<0.05),且三者均以生玉米淀粉组最高。
2.2 不同淀粉来源及其糊化程度对团头鲂养分消化率的影响
如表4所示,淀粉来源对各养分表观消化率均无显著影响(P>0.05),而糊化程度显著影响干物质消化率(P<0.05)。其中,生淀粉组干物质消化率显著低于糊化淀粉组(P<0.05)。此外,二者的交互作用显著影响干物质消化率(P<0.05),且生小麦淀粉组干物质消化率最低。
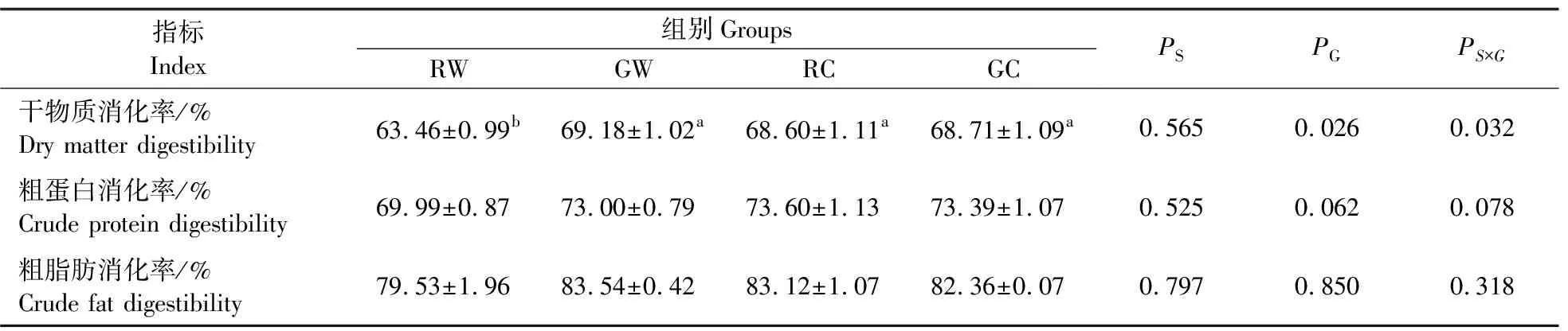
表4 不同淀粉来源及其糊化程度对团头鲂养分消化率的影响Table 4 Effects of different starch sources and gelatinization degrees on the nutrients digestibility of blunt snout bream
2.3 不同淀粉来源及其糊化程度对团头鲂血浆生化指标的影响
如表5所示,淀粉来源对血浆葡萄糖和甘油三酯含量均无显著影响(P>0.05),而糊化程度显著影响血糖含量(P<0.001)。其中,糊化淀粉组血糖含量显著高于生淀粉组(P<0.05)。此外,二者的交互作用显著影响血糖水平(P<0.001),且糊化玉米淀粉组最高。

表5 不同淀粉来源及其糊化程度对团头鲂血浆生化指标的影响Table 5 Effects of different starch sources and gelatinization degrees on the plasma metabolites of blunt snout bream
2.4 不同淀粉来源及其糊化程度对团头鲂肝脏糖原和脂肪含量的影响
如表6所示,淀粉来源对肝脏糖原和脂肪含量均无显著影响(P>0.05),而糊化程度显著影响肝糖原含量(P<0.01)。其中,糊化淀粉组肝糖原含量显著高于生淀粉组(P<0.01)。此外,二者交互作用显著影响肝糖原含量其中(P<0.05),且以糊化玉米淀粉组为最低。
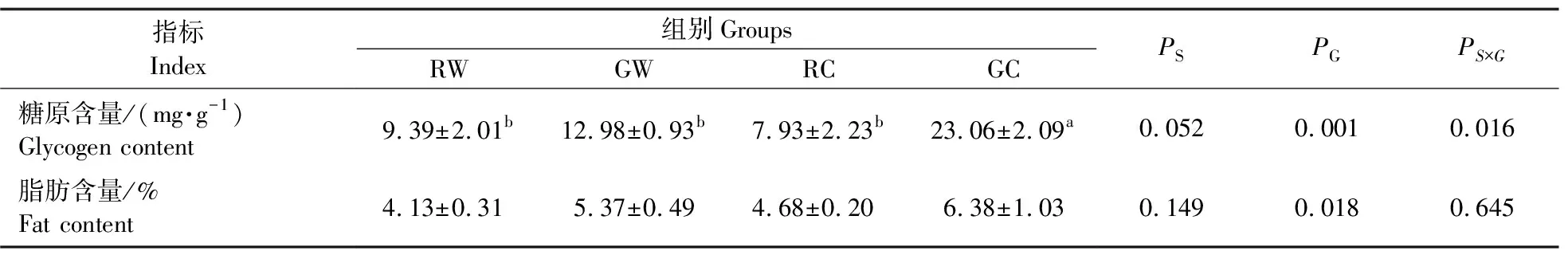
表6 不同淀粉来源及其糊化程度对团头鲂肝糖原和脂肪含量的影响Table 6 Effects of different starch sources and gelatinization degrees on the liver glycogen and lipid contents of blunt snout bream
2.5 不同淀粉来源及其糊化程度对团头鲂肝脏糖脂代谢相关基因表达的影响
从图1和2可见,淀粉来源、糊化程度及其二者交互作用对glut2、gk、pk、g6pase、fbpase、gs、cpt-Ⅰ和aco基因的表达量均无显著影响(P>0.05)。淀粉来源极显著影响fas的表达量(P<0.001),且小麦淀粉组极显著低于玉米淀粉组(P<0.001)。糊化程度显著影响g6pdh、fas和accα的表达量(P<0.05),且糊化淀粉组显著高于生淀粉组(P<0.05)。此外,二者交互作用极显著影响g6pdh和fas表达量(P<0.001),且糊化玉米淀粉组g6pdh、fas和accα表达量最高。
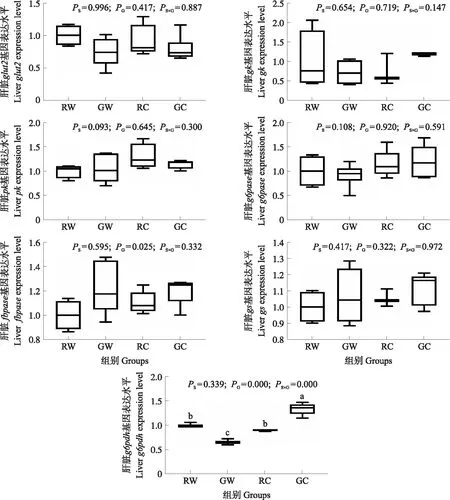
图1 不同淀粉来源及其糊化程度对团头鲂肝脏糖代谢相关基因表达的影响Fig.1 Effects of different starch sources and gelatinization degrees on the expression of glucose metabolism-related genes in blunt snout bream 1)盒子的上线和下线代表第一和第三四分位数,中间的线代表中位数,上下线代表的最大值和最小值;2)柱子上方不同小写字母表示差异显著(P<0.05)。下同。1)The upper and lower limits of the box represent the first and third quartiles. The horizontal line inside the box represents the second quartile(median). Whiskers represent the maximum and minimum values. 2)Bars with different lower-case letters indicate significant difference(P<0.05). The same below.
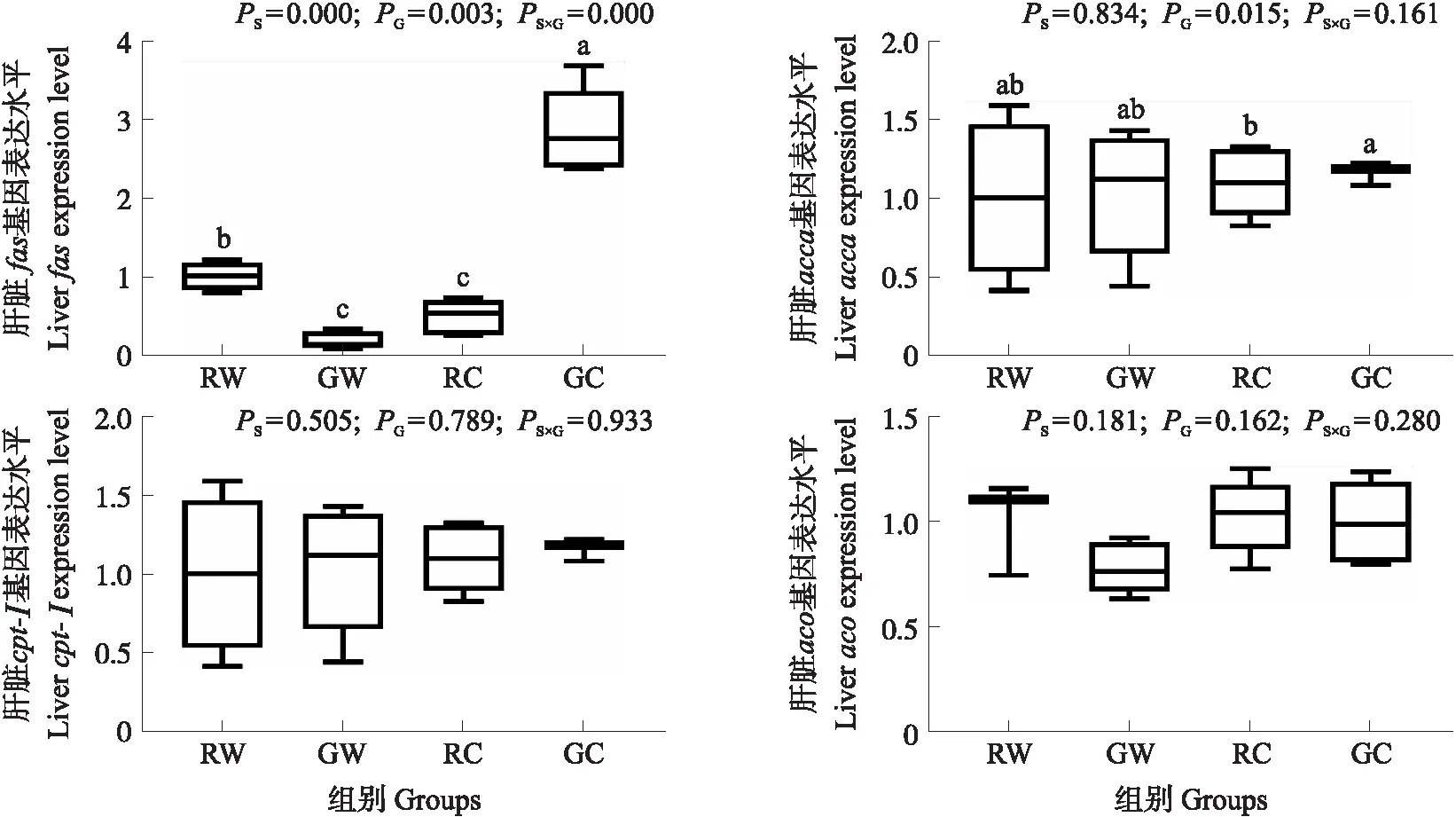
图2 不同淀粉来源及其糊化程度对团头鲂肝脏脂肪代谢相关基因表达的影响Fig.2 Effects of different starch sources and gelatinization degrees on the expression of lipid metabolism-related genes in blunt snout bream
3 讨论
3.1 不同淀粉来源及其糊化程度对团头鲂生长性能与养分消化率的影响
本试验中,糊化淀粉组的干物质消化率显著高于生淀粉组,而蛋白质与脂肪的消化率也呈现类似结果,但无显著差异。这与虹鳟(Oncorhynchusmykiss)对不同淀粉源利用率的结果相同[27],说明糊化能提高水产动物对淀粉的消化率。究其原因,可能有以下两点:1)糊化使淀粉分子内α-1,4-糖苷键断裂,产生大量小分子糖类如葡萄糖、麦芽糖与糊精等,进而提高了其消化率[28];2)糊化处理过程中淀粉离开模具的瞬间压力骤降、水分大量蒸发,使得淀粉颗粒内部产生大量空泡[29],这有利于淀粉酶渗透进入淀粉颗粒,从而提高其消化率。此外,葡萄糖与其他养分(如氨基酸)的吸收均需要以钠离子为主的偶联转运载体参与[30],其吸收过程可能存在协同效应,进而促进蛋白质与脂肪的消化吸收。然而,本试验中生淀粉组的增重率、特定生长率和采食量显著高于糊化淀粉组。可能由于糊化淀粉进入肠道后被快速消化吸收,短时间内释放大量葡萄糖进入血液,而鱼体相关代谢酶的生理响应存在一定滞后性,导致餐后持续高血糖症状[31-32],增加了鱼体代谢负担进而导致摄食量下降,最终影响其生长性能。另外,糊化淀粉具有较强的黏性[33],可增加食糜在肠道中的潴留时间,增强鱼体饱腹感,从而降低采食量和生长性能。此外,淀粉来源与糊化程度的交互作用显著影响干物质消化率、增重率、特定生长率和采食量。使用玉米和小麦淀粉作为糖源时,糊化处理对上述指标的影响不同。可能是由于二者直链淀粉与支链淀粉的比例不同,直链淀粉与脂质形成的具有抗酶解作用的复合物含量也不尽相同[34],进而影响水产动物对养分的利用率。
3.2 不同淀粉来源及其糊化程度对团头鲂血浆生化指标及肝脏糖原与脂肪含量的影响
本试验中,糊化淀粉组血糖水平与肝糖原含量均显著高于生淀粉组,说明摄食糊化淀粉后鱼体更倾向于将葡萄糖合成肝脏糖原以维持血糖稳态。这与金头鲷对不同糖源利用率的结果相似[35]。究其原因,可能在于糊化淀粉结构相对松散且对淀粉酶的敏感性较高,肠道对其消化和吸收率较高,导致鱼体出现餐后高血糖症状;而血糖升高会诱导胰岛素合成和释放,进而促进糖原合成与沉积[36]。过量的肝糖原沉积可导致肝脏病理性变化,进而影响鱼体代谢机能和生长。然而,对虹鳟的研究发现,糊化淀粉首先诱导了肝脏脂肪合成,而肝糖原含量在养殖1个月后显著升高[37]。可能由于鱼类食性差异所导致的糖代谢调控策略不同。本研究中,淀粉来源与糊化程度的交互作用显著影响血糖水平与肝糖原含量,且二者均以糊化玉米淀粉组最高。可能由于糊化玉米淀粉的利用率较高,其在消化道被消化吸收后,大量葡萄糖迅速进入血液进而导致餐后高血糖症状[38]。较高的血糖水平可能超过鱼体的承受范围,造成鱼体代谢障碍,表现出较慢的生长速度。此外,过高的血糖水平可激活肝脏糖原合成途径,导致糖原大量生成以维持机体血糖稳态[39]。因此,以上结果表明,糊化淀粉可提高鱼体血糖水平并促进肝糖原蓄积,进而导致机体代谢负担,这可能是其消化率提高,但生长性能降低的部分原因。
3.3 不同淀粉来源及其糊化程度对团头鲂肝脏糖脂代谢相关基因表达的影响
本试验中,不同淀粉来源仅显著影响肝脏fas表达,且小麦淀粉组最低。这表明,与玉米淀粉相比,长期饲喂小麦淀粉可抑制鱼体脂肪合成,并降低鱼体脂肪沉积。研究表明,FAS是机体脂肪酸从头合成过程中的限速酶,其转录水平可反映机体脂肪合成程度[40]。因为玉米淀粉中直链淀粉含量高于小麦淀粉,而团头鲂为淡水草食性鱼类,对直链淀粉利用率相对较高。大量摄入高利用率淀粉会激活鱼体脂质合成途径,继而促进脂肪合成与沉积[41]。此外,糊化淀粉组g6pdh、fas与accα的表达水平均显著高于生淀粉组。这表明,与生淀粉相比,摄食糊化淀粉可显著促进鱼体脂肪合成。与fas类似,accα也是脂肪酸从头合成的限速酶;而g6pdh是磷酸戊糖途径中的关键酶,该途径生成的NADPH是脂肪酸从头合成的重要能量来源[40]。g6pdh、fas与accα表达水平的高低在一定程度上反映鱼体脂肪合成能力的变化[42]。因为糊化处理提高了淀粉利用率,进而促进了鱼体脂肪合成。然而,各组血浆甘油三酯水平并无明显差异,表明合成的脂肪可能主要以脂滴形式沉积在肝脏等组织中[43]。另外,淀粉来源与糊化程度的交互作用显著影响g6pdh、fas与accα基因的表达,且三者均以糊化玉米淀粉组最高。推测原因,可能在于糊化玉米淀粉的利用率较高,其在机体内产生大量葡萄糖,激活了鱼体脂肪合成途径,致使脂肪大量生成以调节机体葡萄糖稳态。此外,糊化淀粉组肝糖原含量显著高于其他组,而各组间的gs表达水平并无显著差异。其原因可能在于gs活性受到翻译后修饰的调控,导致其转录水平与酶活性之间的结果不吻合[44]。然而,具体调控机制尚需进一步研究。
本研究结果表明,淀粉糊化程度对团头鲂的生长性能、养分消化率和糖脂代谢均有显著影响,而淀粉来源的影响相对较小。综合来看,生玉米淀粉组增重率和干物质消化率较高,而血糖水平及糖原与脂肪沉积较低,更适合作为团头鲂的糖源。

