新型抗真菌聚硫烷的合成和筛选及对白色念珠菌的抑菌作用
姚依然,杨 普,吴浩东,甘 磊,毕师诚,曹礼静,王庆华*
(1.西南大学 动物医学学院,重庆 荣昌 402460;2.重庆市荣昌区职业教育中心,重庆 荣昌 402460)
白色念珠菌(Candidaalbicans)广泛存在于大自然环境中,可引起多种动物感染,尤其是免疫力低下的幼龄动物,常常通过皮肤、口腔或阴道黏膜侵入机体,治疗不及时会继发多系统疾病[1-3]。该菌常引起家禽死亡,特别是幼禽,据报道4周龄内的幼禽病死率可达50%[4],而3月龄以上成年禽类的感染易治愈。其中鸡感染白色念珠菌后常表现精神沉郁、食欲减退、羽毛蓬乱,食欲废绝,常常在感染的2 d内就会出现大批死亡,而动物往往缺乏相应的抗真菌剂治疗,导致鸡群的病死率超过30%[5]。此外,据报道感染白色念珠菌后鸽子的发病率达10%,病死率达5%[6]。
现有的白色念珠菌治疗药物多为三唑类(如:氟康唑)、多烯类(如:两性霉素B)、棘白菌素类(如:卡泊芬净)等传统的抗真菌性药物,而这些药物的大量使用会导致耐药性白色念珠菌泛滥,且长期使用这些药物还会产生各种毒副作用,影响肝、肾等脏器功能[7-10]。但目前在动物饲料和药品中禁用绝大多数抗真菌药[11-13],因此在这种政策背景下,开发新型的抗白色念珠菌的动物用抗真菌剂显得极为迫切。很多研究表明,将有机硫化合物转化为无机硫化物可以产生具有抑菌功效的聚硫烷[14-16],并且纳米级聚硫烷显示出高效的抗细菌活性、低细胞毒性、高生物相容性等优点[17-18],但目前尚缺乏聚硫烷抗侵袭性真菌(比如白色念珠菌)的相关研究报道。
本研究从发生了流行性皮肤病的重庆市某养鸡场分离到疑似白色念珠菌的致病菌,对其进行形态学和分子生物学鉴定。采用皮肤涂布法构建白色念珠菌分离株的皮肤感染模型,并使用本实验室合成的聚硫烷研究其抗真菌特性和对侵袭性真菌皮肤病的愈合作用。通过检测其对致病菌的菌落大小、孢子萌发及凋亡与坏死、菌丝体数量等情况来探究其抑菌作用,为防控侵袭性真菌特别是白色念珠菌病的流行、开发新型抗真菌剂提供理论和技术支持。
1 材料与方法
1.1 病料来源及实验动物经调研发现,重庆市某养鸡场疑似发生侵袭性真菌流行性皮肤病,病鸡精神萎靡,食欲不振,饮水量增加,皮肤发痒、干燥,羽毛杂乱无光泽,皮肤干燥,鸡嗉囊肿大松驰,鸡冠变暗,背腰部皮肤有一层灰白色鳞屑附着,用刀片采集作为检测病料。
白来航鸡140只,体质量1~2 kg,饲养于西南大学动物医学院动物饲养室。每天定时饲喂,并清扫鸡舍,提供良好的饲喂环境及条件。试验结束后试验鸡被执行安乐死,本研究通过了西南大学实验动物福利伦理审查(伦理审查号:IACUC-20200701-01)。

A.YPD平板上划线培养出边缘有皱褶的白色菌落;B.乳酸酚棉兰染色后,显微镜下观察到大量的蓝色的芽生菌体(400×)
1.2 主要试剂酵母浸出粉胨葡萄糖琼脂培养基(YPD)购自北京索莱宝科技有限公司;药敏纸片购自杭州滨和微生物试剂有限公司;乳酸酚棉蓝染液购自青岛海博生物科技有限公司;真菌DNA基因组提取试剂盒购自北京天根生化科技有限公司;2×Taq PCR Master Mix和DL2000 DNA Marker均购自北京擎科生物科技有限公司;凋亡坏死试剂盒购自上海碧云天生物科技公司;引物由上海生工生物工程技术服务有限公司合成。
1.3 白色念珠菌的形态学鉴定和分子生物学鉴定
1.3.1病原菌的分离培养和形态学鉴定 用刀片刮取病鸡背腰部皮肤鳞屑,将其接种于YPD液体培养基中,30℃、150 r/min震荡增菌培养48 h,再接种于YPD固体培养基上,置于30℃恒温培养箱培养72 h,并继续传代培养,观察菌落特征,从纯化后的单个菌落挑取病原菌进行乳酸酚棉蓝染色镜检,观察菌体染色情况[19]。
1.3.2病原菌的分子生物学鉴定 以真菌核糖体RNA基因的内转录间隔区(rDNA-ITS)为扩增目的基因,选用真菌rDNA—ITS通用扩增引物,引物序列:上游引物:5′-TCCGTAGGTGAACCTGCGG-3′;下游引物:5′-TCCTCCGCTTATTGATATGC-3′。预计扩增产物的大小为500 bp[20-21]。PCR反应的特异性引物是根据白色念珠菌ITS1-ITS2部分的保守序列,采用生物信息学软件Primer select设计1对特异性引物。上游引物:5′-GGAAGTAAAAGTCGTAACAAGG-3′;下游引物:5′-GCTGCGTTCTTCATCGATGC-3′。预计扩增产物的大小为471 bp[22]。引物均由上海生工生物工程技术服务有限公司合成。使用真菌DNA基因组提取试剂盒提取纯培养病原菌DNA。RCR反应体系25 μL:2×Taq PCR Master Mix 12.5 μL,DNA模板2 μL,上、下游引物各1 μL,Sterilized ddH2O补足25 μL。PCR反应条件:94℃ 4 min;94℃ 30 s;55℃ 30 s;72℃ 1 min,共35个循环;72℃ 10 min。扩增反应结束后,取5 μL扩增产物进行琼脂糖凝胶电泳30 min(110 V),然后在凝胶成像仪上成像,观察是否扩增出目的条带,记录结果并拍照保存。
1.4 新型聚硫烷的不同合成方法和抑菌作用测定
1.4.1新型聚硫烷的不同合成方法 取无机硫(硫化钠、硫酸铁)、有机硫(半胱氨酸、胱氨酸)按照设定的配方(配方1:硫化钠1.21 g、乙酸钠3.6 g、半胱氨酸0.5 g;配方2:硫化钠1.21 g、半胱氨酸0.5 g;配方3:硫酸铁为1.21 g、乙酸钠3.6 g、胱氨酸0.5 g;配方4:硫酸铁为1.21 g、胱氨酸0.5 g)分别使用20 mL蒸馏水混匀,置于37℃温箱中,使用磁力搅拌器混合,置于200℃高压反应釜分别反应6,12,24,36 h[14-15,23],高温反应结束后,使用高速低温离心机,12 000 r/min,4℃离心后取上清,分离出聚硫烷。并于马尔文激光粒度仪上进行粒径的测定。
1.4.2使用药敏试验(滤纸片扩散法)筛选出具有最佳抑菌活性的聚硫烷 将上述不同合成方法获得的聚硫烷进行滤纸片扩散试验,在YPD固体培养基上均匀涂布浓度为105CFU/mL的白色念珠菌,滤纸片放到平皿中,将平板倒置于30℃恒温培养箱中培养24 h,观察聚硫烷对白色念珠菌(浓度为105CFU/mL)的抑菌效果,重复3次,取平均值。
1.4.3最低抑菌浓度(MIC)的测定 YPD液体培养基稀释菌液至浓度为3.5×105CFU/mL备用,用微量二倍稀释法测定聚硫烷对白色念珠菌的MIC,重复3次。
1.4.4最低杀菌浓度(MBC)的测定 在上述MIC测定实验的基础上,进一步将MIC试验中反应孔内未出现浑浊的培养液,接种至YPD液体培养基上进一步培养,如无白色念珠菌生长则认为该浓度具有杀灭白色念珠菌作用,此时最低的杀灭白色念珠菌的浓度记录为MBC。
1.5 聚硫烷的毒性试验预试验选取60只鸡,试验前禁食12 h,按照10,40,80 g/kg的剂量灌服聚硫烷,观察和记录鸡死亡情况,根据预实验灌服聚硫烷后鸡的状态和死亡数,来设置正式试验中灌服聚硫烷的剂量。根据预试验的结果,正式试验采用改良寇氏法,按照预试验计算所得剂量间距,将鸡分5组,每组10只,驯化饲养3 d,试验前禁食不禁水12 h,经口灌服聚硫烷,灌胃3 h后自由进食。观察并记录各组死亡情况,根据按公式LD50=log-1[Xm-i(Σp-0.5)]计算,求半数致死量(LD50)。(注:Xm为最大剂量组剂量对数值;i为相邻2组对数剂量的差值;p为各组鸡病死率;∑P:各组动物病死率之总和)。
1.6 聚硫烷对鸡白色念珠菌性皮肤病的治疗作用在创建白色念珠菌性皮肤病疾病模型前,对实验鸡连续3 d注射地塞米松免疫抑制剂以降低鸡的免疫力。而后划破鸡皮肤表皮层,制造10 mm×10 mm的伤口。创建皮肤伤口模型后,将实验鸡随机分为白色念珠菌感染组、聚硫烷治疗组、生理盐水组(n=10)。吸取6.8×108CFU/mL白色念珠菌液50 μL均匀涂布到皮肤伤口处,创建白色念珠菌感染组。使用上述剂量的白色念珠菌感染伤口后,使用质量浓度为7.8 g/L的聚硫烷涂抹50 μL创建聚硫烷治疗组,而生理盐水组则在伤口处只涂抹50 μL的生理盐水。
1.7 聚硫烷抑制白色念珠菌菌落生长分别取107,106,105,104,103CFU/mL白色念珠菌菌悬液10 μL滴至含不同质量浓度(0,0.10,0.20,0.39 g/L)聚硫烷的YPD固体平板上,于30℃恒温箱中静置培养10 d,以观察聚硫烷对白色念珠菌菌落大小的影响。
1.8 聚硫烷抑制白色念珠菌孢子萌发率试验使用液体YPD培养基将白色念珠稀释至107CFU/mL,并用不同质量浓度的聚硫烷(0,0.10,0.20,0.39 g/L)30℃条件下处理4 h,加入PBS溶液重悬菌体,磁力搅拌器中搅拌8 min,使聚集成团的孢子均匀分散于溶液中。显微镜下观察并计算孢子萌发率,孢子萌发率=萌发孢子数/总孢子数×100%[24]。每组设置3个重复,每个重复统计200个孢子的萌发率,取平均值。
1.9 聚硫烷抑制白色念珠菌菌丝体试验根据参考文献制备制备107CFU/mL的菌悬液,检测聚硫烷抑制白色念珠菌菌丝体繁殖效果[8]。107CFU/mL的菌悬液用1 mL小牛血清重悬,于培养箱内30℃孵育4 h。取出1滴悬浮液,置于显微镜下确认有芽管出现后,将菌体重悬于RPMI-1640培养基中30℃恒温培养箱中静置孵育6 h,以生成菌丝体。根据聚硫烷质量浓度的不同,试验分为4组,即:0,0.10,0.20,0.39 g/L,每组各设3个重复。使用RPMI-1640培养基将聚硫烷母液稀释至所需的质量浓度(0,0.10,0.20,0.39 g/L)。于30℃恒温培养箱处理24 h后用光学显微镜观察不同质量浓度聚硫烷作用下的菌丝体。扩大培养至100 mL,记录各组培养液中菌丝体的鲜重。
1.10 聚硫烷诱导白色念珠菌孢子凋亡和坏死试验
1.10.1台盼蓝染色法检测聚硫烷诱导白色念珠菌孢子的坏死率 台盼蓝染料正常情况下被细胞壁和细胞膜阻拦在活细胞外,只有细胞壁和细胞膜受损后,才能进入细胞,从而与坏死孢子的DNA结合,使DNA染为蓝色,因此,活细胞一般不能被台盼蓝染色,而死细胞会被染成蓝色[25]。具体操作方法是:白色念珠菌孢子悬浮液用生理盐水稀释至107CFU/mL,加入不同质量浓度的聚硫烷(0,0.10,0.20,0.39 g/L)到各试验组。置于30℃恒温培养箱培养4 h后取出,使用5 μL台盼蓝进行染色,10 min内于显微镜下计数染成蓝色的白色念珠菌,并统计白色念珠菌坏死率。
1.10.2流式细胞仪进一步确认聚硫烷诱导白色念珠菌孢子的坏死率和凋亡率 107CFU/mL白色念珠菌孢子分别经不同质量浓度的聚硫烷(0,0.10,0.20,0.39 g/L)于30℃条件下处理4 h后,10 000 r/min离心5 min收集孢子。用400 μL Binding Buffer重悬,分别加入5 μL标记Ca2+依赖性结合蛋白的异硫氰酸荧光素(Annexin-FITC)、5 μL碘化丙啶(PI)进行染色。使用流式细胞仪检测聚硫烷诱导的白色念珠菌孢子凋亡和坏死情况[26]。凋亡中期(Q2象限)和凋亡晚期的细胞(Q3象限)记录为凋亡细胞,凋亡晚期细胞(Q2象限)和坏死细胞(Q1象限)记录为坏死细胞。

A.不同配方(配方1、配方3、配方3原液)合成的聚硫烷对白色念珠菌的药敏试验;B.配方3合成的聚硫烷对白色念珠菌的MIC实验

A.配方3合成的聚硫烷的粒径分布特征;B.配方3合成的聚硫烷在自然光下呈棕黄色

A.在鸡皮肤伤口涂抹白色念珠菌;B.在鸡皮肤伤口涂抹白色念珠菌后,第3天涂抹聚硫烷;C.在鸡皮肤伤口涂抹生理盐水

A.不同质量浓度聚硫烷(0,0.10,0.20,0.39 g/L)抑制白色念珠菌在YPD固体培养基上的生长;B.不同质量浓度聚硫烷(0,0.10,0.20,0.39 g/L)抑制白色念珠菌菌落直径的折线图;C.显微镜下观察不同质量浓度的聚硫烷抑制白色念珠菌孢子的萌发(放大10×40倍);D.不同质量浓度聚硫烷(0,0.10,0.20,0.39 g/L)抑制白念珠菌孢子的萌发率(与空白组(无)相比,**P<0.01)
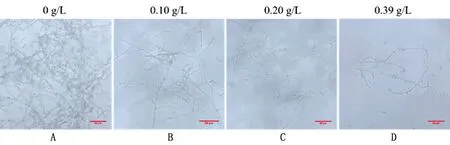
A.未添加聚硫烷组的白色念珠菌菌丝体大量繁殖;B.0.10 g/L质量浓度的聚硫烷抑制了菌丝体数量;C.0.20 g/L质量浓度的聚硫烷聚硫烷抑制了菌丝体数量;D.0.39 g/L质量浓度的聚硫烷聚硫烷抑制了菌丝体数量
1.11 数据统计分析采用SPSS 22.0软件进行数据处理,组间比较采用方差分析和t检验进行分析,以P<0.05为显著水平,P<0.01为极显著水平。
2 结果
2.1 白色念珠菌的形态学鉴定和分子生物学鉴定
2.1.1白色念珠菌的分离和形态学鉴定 分离菌在YPD固体培养基上划线培养48 h后,平板上可见乳白色、圆形的菌落,其表面略粗糙,边缘有皱褶出现,无色素沉着,菌落直径为2 mm左右(图1A);在YPD液体培养基中呈浑浊生长;经乳酸酚棉兰染色,显微镜下镜检可见蓝色的圆形或卵圆形单个、成堆排列的菌体,外部有荚膜,有的可见较小的芽生菌体,背景为淡蓝色乳酸酚棉兰染液(图1B)。
2.1.2白色念珠菌的分子生物学鉴定结果 在提取病原菌DNA经PCR扩增后,用1%琼脂糖凝胶进行电泳,其rDNA-ITS PCR扩增产物大小靠近500 bp左右(图2A),白色念珠菌PCR产物在471 bp附近出现目的条带(图2B),扩增目的片段与预期白色念珠菌片段大小均一致。
2.2 不同方法合成的聚硫烷对白色念珠菌的药敏试验、MIC和MBC药敏试验结果表明(图3A):和其他合成方法相比,使用配方3(硫酸铁为1.21 g、乙酸钠3.6 g、胱氨酸0.5 g)在200℃高温反应釜中反应12 h合成的聚硫烷对白色念珠菌的抑菌效果最好,抑菌圈直径是15.3 mm,白色念珠菌对使用配方3合成的聚硫烷是高度敏感的。而使用配方1(硫化钠1.21 g、乙酸钠3.6 g、半胱氨酸0.5 g)在200℃高温反应釜中反应12 h合成的聚硫烷对白色念珠菌的抑菌效果比较好,抑菌圈直径是11.2 mm。另外,白色念珠菌对配方1~配方4的原液均不敏感,具体见表1。

表1 不同合成方法获得的聚硫烷对白色念珠菌的药敏试验结果
通过采用96孔板进行微量二倍稀释法检测本课题组合成的聚硫烷对白色念珠菌的MIC。通过微量二倍稀释实验发现聚硫烷对白色念珠菌的MIC是0.78 g/L(图3B)。取MIC孔内澄清的培养液接种到新鲜的YPD固体培养基上培养,无菌生长的最低质量浓度为1.56 g/L,即聚硫烷对白色念珠菌的MBC是1.56 g/L。
2.3 聚硫烷的最佳合成方法(配方3)及粒径测定使用药敏筛选发现:使用配方3的无机硫和有机硫可以有效的转化为具有最佳抗菌效果的聚硫烷,其合成方法为:硫酸铁为1.21 g、乙酸钠3.6 g、胱氨酸0.5 g使用蒸馏水20 mL混匀,置于37℃温箱中,使用磁力搅拌器混合2 h后,置于200℃高压反应釜反应12 h。聚硫烷合成反应结束后,12 000 r/min离心5 min,取上清,于马尔文激光粒度仪上进行聚硫烷粒径的测定。制得的聚硫烷平均粒径在162 nm左右(图4A),溶液澄清透明呈棕黄色(图4B)。4℃保存备用。
2.4 聚硫烷(配方3)的毒性试验毒性试验发现当聚硫烷灌服剂量达到39.60 g/kg时,幼鸡开始出现死亡,聚硫烷灌服剂量越高,幼鸡的病死率越高。当聚硫烷灌服剂量达到101.86 g/kg时,幼鸡全部死亡。据公式LD50=log-1[Xm-i(Σp-0.5)]计算,得出LD50为65 g/kg。在下述的聚硫烷对鸡白色念珠菌性皮肤病的治疗试验中,要求治疗剂量远远低于本研究得出的中毒剂量。
2.5 聚硫烷(配方3)对鸡白色念珠菌性皮肤病的治疗作用使用聚硫烷治疗鸡白色念珠菌性皮肤病的实验结果显示,与生理盐水(图5C)组相比,白色念珠菌感染组(图5A)的伤口红肿明显,在伍德氏灯下发现伤口周围有大量的黄绿色荧光,说明白色念珠菌大量繁殖,在第4~5天,伤口扩大,触摸伤口有疼痛表现(鸡表现兴奋、狂躁),第6~9天伤口大小变化不明显,在第10~13天伤口逐渐缩小自愈,痂皮脱落,伍德氏灯下没有发现黄绿色荧光。而聚硫烷治疗组(图5B)在第6天,结痂脱落,伤口及周围黄绿色荧光消失,伍德氏灯下没有发现黄绿色荧光。
2.6 聚硫烷(配方3)抑制白色念珠菌菌落直径、抑制孢子萌发率聚硫烷抑制白色念珠菌菌落直径结果显示(图6A):在相同生长周期下(均培养10 d),在YPD固体培养基上,不同质量浓度的聚硫烷能够抑制白色念珠菌菌落的直径增长(图6B),而且聚硫烷对白色念珠菌的抑制作用随其质量浓度的增加而增加,呈剂量依赖性。
聚硫烷抑制白色念珠菌孢子萌发率测定结果显示(图6C):不同质量浓度的聚硫烷能够显著抑制孢子萌发率(P<0.01),其抑制作用随其聚硫烷质量浓度的增加而增加,而且在光学显微镜下(放大10×40倍)也验证了其抑菌作用随聚硫烷质量浓度的增加而递增的特征(依据培养液中聚硫烷质量浓度从低到高的顺序,孢子萌发率依次平均为86%,25%,8%,2%)(图6D)。综上,聚硫烷可以有效抑制白色念珠菌菌落的生长,降低孢子萌发率,并呈剂量依赖效应。
2.7 聚硫烷(配方3)抑制白色念珠孢子转化为菌丝体聚硫烷抑制白色念珠孢子转化为菌丝体结果显示(图7):在未添加聚硫烷组中,由小牛血清和RPMI-1640培养基诱导培养的白色念珠菌在培养10 h后形成了相互交错、致密细长的菌丝体(图7A)。而和未添加聚硫烷组相比,添加0.10 g/L聚硫烷的菌丝体数量显著较少(图7B)(P<0.01),并且随着聚硫烷质量浓度升高(图7C、D),菌丝体鲜重(依据聚硫烷质量浓度从小到大的顺序,每100 mL培养液中菌丝体的鲜重依次变为为6.9,1.1,0.9,0.4 g)逐渐降低,与聚硫烷质量浓度呈负相关的关系。因此聚硫烷抑制了孢子向侵袭性菌丝体的转变,阻断白色念珠菌的增值和传播。
2.8 聚硫烷(配方3)诱导白色念珠菌孢子凋亡与坏死白色念珠菌孢子经台盼蓝染色后使用显微镜观察并计算了聚硫烷处理下白色念珠菌孢子的坏死率。结果发现,在聚硫烷的作用下,白色念珠菌孢子出现坏死,并且坏死率随着聚硫烷质量浓度的升高而增大(图8A)。此外,还通过PI和Annexin-FITC双染后使用流式细胞仪检测了聚硫烷诱导白色念珠菌孢子的凋亡和坏死情况,结果发现随着聚硫烷质量浓度(0,0.10,0.20,0.39 g/L)的升高,白色念珠菌孢子凋亡率(根据聚硫烷质量浓度的增加,凋亡率依次为3.30%,30.70%,43.00%,57.50%)和坏死率(根据聚硫烷质量浓度的增加,坏死率依次为0.39%,12.37%,16.81%,21.51%)相应升高(根据聚硫烷质量浓度的增加,依次为图8B~E)。以上结果表明,聚硫烷通过剂量依赖性方式诱导白色念珠菌孢子发生凋亡和坏死。
3 讨论
据统计,由真菌引起的皮肤感染中,白色念珠菌占感染的80%~90%[27],尤其在气候剧烈变化、饲料和饲养环境变化和长途运输情况下,白色念珠菌感染率更高[28]。本研究在重庆地区养鸡场流行性皮肤病的皮屑中分离鉴定出白色念珠菌,通过动物回归试验,确认分离出的致病菌白色念珠菌可以引起鸡皮肤感染,并合成和筛选了具有抗白色念珠菌特性的抗真菌剂聚硫烷,为当地侵袭性白色念珠菌的预防和治疗打下了基础。
采用不锈钢釜体和聚四氟乙烯的热反应体系,具有合成方法简单,化学反应时间比较短的优点[29],适合大多数科研院所的科学试验甚至小规模中试生产。多个文献报道,通过化学方法制备的无机纳米材料硫化物抗细菌和抗肿瘤效果明显[30-31]。本研究采用次热反应体系快速合成了具有抗侵袭性真菌的聚硫烷,而且在同样的化学合成条件下,胱氨酸比半胱氨酸对白色念珠菌抑菌作用更强,其原因可能是胱氨酸比半胱氨酸的有机含硫量大,从而产生较多的聚硫烷。
本研究发现,聚硫烷能够抑制白色念珠菌孢子萌发、抑制孢子向侵袭性菌丝体转变,从而阻断白色念珠菌的增值和传播,其抑菌作用与聚硫烷浓度呈正相关。白色念珠菌孢子通常附着在宿主细胞上,当机体免疫屏障机能下降时白色念珠菌孢子萌发,往往通过角质层和上皮层侵入机体,也就是导致皮肤和黏膜损伤后随之损伤其他内脏器官,最终导致动物大范围发病甚至大规模死亡[32]。根据毒性试验结果,聚硫烷对鸡LD50为65 g/kg,远远大于本感染模型使用的治疗剂量,因此本研究使用的剂量为安全剂量。本课题组相信后期经过合成工艺、合成配方的深入的优化后,期待聚硫烷可以更安全和更广泛地应用于生物及医药领域。
综上,本研究合成并筛选了抗侵袭性真菌的新型抗真菌剂聚硫烷,探究了其对流行性白色念珠菌的抑菌作用,填补了无机纳米级硫化物抗侵袭性真菌的研究空白。

