猪δ冠状病毒M蛋白截短表达及单克隆抗体的制备
董昭良,于瑞明,张莉萍,董昭彤,王永录,潘 丽,杜晓华*,刘新生*
(1.甘肃农业大学 动物医学学院,甘肃 兰州 730070;2.中国农业科学院 兰州兽医研究所,甘肃 兰州730064;3.西安交通大学 钱学森学院,陕西 西安 710048)
猪δ冠状病毒(porcine deltacoronavirus,PDCoV)也称为猪丁型冠状病毒,可引起猪急性腹泻,呕吐,脱水甚至哺乳仔猪死亡[1]。该冠状病毒最早于2007年由中国学者DONG等[2]在野生亚洲豹猫和中国白鼬獾中检测发现,但当时并未提出δ冠状病毒的命名[3]。WOO等[4]于2012年在猪粪便样品中检测到该冠状病毒,同时进行流行病学调查发现了6种禽源和1种猪源的新型冠状病毒。2014年2月[5],美国学者在腹泻仔猪肠道内容物及LLC-PK细胞中首次分离出PDCoV OH-FD22株[6-7],随后,包括中国在内的亚洲等许多国家也相继报道了PDCoV感染的病例[8-12]。给世界各个国家的养猪业造成了重大的经济损失[13-15]。此外,近年来国内外有关研究表明,PDCoV具有广泛的宿主谱,除感染猪之外,还可以感染牛[16]、鸡[17]、火鸡[18]。最新的研究结果显示,从患有急性发热疾病的海地儿童血浆中也检测到PDCoV的存在,首次证实了PDCoV能够感染人[19-20]。目前,尚没有应对PDCoV感染的商品化抗病毒药物和疫苗,因此,非常有必要建立特异性强、准确快捷的PDCoV检测方法,为该病的临床快速检测及基础研究提供重要的方法学基础。
PDCoV是一种具有囊膜、单股、正链RNA病毒,属于套式病毒目、冠状病毒科、δ冠状病毒属,病毒直径为60~180 nm,基因组大小为25.4 kb(除poly(A)尾巴),是目前已知冠状病毒基因组中最小的,PDCoV主要编码4种结构蛋白(S、E、M和N)、3个辅助蛋白(NS6、NS7、NS7a)[21-23]及15个非结构蛋白(nsp2-nsp16);M蛋白是病毒囊膜表面最丰富的跨膜运输蛋白,通过比对NCBI公布的不同PDCoV毒株的M基因序列发现其同源性在99%,常作为建立核酸诊断技术的靶基因[24]或血清学诊断[6,9,25]。M蛋白可分为3部分:即暴露于病毒囊膜外短的糖基化N末端区、病毒囊膜中大的C末端区和中间的α螺旋区。也有研究表明,该蛋白在刺激宿主机体产生免疫反应中有着重要作用以及刺激机体产生α干扰素[26]、负责营养物质的运输[27]、并且也在病毒粒子的组装、出芽[28-29]过程中发挥作用。本研究利用截短表达的PDCoV M蛋白制备了特异性单克隆抗体,为PDCoV临床快速诊断检测方法的建立及基础研究提供重要材料。
1 材料与方法
1.1 病毒、细胞及主要试剂PDCoV流行株CH/XJYN/2016(MN064712),猪小肠肾上皮细胞(LLC-PK细胞)、杂交瘤细胞(SP2/0细胞)由本实验室分离、保存。原核表达载体pCold Ⅱ由本实验室保存,E.coliBL21(DE3)感受态购自宝日医生物技术(北京)有限公司、SPF级6~8周龄BALB/c雌鼠由兰州兽医研究所实验动物中心提供。碧云天超敏ECL化学发光试剂盒购自碧云天生物技术;BamHⅠ限制性内切酶和HindⅢ限制性内切酶购自New England Biolabs(NEB)公司;AxyPrepTMDNA凝胶回收试剂盒和HRP标记羊抗鼠购自Cayman公司;亲和层析柱料购自汇研生物技术有限公司;SBA Clonotyping System-HRP购自Southern Biotech;PDCoV N蛋白单克隆抗体由本实验室制备;弗氏完全佐剂、弗氏不完全佐剂、50%PEG融合剂、HAT选择性培养基和HT选择培养基购自SIGMA。
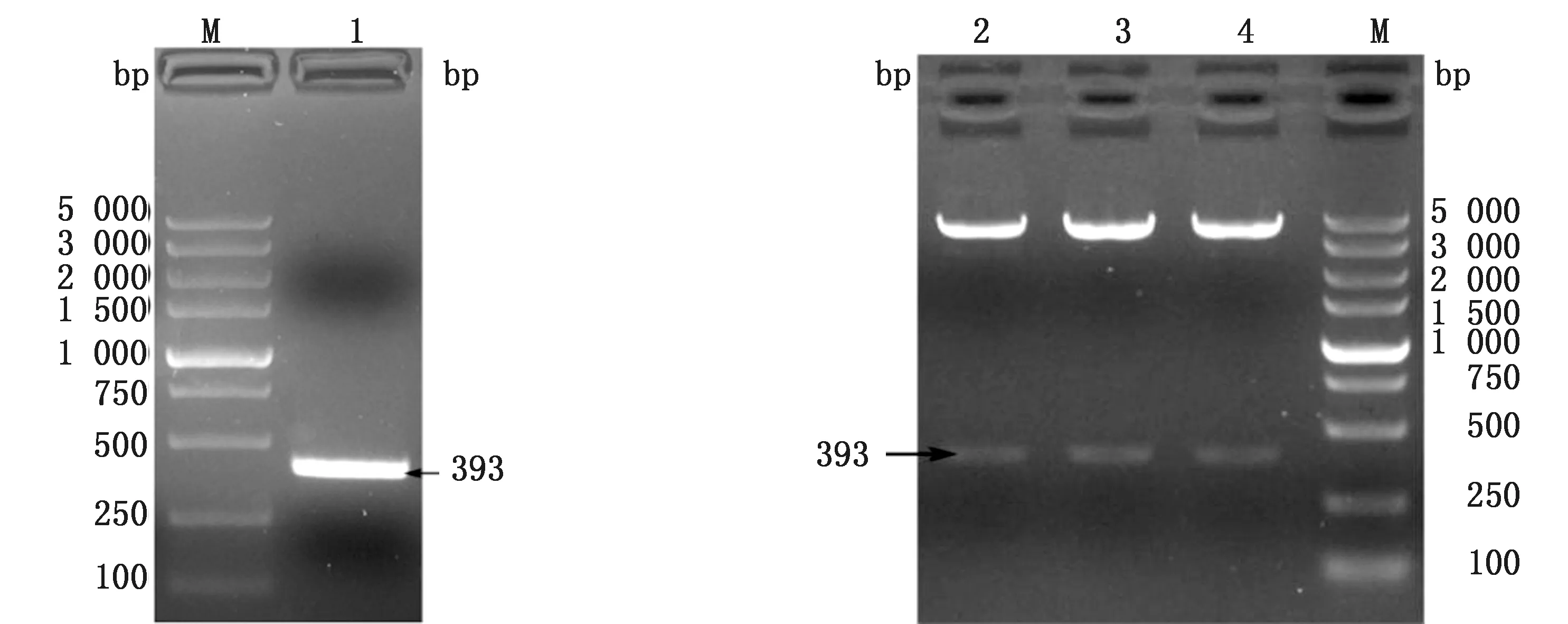
M.DL5000 DNA Marker;1.PDCoV M基因;2~4.pCold II-PDCoV-M双酶切产物
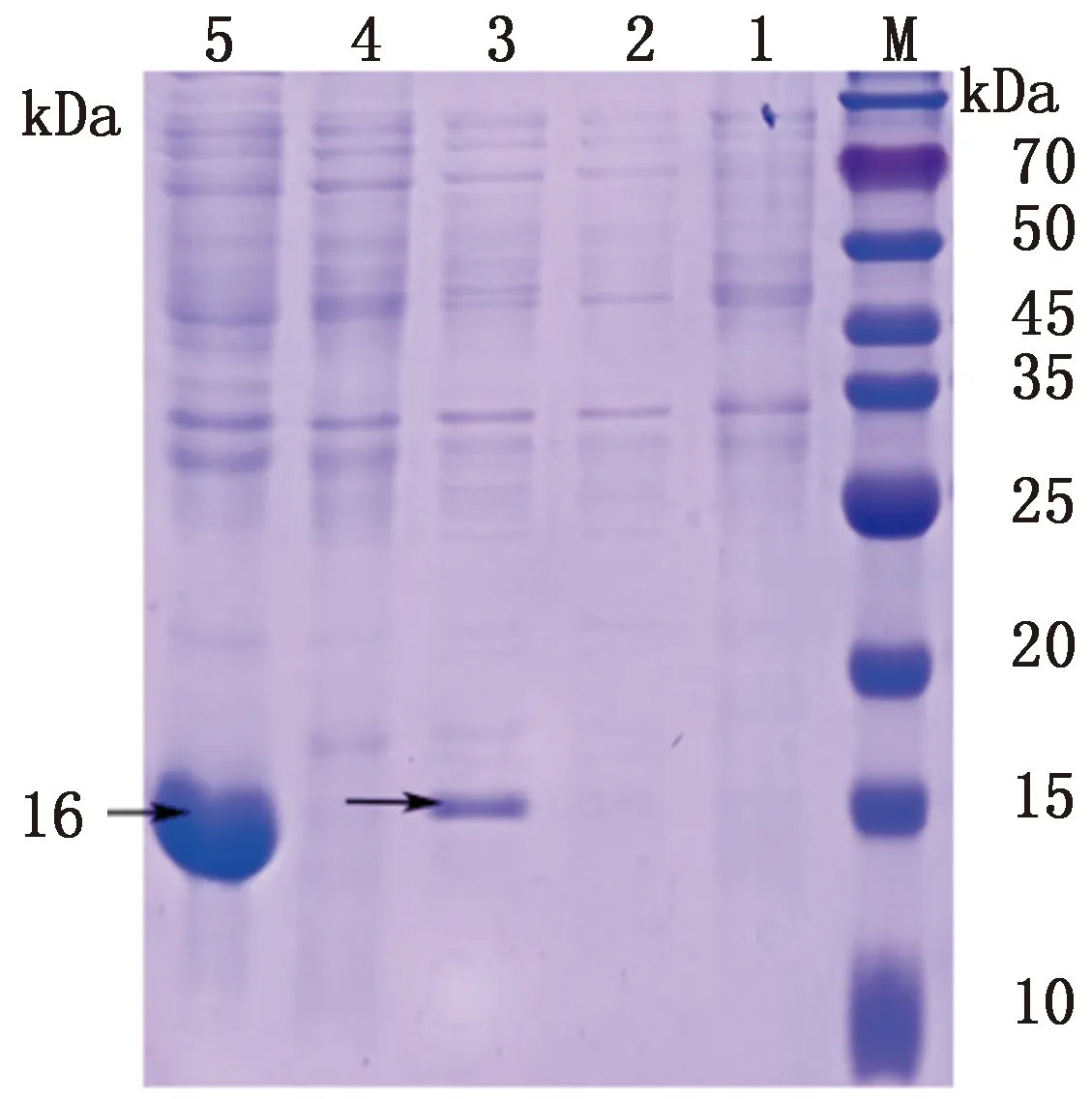
M.蛋白分子质量标准;1.诱导pColdⅡ;2.未诱导pColdⅡ-PDCoV M;3.诱导pColdⅡ-PDCoV M;4.诱导pColdⅡ-PDCoV M上清;5.诱导pCold II-PDCoV M沉淀
1.2 引物的设计与合成根据PDCoV流行株CH/XJYN/2016的M基因组序列,利用Snap Gene软件设计M特异性引物M-F:ATGGATCCGACAGCATTCGCTTGCTTATTAAG(5′→3′);M-R:ATAAGCTTCATGTACTTGTAGAGACGG-GCATC(5′→3′);引入限制性酶切位点分别为BamH Ⅰ和Hind Ⅲ(引物处下划线序列),引物由上海生工生物工程股份有限公司合成。

A.SDS-PAGE鉴定目的蛋白纯化;M.蛋白分子质量标准;1~2.纯化后的PDCoV M蛋白;B.重组蛋白PDCoV M表达鉴定;3~4.目的蛋白鉴定;5.pColdⅡ空载体表达鉴定
1.3 载体的构建以提取PDCoVCH/XJYN/2016株RNA为模板经反转录获得cDNA,以cDNA为模板,利用设计的特异性引物RT-PCR扩增获得PDCoV M基因。将载体pColdⅡ和目的片段PDCoV M同时用BamHⅠ和HindⅢ 进行双酶切,双酶切合适的回收产物与T4DNA连接酶16℃过夜连接,连接产物转化至E.coliBL21(DE3)感受态细胞。经过涂板挑取阳性质粒,构建了重组质粒pColdⅡ-PDCoV M,并对其进行第2次双酶切,然后测序鉴定并保存于超低温冰箱。
1.4 目的蛋白的鉴定和纯化将测序准确的M重组质粒转化至E.coliBL21(DE3)感受态细胞中,挑取阳性菌株经扩大培养后,诱导时间参照pColdⅡ说明书,采用IPTG 16℃ 摇床低温诱导表达24 h,8 000 r/min离心20 min,收取菌体沉淀,加入Tris-NaCl重悬菌体洗涤,放置于冰水混合物上进行超声破碎。取其上清和沉淀(保存于4℃冰箱)制样,进行SDS-PAGE电泳,确定其表达形式后大量诱导表达,利用Ni-NTA亲和层析柱法纯化带His标签重组M蛋白。
1.5 BALB/c小鼠免疫及血清效价检测用M蛋白与弗氏完全佐剂1∶1混合并充分乳化,对6~8周龄的雌性BALB/c小鼠(20 μg只)进行免疫,采用皮下多点注射(或大腿肌肉注射),用弗氏不完全佐剂,按照同样方法进行二免(20 μg/只)和三免(每只20 μg),免疫间隔为2周,二免之后14 d采血,小鼠血清稀释1∶12 800,D450 nm值为1.0时即满足融合要求,血清抗体效价不满足的小鼠继续三免。检测小鼠血清抗体效价用间接ELISA方法。步骤如下:用纯化后的M蛋白(1 mg/L)包被酶标板,4℃过夜,5%脱脂奶粉37℃封闭2 h;小鼠血清为一抗,以1∶500倍比稀释,PBS免疫的BALB/c小鼠血清作为对照,37℃孵育40 min;羊抗鼠IgG-HRP为二抗以1∶10 000稀释每孔加入100 μL,37℃孵育30 min;每孔加入50 μL加入TMB显色液显色,37℃孵育10 min;利用每孔加入50 μL终止液(2 mol/L H2SO4)终止反应,用酶标仪读取D450 nm值。
1.6 细胞融合及杂交瘤细胞的筛选挑选2只高效价的小鼠进行腹腔注射M(每只40 μg)蛋白进行加强免疫,3 d后进行融合,融合前1 d制备饲养层。12~24 h内融合,融合提前预热PEG、DMEM和无菌的去离子水,用预热50%的PEG进行融合,骨髓瘤细胞(SP2/0)与小鼠脾细胞按1∶4混合。放置于37℃、5%CO2的培养箱进行培养,融合后3 d观察细胞集落,并补加含有20%FBS的HAT培养基每隔3~5 d 换液1次(也可用含有20%FBS的HT培养基),补加液体时一定要轻柔,防止集落细胞被打散。每天观察待杂交瘤细胞聚团长至单孔面积的30%~50%时,取其细胞培养上清,用间接ELISA方法检测其在D450 nm值较高的阳性杂交瘤细胞株,应用有限稀释法对其多次亚克隆,获得100%的阳性杂交瘤细胞株。
1.7 腹水的制备及效价测定首先将弗氏不完全佐剂对BALB/c雌鼠进行腹腔注射(0.3 mL/只),3 d后腹腔注射阳性杂交瘤细胞株,在7 d后观察小鼠产生腹水状态,随时准备收集腹水。用正辛酸-饱和硫酸铵法对获取的腹水进行纯化,经SDS-PAGE电泳分析,并测定浓度,通过间接ELISA方法测定纯化后抗体的效价(mAb稀释度从1∶200进行倍比稀释)。
1.8 PDCoV M蛋白单克隆抗体的鉴定
1.8.1Western blot鉴定 将感染PDCoV的PK细胞,分别在0,6,12,24,36 h观察病变,出现病变后收集细胞样品,同时设立未接毒细胞对照组。制样后将样品进行SDS-PAGE电泳,转膜,之后经过5%脱脂奶粉封闭1 h,以制备稀释的单克隆抗体4℃过夜,HRP标记的山羊抗鼠IgG室温作用1 h,最后按照碧云天超敏ECL化学发光试剂盒说明书进行曝光。
1.8.2间接ELISA鉴定 分别将PDCoV N蛋白和PDCoV M蛋白稀释至1 mg/L进行包被,操作方法见1.5,最后用酶标仪读取D450 nm值进行分析。
1.8.3IFA鉴定 将PK细胞铺于12孔板中,待细胞长满每孔的80%左右,用PDCoV感染PK细胞,鉴定制备PDCoV M蛋白单克隆抗体的特异性。根据计算接毒量,在接毒后观察细胞病变情况,约24 h每孔加入1 mL 4%多聚甲醛,放置于4℃冰箱,固定60 min或过夜固定;每孔加入500 μL 0.25%Triton-100,室温条件下通透10 min,每孔加入1 mL PBS洗涤3次,每次3 min并在微量振荡器上混匀,每孔加入500 μL 5%BSA封闭60 min并洗涤;每孔加入500 μL用3%BSA以1∶10稀释的杂交瘤细胞株上清,4℃孵育过夜,在避光条件下,每孔加入500 μL以1∶2 000稀释的488标记的山羊抗鼠,37℃孵育60 min;避光条件下每孔加入1滴DAPI,室温静置5 min,每孔加入1 mL PBS洗涤3次后,再每孔加入500 μL PBS,放入4℃冰箱,在倒置荧光显微镜下观察结果。
2 结果
2.1 目的基因扩增与重组质粒的鉴定电泳结果显示PCR扩增产物大小约393 bp,与预期大小相符(图1A)。用BamHⅠ和HindⅢ 对扩增产物与pColdⅡ载体进行双酶切。酶切鉴定确认载体片段与目的片段(图1B)均与预期片段大小一致,通过测序证实无误,说明原核表达载体pColdⅡ-PDCoV M构建成功。
2.2 目的蛋白的诱导表达与可溶性分析将原核表达质粒pColdⅡ-PDCoV M转化至BL21(DE3),加入IPTG,15℃ 220 r/min的条件下诱导表达24 h,诱导时间参照pColdⅡ说明书,并对空载体诱导表达24 h,超声破碎后,用8 mol/L的尿素溶解,经SDS-PAGE电泳分析,与预期大小相符,且重组蛋白在包涵体中表达(图2)。
2.3 重组蛋白pColdⅡ-PDCoV M的纯化经SDS-PAGE结果显示,包涵体M蛋白用Ni亲和层析注法纯化,纯化后的纯度可达90%,经透析用BCA法测定其质量浓度为1.63 g/L,并作Western blot验证(图3)。
2.4 间接ELISA测定免疫小鼠血清抗体效价采用间接ELISA方法检测免疫小鼠血清抗体效价,结果如图4所示,免疫小鼠体内血清抗体效价(D450 nm值)均比较高,对照小鼠血清抗体效价(D450 nm值)较低。在免疫的8只小鼠中,除2号不满足实验要求,其余小鼠抗体效价均达约为1∶32 000,可作为细胞融合的脾细胞供体。

图4 三免后小鼠血清效价
2.5 杂交瘤细胞的筛选及腹水效价测定本研究进行阳性杂交瘤细胞株的亚克隆,采用有限稀释法,之后筛选出4株阳性杂交瘤细胞株。分别命名为4A6、4G3、5F3和5G8,选取5F3株杂交瘤细胞进行腹水制备,采用正辛酸-饱和硫酸铵法对获得腹水进行纯化,纯化后的腹水经透析,SDS-PAGE电泳分析,抗体重链和轻链与预期一致。对纯化后的mAb进行倍比稀释,测定纯化后抗体的效价达204 800(图5),质量浓度为2.12 g/L。

A.杂交瘤细胞上清与PDCoV M蛋白反应;B.杂交瘤细胞上清与PDCoV全病毒反应
2.6 PDCoV M蛋白单克隆抗体与病毒反应的鉴定
2.6.1Western blot鉴定 经Western blot(对PDCoV M蛋白进行稀释)分析结果表明4株单克隆抗体均能检测到抗M蛋白的特异性条带,大小与预期相符,而对照组未出现类似大小条带(图6 )。
2.6.2PDCoV M蛋白单克隆抗体特异性鉴定 分别将PDCoV N蛋白和PDCoV M蛋白稀释至1 mg/L包被酶标板,以稀释的mAb作为一抗进行间接ELISA,结果如图7所示,mAb与PDCoV M蛋白发生反应,具有较高的D450 nm值;与PDCoV N蛋白不反应,D450 nm值较低,说明mAb具有良好的特异性。
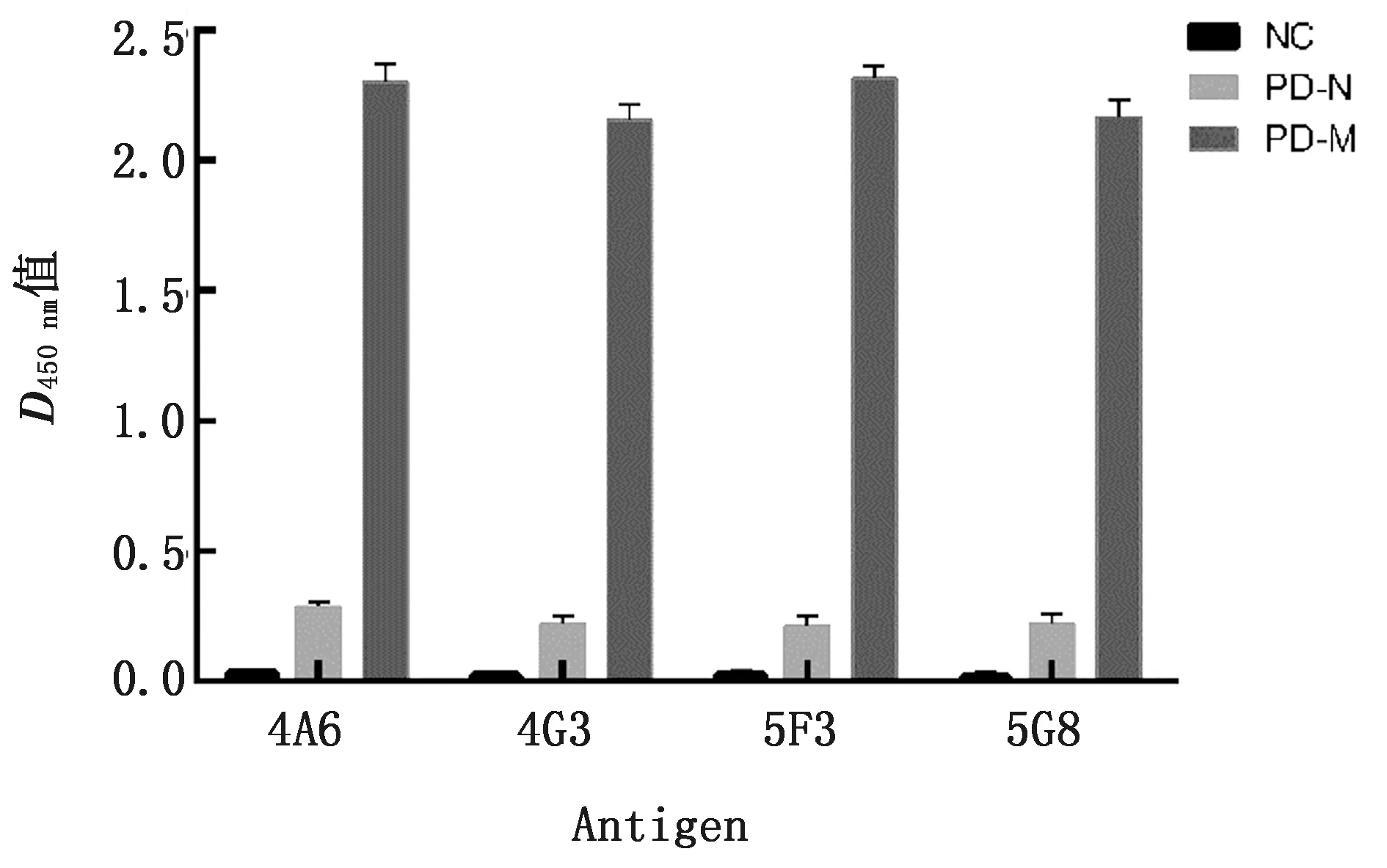
图7 间接ELISA鉴定mAb的特异性
2.6.3mAb的亚类鉴定 按照SBA Clonotyping System-HRP试剂盒说明书对4株单克隆抗体进行亚型鉴定,鉴定出4株单克隆抗体均为IgG亚类,单克隆抗体为IgG2a型,单克隆抗体轻链类型均为κ(表 1)。

表1 PDCoV M 蛋白单克隆抗体亚类鉴定
2.6.4IFA鉴定 将PDCoV感染LLC-PK细胞,用杂交瘤细胞株的上清作为一抗,进行mAb的免疫荧光分析。结果显示,4A6、4G3、5F3和5G8均可观察到特异性绿色荧光,同时阳性对照(PDCoV N mAb为一抗)中,可明显看到特异性绿色荧光,而阴性对照(SP2/0上清为一抗)中没有绿色荧光(图8),表明本研究所制备的4株单克隆抗体均可与PDCoV发生特异性反应。
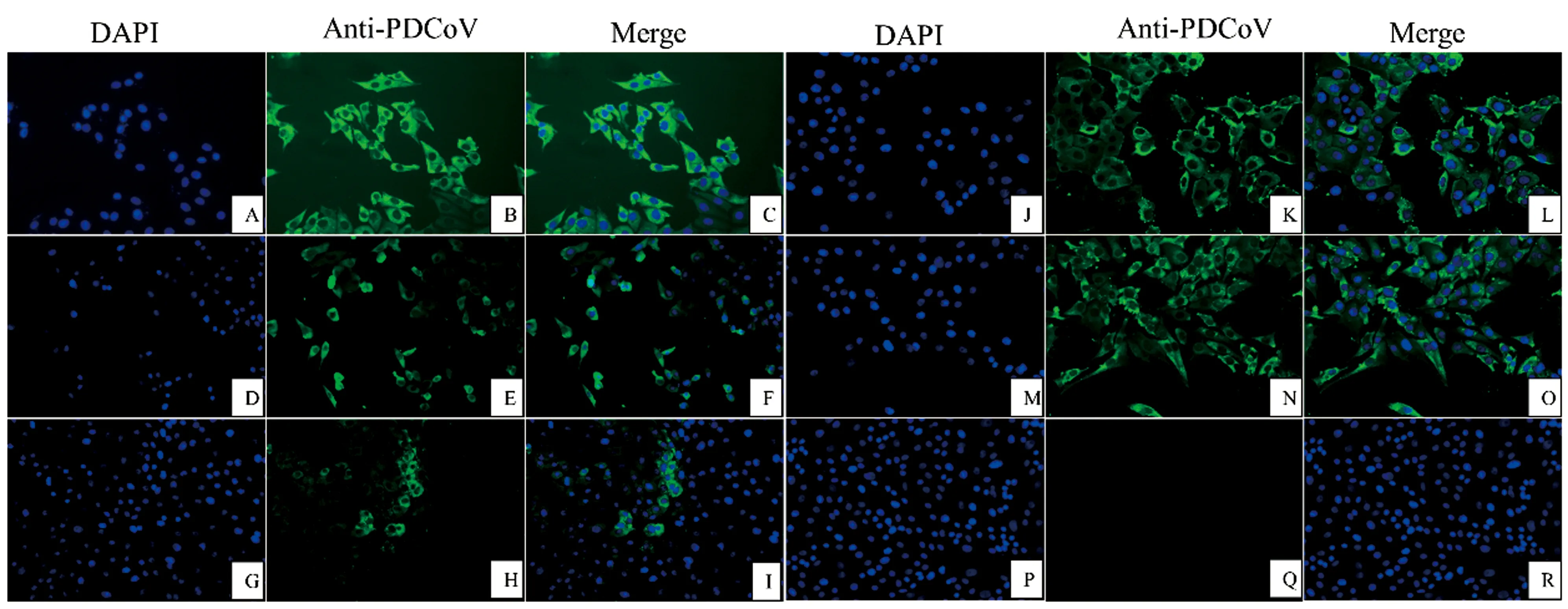
A~C.PDCoV N mAb作为阳性对照与PDCoV感染的PK细胞进行特异性反应;D~F.PDCoV M 4A6 mAb与PDCoV感染的PK细胞进行特异性反应;G~I.PDCoV M 4G3 mAb与PDCoV感染的PK细胞进行特异性反应;J~L.PDCoV M 5F3 mAb与PDCoV感染的PK细胞进行特异性反应;M~O.PDCoV M 5G8 mAb与PDCoV感染的PK细胞进行特异性反应;P~R.SP2/0上清作为阴性对照与PDCoV感染的PK细胞进行特异性反应
3 讨论
PDCoV作为近年来出现的一种新型冠状病毒,自2014年在美国猪场首次暴发后[5],随后在全球多个国家检测到PDCoV的存在,目前已形成全球流行的趋势,严重影响了养猪业的发展。在临床症状上面PDCoV与多种病毒(如猪流行性腹泻病毒)表现十分相似,很难判别,在技术手段上借助实验室诊断技术完成,而且临床上多种病毒混合感染,给疾病综合防控带来很大的挑战。即使近年来PDCoV各方面研究进一步发展,但是对该病毒具有广泛宿主谱的机制尚不清楚。而且2021年的研究发现PDCoV跨种传播给人,给人类健康带来威胁。因此,快速构建PDCoV的诊断检测方法,观测猪群和人群中PDCoV受感染的情况具有十分重要的意义。
PDCoV M蛋白在刺激机体产生免疫应答中有着重要的作用。然而,在国内单克隆方面的研究较少,目前,在针对M蛋白的特征,大量制备PDCoV M和针对M蛋白的抗体,为病毒的诊断奠定基础。例如,史继亚[30]制备的PDCoV M蛋白的单克隆抗体,用于间接免疫荧光法,逄凤娇等[31]和苑建军等[32]针对PDCoV M基因建立了RT-PCR检测方法,郑兰兰等[33]和江珊等[34]用TaqMan荧光定量RT-PCR方法,可用于临床PDCoV的检测和流行病学的调查,魏姗等[35]最早构建重组M蛋白能与PDCoV阳性血清发生反应,冯宇等[36]、宋代丽等[37]和张艺旋等[38]通过原核表达PDCoV M蛋白,建立了间接ELISA检测方法,对四川不同地区937份临床样品检测,发现四川地区样本PDCoV抗体阳性率平均为32.01%,表明该地区PDCoV广泛流行。总而言之,以PDCoV M基因作为靶标,广泛的研究已经建立了相关的检测方法。尽管如此,现阶段仍然对PDCoV单克隆抗体开发方面的研究较少;因此,研发关于PDCoV相关的单克隆抗体是必不可少的。
因M蛋白是一种跨膜蛋白,对其全长进行表达难度较大,所以本研究选择将M蛋白跨膜区去除,只表达暴露于病毒囊膜外的区域。
本研究利用PDCoVCH/XJYN/2016株M蛋白进行截短表达,通过大肠杆菌原核表达系统,表达及纯化后的M为免疫原,利用杂交瘤技术,获得4株能与PDCoV感染细胞产生特异性反应的单克隆抗体,ELISA结果发现4株单克隆抗体分泌抗体能力几乎相同。IFA显示4株mAb均能识别PDCoV,与Western blot结果是相符的,由此看来,本研究成功在体外原核表达了重组PDCoV M蛋白并制备了针对PDCoV M的单克隆抗体,为后续建立PDCoV临床检测方法及相关基础研究提供了良好的实验材料。

