枸杞多糖通过TLR4/Src通路促进巨噬细胞吞噬金黄色葡萄球菌
张 悦,姜孟伶,曹金丹,彭忠禄,刘科峰*,樊竑冶*
枸杞多糖通过TLR4/Src通路促进巨噬细胞吞噬金黄色葡萄球菌
张 悦1,姜孟伶1,曹金丹1,彭忠禄2,刘科峰2*,樊竑冶1*
1. 中国药科大学生命科学与技术学院,江苏 南京 211198 2. 湘南学院,湖南 郴州 423099
探究枸杞多糖(polysaccharide,LBP)对巨噬细胞吞噬金黄色葡萄球菌的影响及其机制。采用CCK-8法检测不同浓度的LBP对巨噬细胞活力的影响;利用Western blotting法检测LBP对巨噬细胞丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子-κB(nuclear factor-κB,NF-κB)及Src激酶家族成员(Src family kinases,SFKs)中的Src蛋白表达水平的影响;运用庆大霉素保护实验和流式细胞术检测LBP对巨噬细胞吞噬的影响,同时使用Toll样受体4(Toll-like receptor 4,TLR4)、MAPK、NF-κB和Src的抑制剂初步判断LBP的作用机制。100~600 μg/mL的LBP对巨噬细胞无毒性,但能有效提高巨噬细胞的活力(<0.01、0.001),并且显著促进巨噬细胞对的吞噬作用。虽然LBP可促进巨噬细胞中MAPK信号通路相关蛋白、NF-κB以及Src的磷酸化水平(<0.01、0.001),但LBP诱导巨噬细胞吞噬能力仅被TLR4抑制剂TAK242和Src激酶家族抑制剂AZD0530显著抑制(<0.001),而不受NF-κB、MAPK抑制剂的影响。LBP能够活化巨噬细胞,并通过TLR4/Src信号通路促进巨噬细胞对的吞噬。
枸杞多糖;巨噬细胞;金黄色葡萄球菌;吞噬功能;TLR4/Src通路
金黄色葡萄球菌是广泛存在于自然界的革兰阳性致病菌,也是社区和医院感染常见的病原菌之一,可引起急性或长期持续性感染,如脓毒症、坏死性肺炎和败血症等[1-2],严重威胁着公众健康。感染在临床上可用多种广谱抗生素治疗,但容易产生耐药性,其中以耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)的感染危害大。MRSA感染已成为世界范围内难以解决的感染性疾病之一[3]。因此,除了寻找新的抗生素外,通过调节宿主天然免疫功能来对抗感染性疾病是值得重视的辅助治疗策略。
宿主导向疗法(host-directed therapy,HDT)通过激活人体自身保护性的免疫反应、抑制过度的炎症反应,从而干预病原体在体内的感染,使机体恢复内环境稳态,以此实现对感染性疾病的辅助治疗[4]。近年来,一些中药化合物被报道具有抗感染的辅助治疗潜力。黄芩苷能够保护小鼠免受MRSA的感染[5]。海胆多糖可激活Toll样受体4(Toll-like receptor 4,TLR4)信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路促进巨噬细胞吞噬细菌,从而减轻细菌感染引起的组织损伤[6]。枸杞多糖(polysaccharides,LBP)是从枸杞子中提取的最主要的活性成分,药性温和无毒,具有抗氧化[7-9]、抗肿瘤[10]、抗衰老、抗糖尿病、抗纤维化、神经保护、免疫调节[11-13]等多种药理活性,具有良好的药物研究和临床应用价值。然而,LBP是否能调节天然免疫来防御细菌感染尚未见报道。本研究首次探索了LBP对小鼠巨噬细胞RAW264.7吞噬的影响及其潜在的机制,为LBP作为免疫调节HDT的候选药物提供理论依据。
1 材料
1.1 细胞株与菌株
RAW264.7细胞购自中国典型培养物保藏中心(CCTCC),菌株(25923)购自ATCC。
1.2 药品与试剂
DMEM培养基(批号8122693)购自美国Sigma公司;胎牛血清(fetal bovine serum,FBS,批号42Q1299k)购自美国Gibco公司;CCK-8试剂盒(批号MA0218)购自大连美仑生物技术有限公司;枸杞多糖(质量分数为51.5%,批号A18GB144984)购自上海源叶生物科技有限公司;pHrodo™ RedBioparticlesTMconjugate for phagocytosis(批号2599191)购自美国Thermo Fisher Scientific公司;细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)抗体(批号F071106)、β-actin抗体(批号F180047)购自Abways Technology公司;p-p65(Ser536)抗体(批号3033T)、p-JNK(Thr183)抗体(批号4668T)、JNK抗体(批号9252T)、p-Src(Ser473)抗体(批号6943T)均购自美国CST公司;p-ERK(Thr202/Tyr204)抗体(批号67b4599)购自美国Affinity Biosciences公司;p-p38抗体(批号I03062031)、p38抗体(批号I109270764)、p65抗体(批号I10211980)、Src抗体(批号I02201570)购自中国沈阳万类生物科技有限公司;HPR标记的羊抗兔IgG二抗(批号SA00001-4)购自美国Proteintech Group公司;TLR4抑制剂TAK242(批号HY-11109)购自美国MedChemExpresss公司;硫酸庆大霉素(批号S403001)、核因子-κB(nuclear factor-κB,NF-κB)抑制剂BAY11-7082(批号S291304)、ERK抑制剂SCH772984(批号S710108)、JNK抑制剂SP600125(批号S146005)、p38抑制剂SB203580(批号S107611)、Src家族激酶抑制剂AZD0530(批号S100615)均购自美国Selleckchem公司;0.1% Triton X-100(批号9002-93-1)购自上海捷倍思基因技术有限公司;增强型ECL化学发光检测试剂盒(批号S7017030)购自翌圣生物科技(上海)股份有限公司。
1.3 仪器
MSC-AdvantageTMII级生物安全柜、Micro CL21R型高速冷冻离心机(美国Thermo Fisher Scientific公司);ECLIPSE Ts2型倒置显微镜(日本Nikon公司);SpectraMax i3x型多功能酶标仪(美国Molecular Devices公司);C25型恒温摇床(美国New Brunswick Scientific公司);GNP-9270型隔水式恒温培养箱(上海精宏实验设备有限公司);BD FACSCalibur流式细胞仪(美国BD公司);Mini-Protein Tetra垂直电泳槽、湿式转印槽(美国Bio-Rad公司);Tanon-5200Multi型全自动化学发光成像仪(上海天能科技有限公司)。
2 方法
2.1 细胞培养
RAW264.7细胞用含10% FBS和1%链霉素-青霉素的DMEM培养基,置于含5% CO2的37 ℃恒温培养箱中培养。根据细胞的生长状态,当细胞融合度为70%~90%达到对数生长期时,进行相关实验或传代。
2.2 CCK-8法检测巨噬细胞活性
取对数生长期的RAW264.7细胞,调整密度为2.5×105个/mL,取100 μL接种至96孔板中,培养过夜。待细胞贴壁后,加入0、100、200、300、400、600 μg/mL的LBP处理细胞,继续培养24 h。弃培养基,每孔加入100 μL含10% CCK-8溶液的培养基,37 ℃培养箱中避光培养1 h,用酶标仪在450 nm处检测吸光度()值。
2.3 庆大霉素保护实验检测巨噬细胞吞噬细菌的数量
RAW264.7细胞以5×104个/孔接种于96孔板,待细胞贴壁后,使用600 μg/mL LBP处理细胞不同时间点。按MOI=50∶1(细菌∶细胞)的比例向细胞中加入,4 ℃、400×离心10 min,置于37 ℃培养箱中共孵育1 h使细胞吞噬细菌。弃上清,用冷的PBS清洗细胞,再加入300 μg/mL庆大霉素,4 ℃孵育30 min杀死胞外菌。弃上清,冷的PBS清洗后用0.1% Triton X-100裂解细胞10~15 min,收集裂解液后梯度稀释并点板培养,12 h后统计菌落数。
2.4 流式细胞术检测吞噬细菌的巨噬细胞比例
RAW264.7细胞以5×104个/孔接种于96孔板,待细胞贴壁后,加入相应刺激。按MOI=50∶1(细菌∶细胞)的比例加入pHrodo-进行感染,并放置于37 ℃培养箱中共孵育1 h。弃上清,用冷的PBS清洗细胞,将细胞重悬于200 μL PBS中,用流式细胞仪进行检测,FlowJo VX软件分析结果。
2.5 Western blotting检测蛋白表达
RAW264.7细胞以8×104个/孔接种于24孔板,待细胞贴壁后,加入相应刺激。弃上清,每孔加入200 μL含1 mmol/L PMSF的RIPA裂解液,冰上裂解10 min提取总蛋白。BCA试剂盒检测蛋白浓度,加入适量蛋白上样缓冲液,涡旋混匀,沸水煮10 min使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,置于5%脱脂牛奶中,摇床振荡封闭 1 h,4 ℃孵育一抗过夜,TBST洗膜5次后室温孵育二抗(1∶10 000)2 h。TBST洗膜5次后,避光用ECL显影,并用全自动化学发光成像仪成像,采用Image J软件分析条带灰度。
2.6 统计学分析
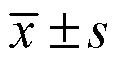
3 结果
3.1 LBP对巨噬细胞活力的影响
为了考察LBP是否影响巨噬细胞的活力,利用CCK-8实验检测不同质量浓度的LBP作用于RAW264.7细胞24 h后的细胞活力。如图1所示,100~600 μg/mL的LBP对细胞无毒性,并显著提高RAW264.7细胞活力(<0.01、0.001)。表明LBP能够有效提高巨噬细胞的活力。
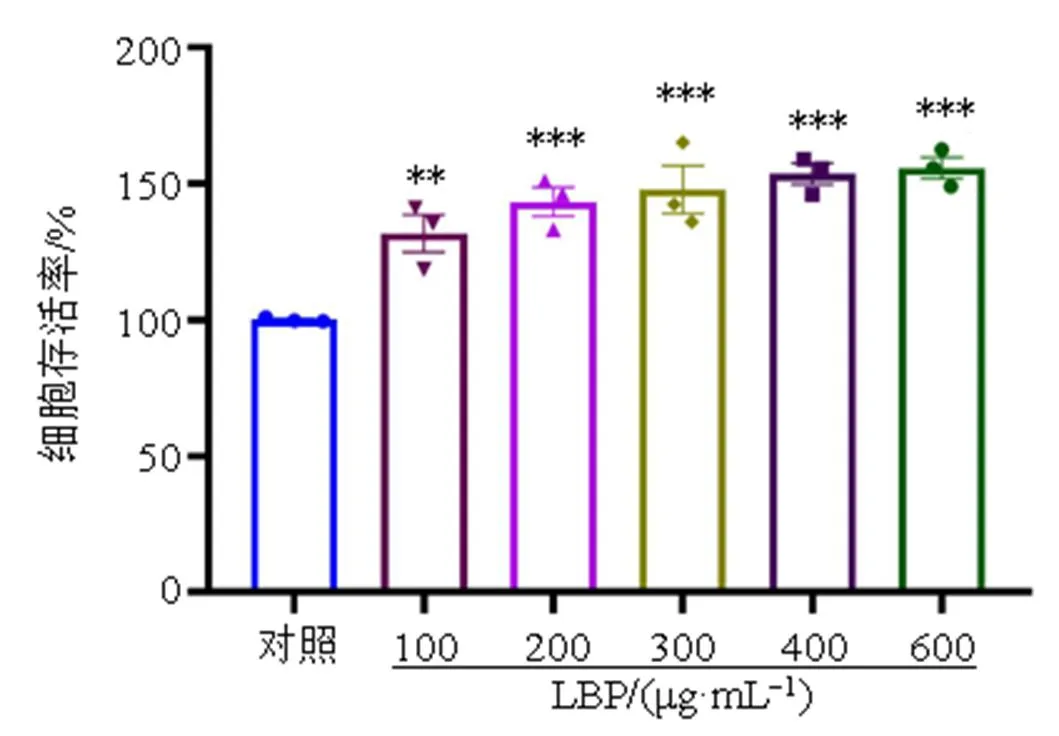
与对照组比较:**P<0.01 ***P<0.001,下图同
3.2 LBP增强巨噬细胞对S. aureus的吞噬作用
为了探究LBP对RAW264.7细胞吞噬的影响,首先采用庆大霉素保护实验检测LBP对RAW264.7细胞吞噬数量的影响。如图2-A所示,600 μg/mL LBP刺激3 h可显著提高RAW264.7细胞对的吞噬数量(<0.001),且该作用持续至24 h。说明LBP处理3 h即可有效促进RAW264.7细胞对的吞噬作用。
pHrodo是一种pH敏感的荧光染料,其荧光强度随环境中pH值的变化而改变。pHrodo-细菌偶联物被巨噬细胞吞噬进入溶酶体后,该染料在溶酶体的酸性环境中荧光强度显著增加。用不同质量浓度(400、600 μg/mL)的LBP处理巨噬细胞24 h后,按MOI=50∶1(细菌∶细胞)的比例加入pHrodo-并与RAW264.7细胞共孵育1 h。流式细胞术检测RAW264.7细胞对pHrodo-的吞噬作用。如图2-B所示,LBP呈剂量相关性地促进巨噬细胞吞噬pHrodo-(<0.001)。以上结果均表明LBP能够显著增强巨噬细胞对的吞噬能力。

A-庆大霉素保护实验检测LBP处理不同时间点对RAW264.7细胞吞噬S. aurues的影响 B-流式细胞术检测不同剂量LBP对RAW264.7细胞吞噬pHrodo-S. aurues的影响
3.3 LBP可通过TLR4信号促进巨噬细胞吞噬S. aureus
TLRs是机体感应病原微生物,并及时做出防御反应的重要模式识别受体[14]。为了探究LBP对RAW264.7细胞吞噬能力的促进作用是否与TLR4信号通路有关,使用TLR4抑制剂TAK242(20 μmol/L)预处理RAW264.7细胞1 h后,再用600 μg/mL LBP处理RAW264.7细胞24 h,采用流式细胞术检测RAW264.7细胞对pHrodo的吞噬作用。如图3所示,TAK242预处理后,LBP对RAW264.7细胞吞噬的促进作用被显著抑制(<0.001)。表明TLR4信号通路参与了LBP诱导的RAW264.7细胞对的吞噬功能。

与LBP组比较:##P<0.01 ###P<0.001,图6、7同
3.4 LBP活化巨噬细胞中NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路
TLR4信号激活后可引起一系列的信号级联反应,包括下游NF-κB和MAPK信号通路。为探究LBP对巨噬细胞中NF-κB和MAPK信号活化的影响,采用600 μg/mL的LBP处理RAW264.7细胞,Western blotting实验检测LBP对TLR4下游信号的活化作用。如图4所示,LBP刺激1 h后即可显著促进p65、JNK、ERK和p38的磷酸化蛋白表达水平(<0.01、0.001)。说明LBP能够激活巨噬细胞中的NF-κB和MAPK信号通路。
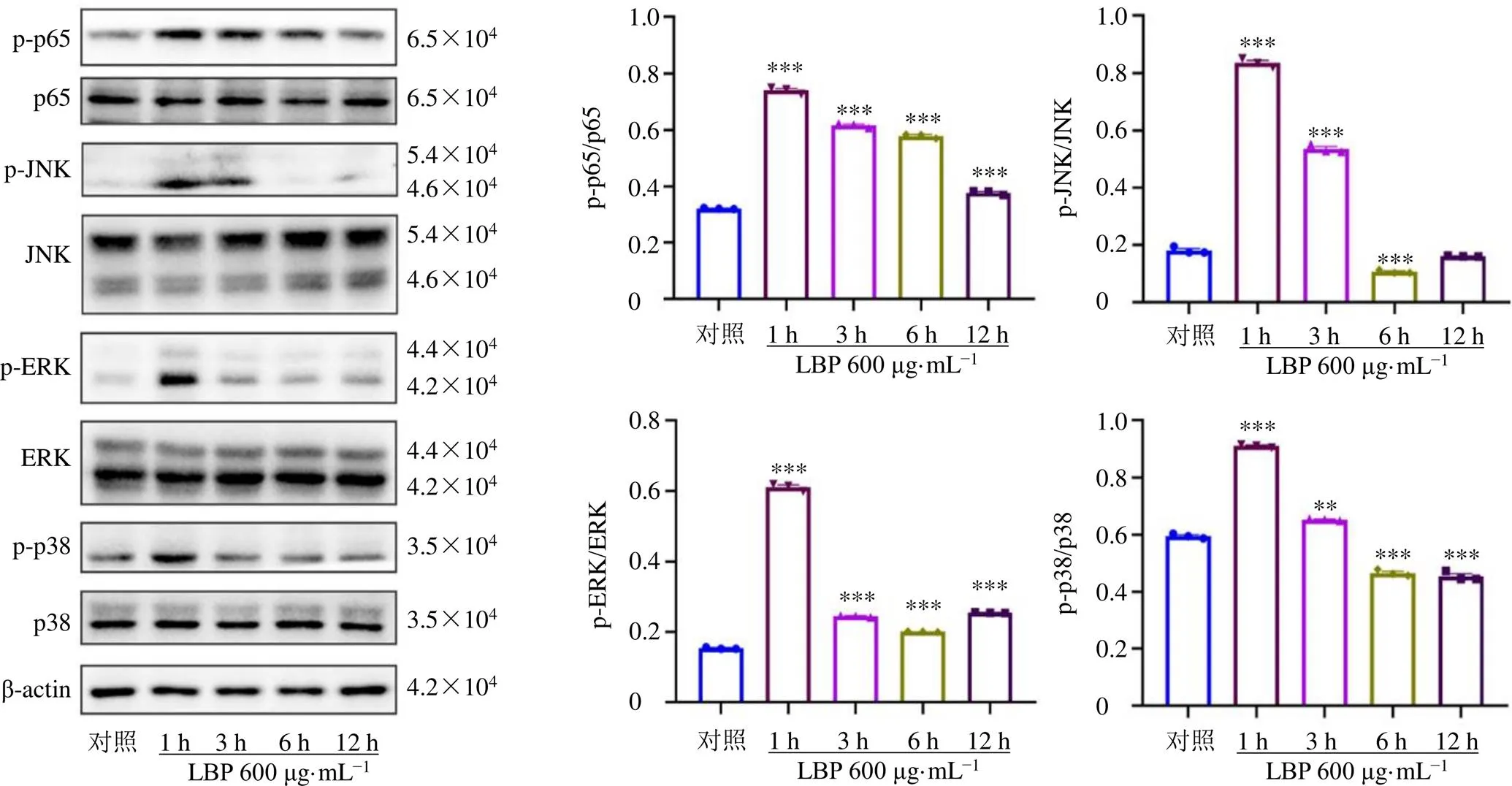
图4 LBP对巨噬细胞NF-κB/MAPK信号通路相关蛋白表达的影响(, n = 3)
3.5 LBP促进巨噬细胞的吞噬作用与NF-κB和MAPK无关
为了考察LBP对巨噬细胞吞噬的促进作用是否与其激活TLR4下游NF-κB和MAPK信号通路有关,采用NF-κB抑制剂BAY11-7082(2 μmol/L)、ERK抑制剂SCH772984(0.5 μmol/L)、JNK抑制剂SP600125(5 μmol/L)和p38抑制剂SB203580(2 μmol/L)预处理RAW264.7细胞1 h,再使用600 μg/mL LBP刺激细胞12 h。流式结果显示,抑制NF-κB、ERK、JNK和p38信号均不影响LBP诱导的RAW264.7细胞对pHrodo的吞噬作用(图5)。以上结果说明LBP对巨噬细胞吞噬的促进作用不受NF-κB和MAPK信号的调控。
3.6 LBP通过TLR4活化Src信号
Src家族激酶通过磷酸化细胞质中受体结构域的ITAM序列中的酪氨酸,促进免疫识别受体聚集并启动巨噬细胞骨架重塑[15],导致细胞膜内陷,形成吞噬体进入细胞。为探究LBP是否能够活化Src信号,使用600 μg/mL LBP处理细胞,Western blotting实验检测LBP对Src信号的活化作用。如图6-A所示,LBP可显著增加Src的磷酸化水平(<0.001)。而TLR4抑制剂TAK-242预处理1 h,显著抑制了LBP诱导的Src的活化(<0.01,图6-B)。说明LBP能够通过TLR4活化Src信号通路。
3.7 LBP通过TLR4/Src促进巨噬细胞对S. aureus的吞噬作用
为探究LBP对巨噬细胞吞噬的促进作用是否与其激活Src信号通路有关,使用600 μg/mL LBP预处理RAW264.7细胞12 h,再用Src家族激酶抑制剂AZD0530(15 μmol/L)处理细胞2 h。流式细胞术检测RAW264.7细胞对pHrodo-的吞噬能力。结果显示,阻断Src家族激酶显著抑制RAW264.7细胞对的吞噬能力(<0.001,图7)。综合以上实验结果说明,LBP通过TLR4/Src信号促进巨噬细胞对的吞噬。

图5 NF-κB、MAPK信号对LBP诱导的巨噬细胞吞噬的影响(, n = 3)

A-LBP对Src信号的活化作用 B-给予TLR4抑制剂TAK-242预处理后,LBP对Src信号通路相关蛋白表达的影响

图7 Src信号对LBP诱导的巨噬细胞吞噬的影响(, n = 3)
4 讨论
HDT作为一种新型抗病原体感染的治疗策略,受到越来越多的关注。在治疗金葡菌感染性炎症过程中,大量天然提取物通过辅助治疗显示了其潜在药用价值,如穿心莲内酯[16]、黄芩苷[5]等。本研究发现,LBP不仅可以活化巨噬细胞,还能增强巨噬细胞对的吞噬能力,其机制可能主要涉及LBP对TLR4/Src信号通路的激活作用。这些结果也表明LBP在增强宿主天然免疫、抵御细菌感染方面的潜力,并为其成为辅助治疗细菌感染的HDT策略的候选药物提供依据。
巨噬细胞的吞噬作用包括识别配体、黏附、肌动蛋白聚合、吞噬杯的形成、摄取和降解等过程[17]。TLR4是一类天然免疫模式识别受体,广泛存在于单核细胞、树突状细胞和巨噬细胞表面[18]。TLR4信号传导在对微生物感染的先天免疫反应中起关键作用[19]。细菌感染或LPS刺激触发Piezo1和TLR4形成复合物,促进肌动蛋白重塑,增强巨噬细胞的吞噬功能[20]。本研究发现,TLR4抑制剂可以显著抑制LBP诱导的巨噬细胞的吞噬能力,表明TLR4信号参与了LBP诱导的巨噬细胞对的吞噬。
TLR4下游NF-κB和MAPK信号是调节炎症和免疫的关键因子。据报道,抑制NF-κB和MAPK信号可显著减少细胞因子的释放,降低巨噬细胞对肠球菌的吞噬和清除能力[21]。本研究发现,抑制NF-κB和MAPK均不影响LBP诱导的巨噬细胞的吞噬功能,而使用Src家族激酶抑制剂AZD0530能够有效抑制LBP诱导的巨噬细胞的吞噬能力。Src家族激酶在巨噬细胞骨架重排、吞噬体形成的过程中发挥重要作用[22]。这些结果表明TLR4/Src通路介导了LBP对巨噬细胞吞噬功能的促进作用。
综上,LBP可以活化巨噬细胞,并促进巨噬细胞对的吞噬作用,且这种促进作用可能部分通过TLR4/Src信号介导的,关于LBP促进巨噬细胞吞噬的更深入机制还需要进一步探索。本研究初步探究了LBP通过提高天然免疫的活化从而增强抗感染能力,并在一定程度上阐明了LBP促进巨噬细胞吞噬的相关机制为其成为HDT相关药物的开发提供了理论和实验依据。然而,本研究仅进行了体外实验,并未在体内探究LBP的抗细菌感染作用。下一步将建立动物实验模型,进一步确认LBP在增强宿主天然免疫、抵御细菌感染方面的作用,这将对HDT药物的开发具有积极意义。
利益冲突 所有作者均声明不存在利益冲突
[1] Hou H J, Li Y, Jin Y F,. The crafty opponent: The defense systems ofand response measures [J]., 2022, 67(2): 233-243.
[2] Rowe S E, Wagner N J, Li L P,. Reactive oxygen species induce antibiotic tolerance during systemicinfection [J]., 2020, 5(2): 282-290.
[3] Lee A S, de Lencastre H, Garau J,. Methicillin-resistant[J]., 2018, 4: 18033.
[4] Nisini R, Oggioni M R, Rossolini G M,. Editorial: Exploiting novel combined host- and pathogen-directed therapies for combating bacterial multidrug resistance [J]., 2020, 11: 616486.
[5] Shi T, Li T T, Jiang X R,. Baicalin protects mice from infection with methicillin-resistantvia alleviating inflammatory response [J]., 2020, 108(6): 1829-1839.
[6] Tian X L, Guo M, Zhang X Y,.eggs polysaccharide enhances macrophage phagocytosis against.infection by TLR4/STAT3 axis [J]., 2022, 13: 807440.
[7] He N W, Yang X B, Jiao Y D,. Characterisation of antioxidant and antiproliferative acidic polysaccharides from Chinese wolfberry fruits [J]., 2012, 133(3): 978-989.
[8] Xiao J, Liong E C, Ching Y P,.polysaccharides protect mice liver from carbon tetrachloride-induced oxidative stress and necroinflammation [J]., 2012, 139(2): 462-470.
[9] 邓清月, 吕芳, 董英, 等. 枸杞多糖中医药研究概况:文献计量学分析[J]. 中草药, 2023, 54(9): 2852-2862.
[10] Zhang M, Chen H X, Huang J,. Effect ofpolysaccharide on human hepatoma QGY7703 cells: Inhibition of proliferation and induction of apoptosis [J]., 2005, 76(18): 2115-2124.
[11] Bo R N, Zheng S S, Xing J,. The immunological activity ofpolysaccharides liposomeand adjuvanticity against PCV2[J]., 2016, 85: 294-301.
[12] Xiao Z Y, Deng Q, Zhou W X,. Immune activities of polysaccharides isolated fromL. What do we know so far? [J]., 2022, 229: 107921.
[13] Du M Z, Hu X Y, Kou L,.polysaccharide mediated the antidiabetic and antinephritic effects in diet-streptozotocin-induced diabetic Sprague Dawley rats via regulation of NF-κB [J]., 2016, 2016: 3140290.
[14] Duan T H, Du Y, Xing C S,. Toll-like receptor signaling and its role in cell-mediated immunity [J]., 2022, 13: 812774.
[15] Fitzer-Attas C J, Lowry M, Crowley M T,. Fcgamma receptor-mediated phagocytosis in macrophages lacking the Src family tyrosine kinases Hck, Fgr, and Lyn [J]., 2000, 191(4): 669-682.
[16] Zhang L L, Wen B, Bao M,. Andrographolide sulfonate is a promising treatment to combat methicillin-resistantand its biofilms [J]., 2021, 12: 720685.
[17] Weiss G, Schaible U E. Macrophage defense mechanisms against intracellular bacteria [J]., 2015, 264(1): 182-203.
[18] Ciesielska A, Matyjek M, Kwiatkowska K. TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling [J]., 2021, 78(4): 1233-1261.
[19] Li D Y, Wu M H. Pattern recognition receptors in health and diseases [J]., 2021, 6(1): 291.
[20] Geng J, Shi Y R, Zhang J J,. TLR4 signalling via Piezo1 engages and enhances the macrophage mediated host response during bacterial infection [J]., 2021, 12(1): 3519.
[21] Zou J, Shankar N. Roles of TLR/MyD88/MAPK/NF-κB signaling pathways in the regulation of phagocytosis and proinflammatory cytokine expression in response to E. faecalis infection [J]., 2015, 10(8): e0136947.
[22] Berton G, Mócsai A, Lowell C A. Src and Syk kinases: Key regulators of phagocytic cell activation [J]., 2005, 26(4): 208-214.
polysaccharide promotes macrophage phagocytosis ofthrough TLR4/Src pathway
ZHANG Yue1, JIANG Meng-ling1, CHAO Jin-dan1, PENG Zhong-lu2, LIU Ke-feng2, FAN Hong-ye1
1. School of Life Science and Technology, China Pharmaceutical University, Nanjing 211198, China 2. Xiangnan University, Chenzhou 423099, China
To explore the effect and mechanism ofpolysaccharide (LBP) on phagocytosis ofby macrophages.CCK-8 was used to detect the effect of different concentrations of LBP on macrophage viability. The effect of LBP on the protein expressions of mitogen-activated protein kinase (MAPK), nuclear factor-κB (NF-κB) and Src in members of Src kinase family were detected by Western blotting. Effects of LBP on phagocytosis ofby macrophages detected by gentamicin protection test and flow cytometry, and the macrophages were treated with the inhibitors of TLR4, NF-κB, MAPK and Src to preliminary assess the mechanism of LBP.LBP at 100—600 μg/mL had no toxicity to macrophages, but effectively improved the vitality of macrophages (< 0.01, 0.001), and significantly promoted the phagocytosis of macrophages on. Although LBP could promote phosphorylation levels of MAPK signaling pathway-related proteins, NF-κB and Src in macrophages, the promoting effect of LBP on phagocytic ability of macrophages towas only significantly inhibited by TLR4 inhibitors TAK242 and Src kinase family inhibitors AZD0530, but not by NF-κB and MAPK inhibitors.LBP can activate macrophages and promote phagocytosis ofby macrophages through TLR4/Src signaling pathway.
polysaccharides; macrophages;; phagocytic function; TLR4/Src pathway
R285.5
A
0253 - 2670(2023)22 - 7466 - 08
10.7501/j.issn.0253-2670.2023.22.023
2023-08-04
湖南省“十四五”药学应用特色学科项目(湘教通[2022]351号);生物医药微生物组学研究湖南省高校重点实验室项目(湘教通[2021]241号)
张 悦(1998—),女,硕士研究生,研究方向为微生物与分子免疫。Tel: 18372610967 E-mail: Zhangyue2y@163.com
通信作者:樊竑冶,女,博士,副教授,主要从事细胞与分子免疫研究。E-mail: changqingshu2004@126.com
刘科峰,女,博士,副教授,主要从事心血管疾病与免疫研究。E-mail: 2874605238@qq.com
[责任编辑 李亚楠]