基于UHPLC-Q-Exactive Orbitrap MS鉴定参芪降糖胶囊在大鼠体内的代谢产物
苑楠楠,王宏进,孙 琪,赵 蕾,白桦芳,孙立新
基于UHPLC-Q-Exactive Orbitrap MS鉴定参芪降糖胶囊在大鼠体内的代谢产物
苑楠楠,王宏进,孙 琪,赵 蕾,白桦芳,孙立新*
沈阳药科大学药学院,辽宁 本溪 117004
研究参芪降糖胶囊在大鼠血浆、胆汁、尿液和粪便中的代谢产物及其代谢途径。采用UHPLC-Q-Exactive Orbitrap MS技术,以0.1%甲酸溶液(A)-乙腈(B)为流动相进行梯度洗脱,并采用ESI离子源,分别在正、负离子模式进行全扫描和二级质谱扫描,获得化合物的一级和二级质谱数据,结合文献报道、对照品裂解规律及药物代谢反应规律,对大鼠ig参芪降糖胶囊混悬液后的生物样品进行分析鉴定。在大鼠体内共鉴定出125个化合物,包括47个原型成分(PA1~PF)和78个代谢产物(MA1~ME14),其中2个为新代谢产物,分别为MC15(五味子甲素双脱甲基后葡萄糖醛酸化产物)和MD3(去氢茯苓酸的硫酸酯化产物),4个为新化合物,分别为MC14:(6,7)-2,3,10,11-tetramethoxy-6,7-dimethyl- 5,6,7,8-tetrahydrodibenzo[a,c][8]annulene-1,7-diol、MC16:(6,7)-2,3,10-trimethoxy-6,7-dimethyl-5,6,7,8-tetrahydrodibenzo [a,c][8]annulene-1,7,11-triol、MD1:()-2-((3,3a,6,7,9b)-6-(2-carboxyethyl)-3a,6,9b-trimethyl-7-(prop-1-en-2-yl)-3a,4,6,7,8,9b- hexahydro-3-cyclopenta[a]naphthalen-3-yl)-6-methylhept-5-enoic acid和MD4:(3,5,10,13,14,16,17)-4,4,10,13,14,17- hexamethyl-2,3,4,5,6,10,12,13,14,15,16,17-dodecahydro-1-cyclopenta[a]phenanthrene-3,16-diol。参芪降糖胶囊在大鼠体内的代谢途径主要涉及脱羟基、脱甲基、脱水、水解、还原氢化、甲基化、葡萄糖醛酸化、硫酸酯化和多种反应类型的复合反应等。初步阐明了参芪降糖胶囊的体内代谢特征,同时为探索其生物活性成分及作用机制提供参考。
参芪降糖胶囊;超高效液相色谱-四极杆-静电场轨道阱高分辨质谱法;代谢产物;代谢途径;黄芪甲苷;芒柄花素;五味子甲素
糖尿病是一种以血糖水平升高为主要特征的慢性代谢性疾病,主要分为1型和2型糖尿病,其中2型糖尿病患者约占90%以上。在具有降糖疗效的中药制剂中,参芪降糖胶囊(Shenqi Jiangtang Capsules,SJC)由人参茎叶总皂苷、黄芪、地黄、天花粉、麦冬、五味子、枸杞子、覆盆子、山药、茯苓和泽泻11味药味组成,具滋阴、健脾、补肾之功效,临床上单独使用或作为辅助中药制剂联合降糖西药治疗气阴两虚型的2型糖尿病及其并发症且具有一定的降糖疗效[1-3]。目前,对该制剂的研究主要集中于统计和观察临床疗效[4-6]、化学成分分析[7-8]和药动学研究[9]等,而对其在体内代谢的研究尚无报道。中药复方制剂的药效成分可能是原型成分、代谢产物或两者的综合叠加,通过作用于体内的相关靶点发挥疗效。因此,研究药物在体内的代谢,对于揭示其生物活性成分和阐明其药效物质基础具有重要意义[10]。
中药复方制剂由于化学成分复杂、体内代谢途径多样及内源性物质的干扰,代谢产物鉴定困难,需要采用具有高选择性、高分析速度、高分辨率的液质联用技术,提高色谱对复杂组分的分离能力和获得多级质谱信息。其中,超高效液相色谱-四极杆-静电场轨道阱高分辨质谱仪(ultra-high-performance liquid chromatography-quadrupole-electrostatic field orbitaltrap high resolution mass spectrometer, UHPLC- Q-Exactive Orbitrap MS)具高分辨率、检测限度低、质量偏差低和高质量精度的优势,可显著降低样品基质的干扰,已逐渐应用于中药复方制剂的定性分析。
本研究采用UHPLC-Q-Exactive Orbitrap MS技术,对大鼠ig给予SJC混悬液后的血浆、胆汁、尿液和粪便样品中的原型成分及其代谢产物进行分析鉴定,以期为阐明SJC的药效物质基础和解析其在大鼠体内的代谢过程提供参考。
1 仪器与材料
1.1 仪器
Vanquish Flex超高效液相色谱仪、Q-Exactive TM四极杆-静电场轨道阱高分辨质谱仪(美国Thermo公司),配有电喷雾离子源(ESI)、Trace Finder 4.1工作站及TraceFinder 4.1 General Quan数据处理系统;CPA225D型电子分析天平(十万分之一,赛多利斯科学仪器有限公司);TGL-16型高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料
SJC(批号2004263,0.35 g/粒,河南羚锐制药股份有限公司);对照品人参皂苷Rg1(批号G30N10Y104330,质量分数≥98%)、五味子甲素(批号R12O8F45508,质量分数≥98%)、人参皂苷Re(批号B04D9S76499,质量分数≥98%)、黄芪甲苷(批号J25F10T81373,质量分数≥98%)、茯苓酸(批号P07D10S105271,质量分数≥97%)均购自上海源叶生物科技有限公司;甲醇(色谱级)、乙腈(质谱级)、甲酸(质谱级),美国Sigma公司;纯净水(杭州娃哈哈集团有限公司)。
1.3 实验动物
SPF级SD大鼠,雄性,体质量180~220 g,动物生产合格证号SCXK(辽)2020-0001,由沈阳药科大学动物实验中心提供,饲养温度为(22±2)℃,饲养环境相对湿度为50%~60%,光照时间为12 h,自由饮食、饮水,适应性饲养1周后开始实验。动物实验伦理审查编号SYPU-IACUC- S2021-06.18-201。
2 方法
2.1 溶液的配制
2.1.1 对照品溶液的制备 精密称定人参皂苷Rg1、人参皂苷Re、五味子甲素、黄芪甲苷和茯苓酸对照品,分别置于10 mL棕色量瓶中,用80%甲醇溶解并稀释至刻度,摇匀,制成质量浓度分别为104.0、97.0、87.0、98.0和92.0 mg/L的对照品储备液,精密量取以上溶液各0.24 mL,置100 mL棕色量瓶中,用80%甲醇稀释至刻度,摇匀,制成质量浓度分别为0.250、0.233、0.209、0.235、0.221 mg/L的混合对照品溶液,于4 ℃储存,备用。
2.1.2 供试品溶液的制备 称取适量的SJC内容物,研细,精密称定,用0.5%羧甲基纤维素钠溶液(CMC-Na)混悬,配制成质量浓度约为210 g/L的供试品溶液。
2.2 分组与给药
SD大鼠12只,随机分为空白组和给药组(血浆组、胆汁组、尿液/粪便组),每组3只。末次给药大鼠前禁食12 h,自由饮水,给药剂量为4.96 g/(kg·d),每天早、晚2次给药,连续给药3 d。空白组大鼠ig等体积0.5%的CMC-Na溶液。
2.3 生物样品采集
2.3.1 血浆组 分别于给药后0、0.33、0.5、1、3、6、10和24 h自眼眶静脉丛取血,置于预先用肝素钠处理的EP管中,4000 r/min离心10 min,取上清液,即得血浆样品。
2.3.2 胆汁组 将大鼠麻醉后,胆管插管术按时间段0~2、2~4、4~8、8~12、12~24 h收集大鼠给药后24 h内的胆汁样品。
2.3.3 尿液/粪便组 给药后,立即将大鼠置于代谢笼中,分别按时间段0~4、4~8、8~12、12~24、24~48 h和时间段0~6、6~12、12~24、24~48 h收集48 h内的尿液样品和粪便样品。以上样品收集后均于−20 ℃冰箱保存。
2.4 生物样品预处理
2.4.1 血浆样品预处理 分别取给药后8个时间点的血浆各100 μL,共800 μL,置于EP管中,涡旋混匀1 min,加3.2 mL甲醇,涡旋混匀2 min,于4 ℃ 12 000 r/min离心10 min,上清液于室温下氮气吹干,残渣用200 μL 80%甲醇水复溶,4 ℃12 000 r/min离心10 min,离心2次,取上清,进样分析。
2.4.2 胆汁样品预处理 按体积比(各时间段采集生物样品体积占总量的体积比例)取各时间段胆汁样品共1 mL,置于EP管中,涡旋混匀1 min,加2 mL甲醇,涡旋混匀2 min,于4 ℃、12 000 r/min离心10 min,上清液于室温下氮气吹干,胆汁残渣用1 mL 60%甲醇水复溶,于4 ℃ 12 000 r/min离心10 min,离心2次,取上清,即得胆汁样品,进样分析。
2.4.3 尿液和粪便样品预处理 按体积比取各时间段尿液样品共1 mL,置于EP管中,涡旋混匀1 min,加2 mL甲醇,涡旋混匀2 min,于4 ℃、12 000 r/min离心10 min,上清液于室温下氮气吹干,尿液残渣用200 μL 60%甲醇水复溶,于4 ℃、12 000 r/min离心10 min,离心2次,取上清,即得尿液样品。将各时间段给药粪便烘干,研磨混匀,按比例(各时间段称取的生物样品质量占总量的质量比例)称取各时间段粪便共1.0 g,加5 mL 60%甲醇,超声提取30 min,4 ℃、12 000 r/min离心10 min,离心2次,取上清,氮气吹干,残渣用2 mL 60%甲醇水复溶,4 ℃、12 000 r/min离心10 min,离心2次,取上清,进样分析。
2.5 检测条件
2.5.1 色谱条件 色谱柱:采用Waters ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 µm);流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~15.5 min,8%~35% B;15.5~32.5 min,35%~95% B;32.5~32.6 min,95%~8% B;32.6~35.6 min,8% B);体积流量0.2 mL/min;柱温35 ℃,进样量5 µL。
2.5.2 质谱条件 电喷雾离子源(ESI);正负离子模式;数据采集模式:全扫描和自动触发二级质谱扫描(Full MS/dd-MS2);扫描范围为100~1500,一级质谱分辨率70 000,二级质谱分辨率17 500;喷雾电压正负离子模式下分别为3.8、3.0 kV;碰撞能量(CE)为20、35、60 eV;脱溶剂气体温度正负离子模式下分别为310、350 ℃,毛细管温度正负离子模式下分别为320、350 ℃。
2.6 数据处理
采用TraceFinder 4.1 General Quan data processing system和Xcalibur 2.1工作站进行数据采集和处理,代谢物的分子式通过Xcalibur 2.1软件在质量偏差5×10−6内推测。通过查阅SJC化学成分的相关文献,建立包含化合物名称、分子式、精确相对分子质量、一级和二级质谱数据的代谢物数据库以快速筛选和鉴定SJC在大鼠体内的代谢物。
3 结果
采用UHPLC-Q-Exactive Orbitrap MS技术对大鼠ig给予SJC混悬液后的生物样品进行分析。结合对照品、SJC中化学成分的质谱裂解规律和代谢物数据库,共鉴定出125个化合物,包括47个原型成分(PA1~PF)和78个代谢产物(MA1~ME14),并发现了2个新代谢产物和4个新化合物。SJC在大鼠体内代谢产物在正、负离子模式下扣除空白后的总离子流图见图1。代谢物具体信息见表1、2。

a-血浆 b-胆汁 c-尿液 d-粪便
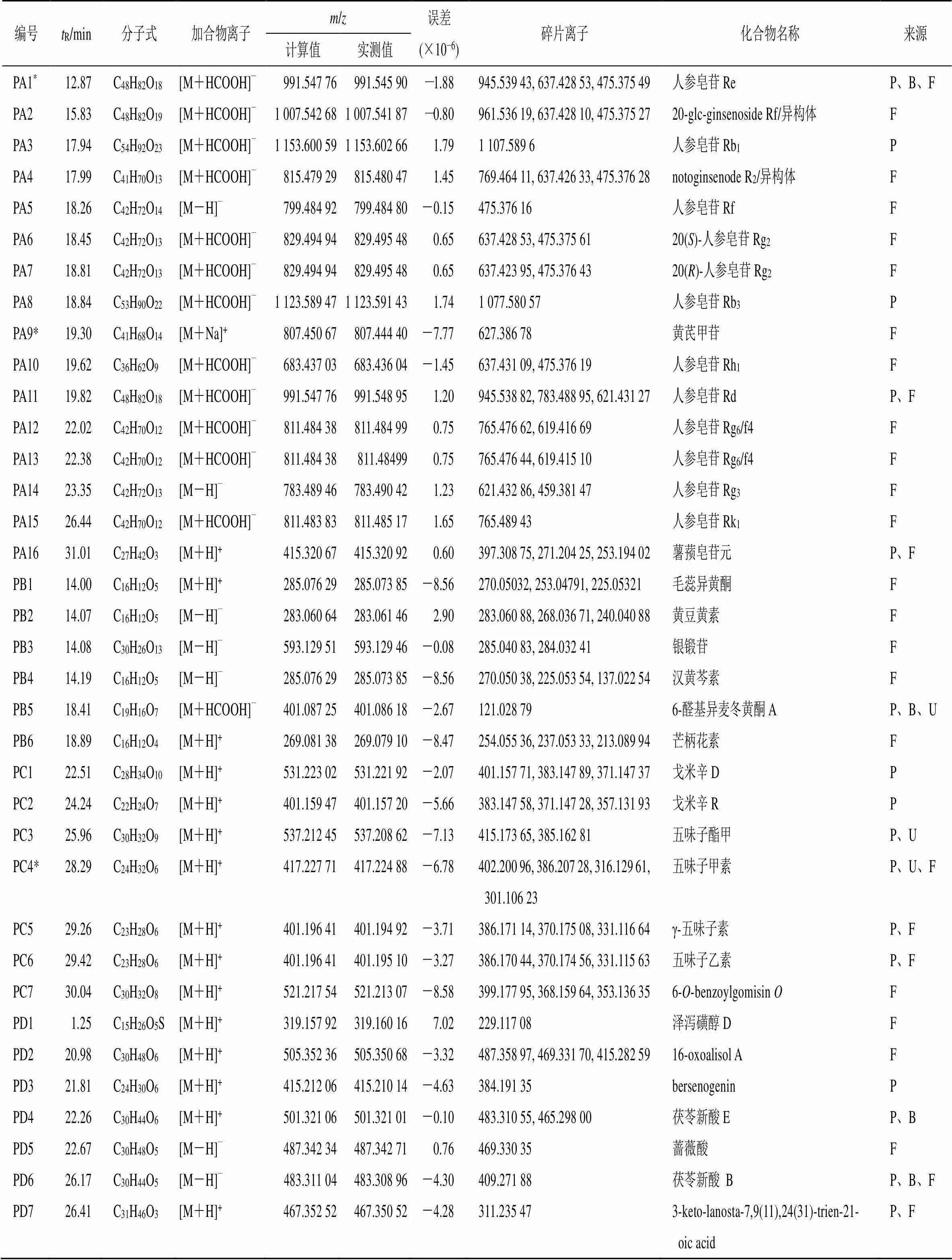
表1 参芪降糖胶囊在大鼠体内的原型成分
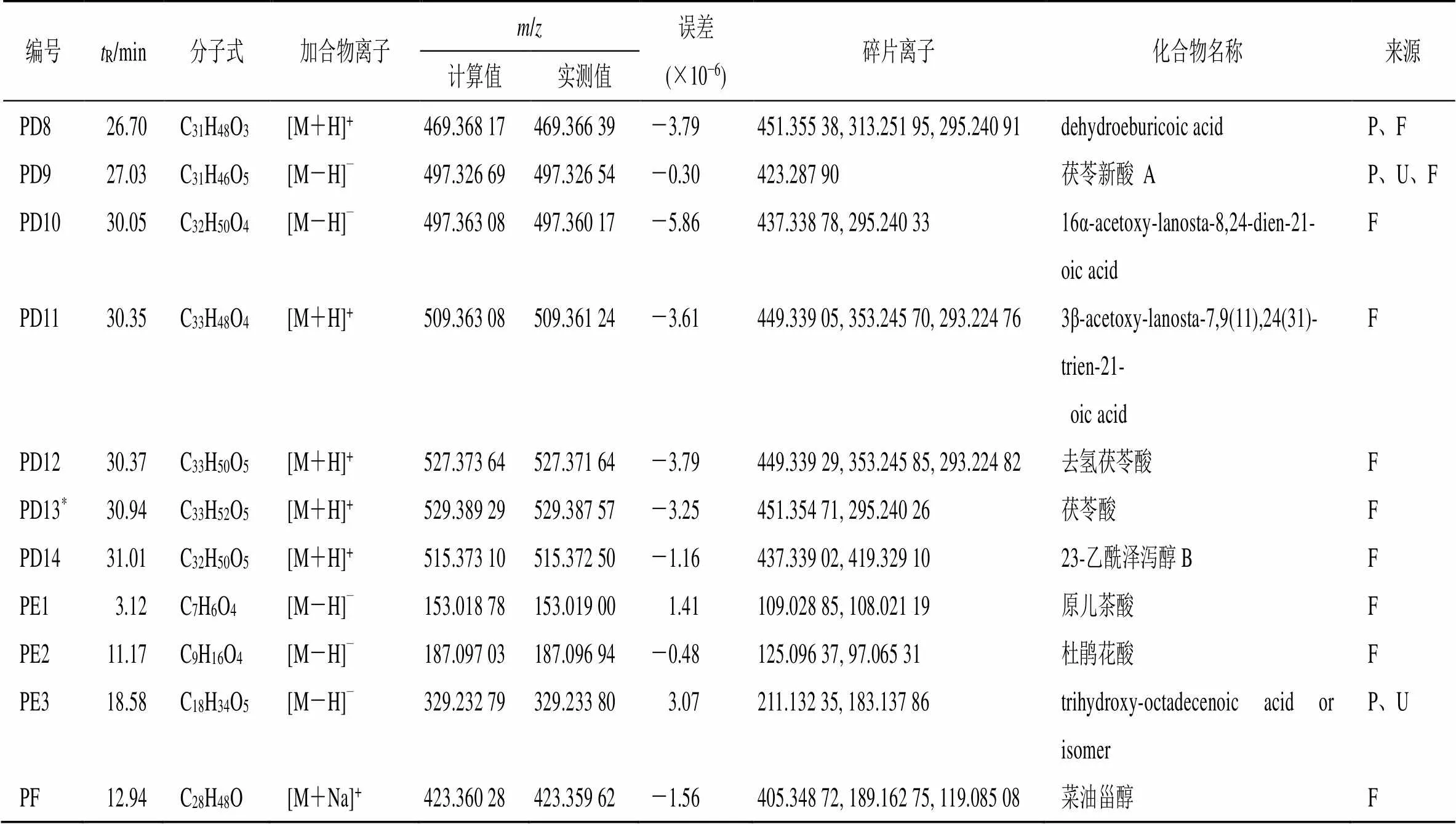
续表1
“*”经与对照品比对;P-血浆 B-胆汁 U-尿液 F-粪便,下表同
“*” Compare with reference substance; P-Plasma; B-Bile; U-Urine; F-Feces, same as table below
3.1 原型成分鉴定
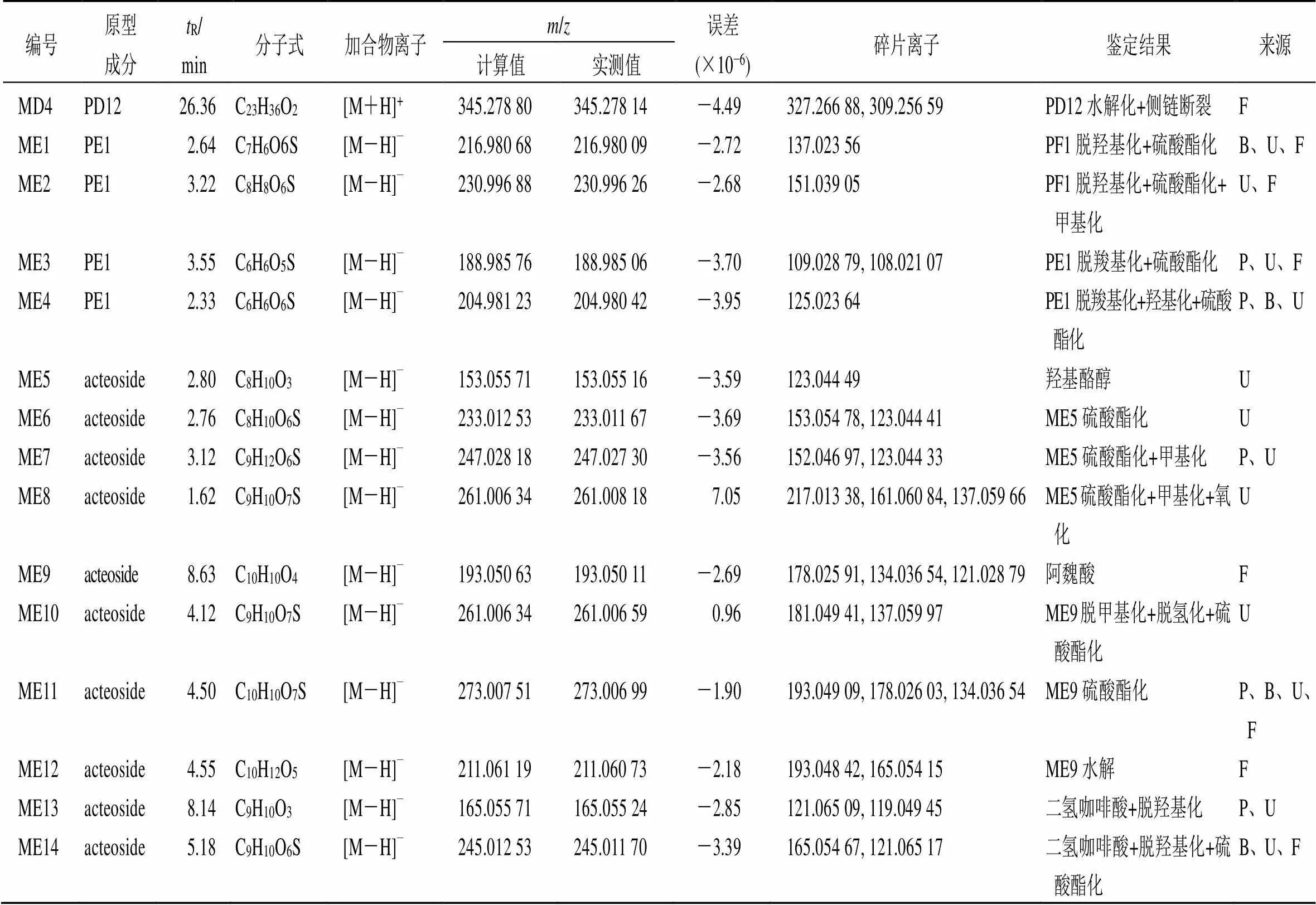
3.1.1 皂苷类成分 化合物PA1~PA16是皂苷类化合物。其中,化合物PA1与文献数据[11]及相应对照品的保留时间和质谱裂解碎片比较,被鉴定为人参皂苷Re;PA9保留时间为19.30 min,准分子离子峰 [M+Na]+/807.444 40,碎片离子为/627.386 78 [M+Na-C6H10O5-H2O]+,经与对照品比对,鉴定为黄芪甲苷,见图2。
3.1.2 黄酮类成分 化合物PB1~PB6是黄酮类化合物。PB6的保留时间为18.89 min,准分子离子峰 [M+H]+/269.079 10,碎片离子/254.055 36 [M+H-CH3]+、237.053 33 [M+H-OH-CH3]+和213.089 94 [M+H-2CO]+与文献报道结果相符[12],推测PB6为芒柄花素。
3.1.3 木脂素类成分 化合物PC1~PC7是木脂素类化合物,PC4保留时间为28.29 min,准分子离子峰 [M+H]+/417.224 88,碎片离子为/402.200 96 [M+H-CH3]+、386.207 28 [M+H-OCH3]+、316.129 61 [M+H-C5H10-OCH3]+和301.106 23 [M+H-C5H10-OCH3-CH3]+,经与对照品比对,鉴定为五味子甲素,见图3。
3.1.4 三萜类成分 化合物PD1~PD14是三萜类化合物。化合物PD13与文献数据[13]及相应对照品的保留时间和质谱裂解碎片比较,鉴定为茯苓酸。
3.1.5 酚酸类成分 化合物PE1~PE3是酚酸类化合物,PE1的保留时间为3.12 min,准分子离子峰 [M-H]−/153.019 00,碎片离子/109.028 85 [M-H-COOH]−与文献报道结果相符[14],推测PE1为原儿茶酸。
原型成分PA2~PA8、PA10~PA16、PB1~PB5、PC1~PC3、PC5~PC7、PD1~PD12、PD14、PE2、PE3和PF的二级质谱数据与文献报道的质谱数据相符[15-25]。具体的质谱信息见表1。
3.2 代谢产物鉴定
3.2.1 皂苷类代谢产物 皂苷类成分在大鼠体内主要发生Ⅰ相代谢,包括脱糖基、脱羟基和还原等反应。在大鼠体内共检测到10个皂苷类代谢产物(MA1~MA10),其来源及碎片离子信息见表2。以PA9(黄芪甲苷)为例分析皂苷类成分的代谢途径。MA1~MA5是PA9的相关代谢产物。MA1准分子离子峰 [M+Na]+/513.354 74,较PA9减少294且含碎片离子/495.343 11 [M+Na-H2O]+和477.337 01 [M+Na-2H2O]+,推测是PA9水解产物:环黄芪醇[26];MA2准分子离子峰 [M+H]+/471.344 88,较MA1减少20,推测是MA1脱水脱氢产物[27];MA3准分子离子峰 [M+H]+/469.366 27,较MA1减少22,含碎片离子/451.355 59 [M+H-H2O]+和433.347 11 [M+H-2H2O]+,推测是MA1双脱水后甲基化产物[26];MA4准分子离子峰 [M+Na]+/499.340 09,较MA1减少14且两者碎片均相差14,推测是MA1脱甲基产物,同理可推MA5是MA4脱甲基产物[26]。
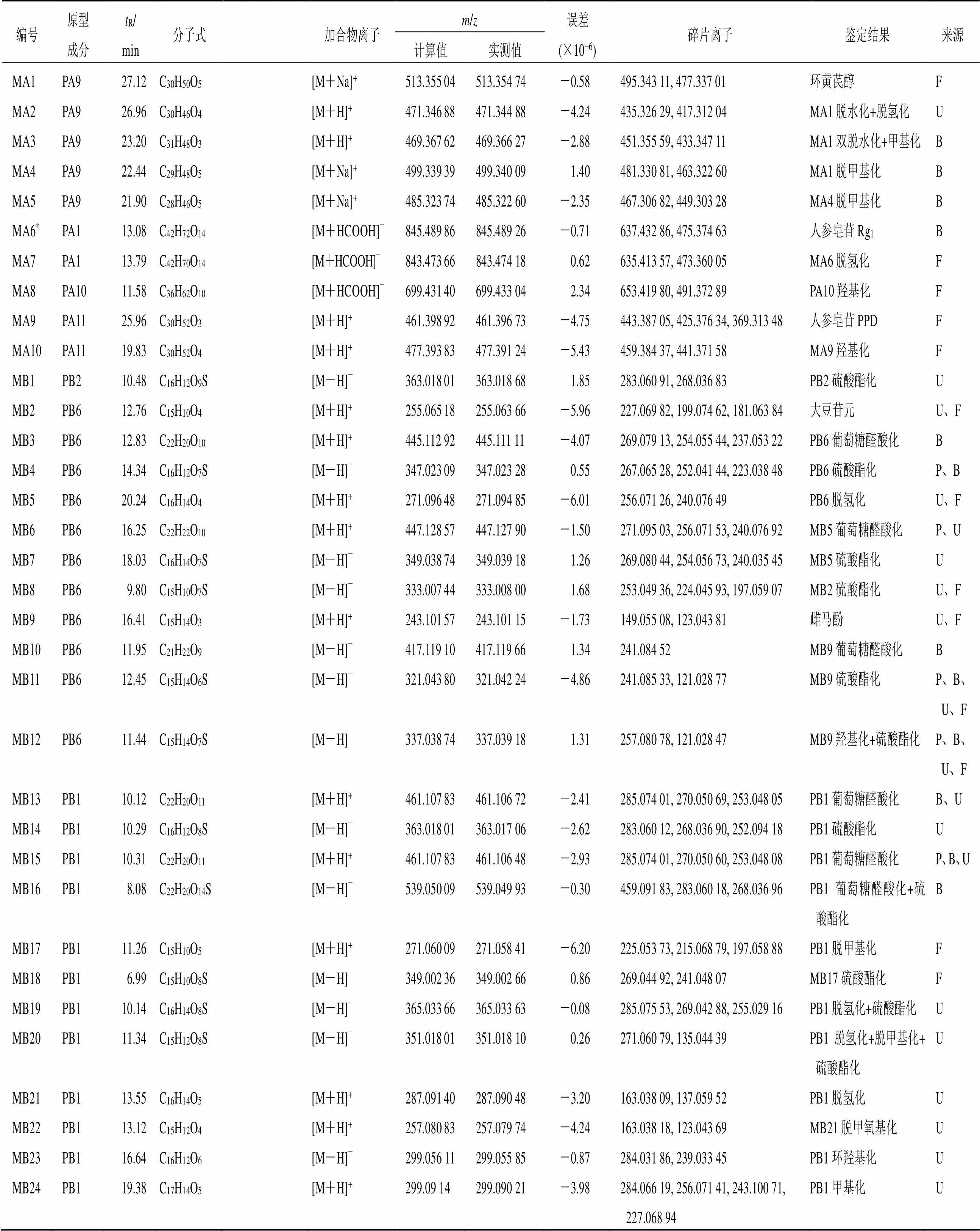
表2 参芪降糖胶囊在大鼠体内的代谢产物

续表2
续表2
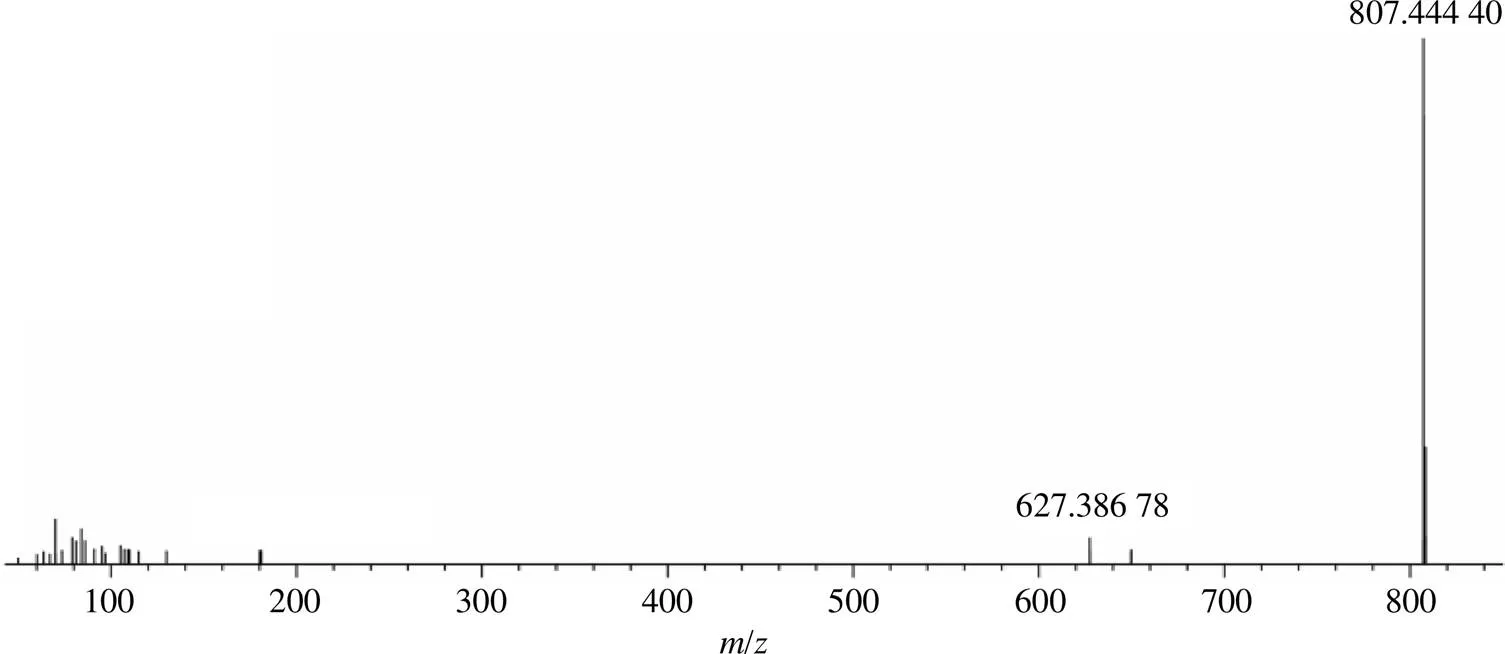
图2 PA9 (黄芪甲苷) 二级质谱图
3.2.2 黄酮类代谢产物 黄酮类化合物在大鼠体内主要发生脱甲基、脱羟基和还原等Ⅰ相代谢反应,葡萄糖醛酸化和硫酸酯化等Ⅱ相代谢反应。在大鼠体内共检测到31个黄酮类代谢产物(MB1~MB31),其来源及碎片离子信息见表2。以PB6(芒柄花素)为例分析黄酮类成分的代谢途径。MB2~MB12是PB6的相关代谢产物。MB2、MB5和MB9为Ⅰ相代谢产物,MB3、MB4、MB6~MB8和MB10~MB12为Ⅱ相代谢产物。MB2准分子离子峰 [M+H]+/255.063 66,较PB6减少14,推测是PB6脱甲基产物:大豆苷元[28];MB9准分子离子峰 [M+H]+/243.101 15,较MB2减少12,推测是MB2脱饱和后氢化还原产物雌马酚[29];MB5的准分子离子峰 [M+H]+/271.094 85,较PB6增加2,推测是PB6的氢化还原产物[27];MB8准分子离子峰 [M-H]−/333.008 00,较MB2增加80且含碎片离子/253.049 36 [M-H-SO3H]−,推测是MB2硫酸酯化产物[29],MB3准分子离子峰 [M+H]+/445.111 11,较PB6增加176且含碎片离子/269.079 13 [M+H-C6H8O6]+,推测是PB6葡萄糖醛酸化产物,同理可推MB4是PB6硫酸酯化产物[27],MB6和MB7分别是MB5的葡萄糖醛酸化产物和硫酸酯化产物,MB10和MB11分别是MB9的葡萄糖醛酸化产物和硫酸酯化产物[29];MB12准分子离子峰 [M-H]−/337.039 18,相对分子质量较MB9增加96且含碎片离子/257.080 78 [M-H-SO3H]−,推测是MB9羟基化后硫酸酯化产物[29]。
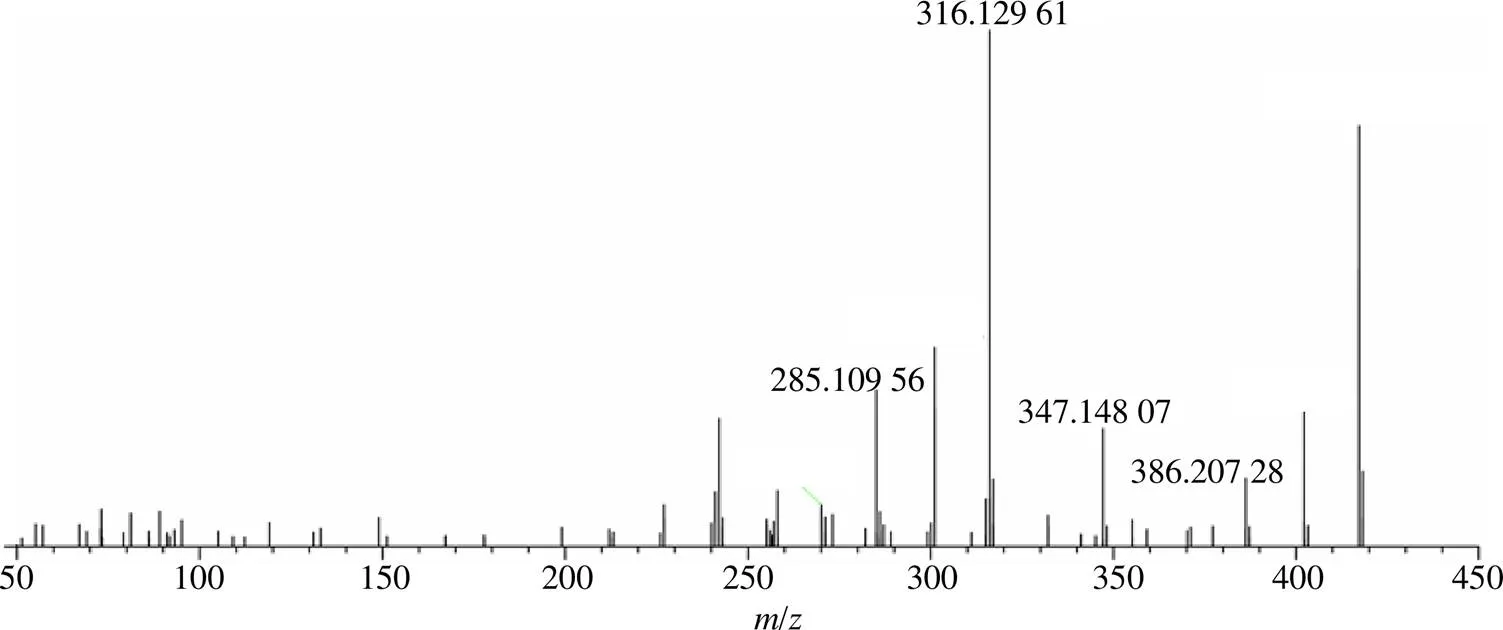
图3 PC4 (五味子甲素) 二级质谱图
3.2.3 木脂素类代谢产物 木脂素类化合物在大鼠体内主要发生脱甲基、脱羟基、羟基化和脱水等Ⅰ相代谢反应。在大鼠体内共检测到19个木脂素类代谢产物(MC1~MC19),其来源及碎片离子信息见表2。以PC4(五味子甲素)为例分析木脂素类成分的代谢途径。MC4~MC16是PC4的相关代谢产物,通过SciFinder检索发现,MC14和MC16是新化合物,MC15是未曾报道过的五味子甲素的新代谢产物。MC4准分子离子峰 [M+H]+/401.193 45,较PC4减少16,含碎片离子/386.168 79 [M+H-CH3]+、370.174 84 [M+H-OCH3]+和355.151 21 [M+H-OCH3-CH3]+,推测是PC4脱甲氧基和氧化产物[30];MC5准分子离子峰 [M+H]+/415.173 80,较MC4增加14,含碎片离子385.162 51 [M+H-2CH3]+、371.146 70 [M+H-CHO-CH3]+和356.124 60 [M+H-2CH3-CHO]+,推测是MC4醛基化产物[30];MC6准分子离子峰 [M+H]+/389.194 82,较PC4减少28,推测是PC4双脱甲基产物[30];MC7准分子离子峰 [M+H]+/421.184 30,较MC6增加32,推测为MC6双羟基化产物;MC8准分子离子峰 [M+H]+/435.200 74,较PC4增加18,含碎片离子417.189 18 [M+H-H2O]+、385.162 84 [M+H-H2O-CH3-OH]+和359.147 61 [M+H-C2H4O-CH3-OH]+,推测是PC4脱甲基后双羟基化产物[31];MC9准分子离子峰 [M+H]+/401.194 40,较MC8减少14,含碎片离子386.170 81 [M+H-CH3]+、370.174 87 [M+H-OCH3]+和355.151 21 [M+H-OCH3-CH3]+,推测是MC8的脱水脱羟基产物;MC11、MC12、MC13和MC10是同分异构体且碎片离子相似,因前三者保留时间相近,故推测MC11、MC12、MC13是PC4的单脱甲氧基和羟基化产物,MC10最后出锋,较PC4减少14,推测MC10是PC4的脱甲基产物[31]。
MC14的保留时间为21.17 min,准分子离子峰 [M+H]+/389.193 51,根据Xcalibur软件在5×10−6的质量偏差范围内推测其分子式为C22H28O6,与PC4相差28,推测是PC4羟基化后连续脱甲氧基、脱甲基产物。根据木脂素类化合物裂解规律进行碎片裂解。碎片离子/374.169 74 [M+H-CH3]+、357.168 09 [M+H-CH3-OH]+、326.149 41 [M+H-CH3-OH-OCH3]+、288.097 11 [M+H-CH3-C5H10O]+、342.144 99 [M+H-2CH3-OH]+和273.074 22 [M+H-2CH3-C5H10O]+,推测MC14是PC4羟基化后连续脱甲氧基、脱甲基产物,与Xcalibur软件推测结果一致。根据ChemDraw软件将其命名为(6,7)-2,3,10,11-tetramethoxy-6,7- dimethyl-5,6,7,8-tetrahydrodibenzo[a,c][8]annulene-1,7-diol。MC14的质谱图及裂解规律见图4。

图4 MC14的质谱图及可能的裂解规律
MC15的保留时间为21.04 min,准分子离子峰 [M+H]+/565.226 75,根据Xcalibur软件在5×10−6的质量偏差范围内推测其分子式为C28H36O12,较MC6增加176,推测是MC6葡萄糖醛酸化产物。碎片离子/389.193 54 [M+H-C6H8O6]+证实葡萄糖醛酸的存在,碎片离子/374.170 78、357.168 09、288.096 98和273.074 40与MC6一致,因此推测MC15是代谢物MC6的葡萄糖醛酸化产物,即PC4的双脱甲基后葡萄糖醛酸化产物。
MC16的保留时间为18.58 min,准分子离子峰 [M+H]+/375.176 30,根据Xcalibur软件在5×10−6的质量偏差范围内推测其分子式为C21H26O6,较MC14减少14,推测是MC14脱甲基产物。利用ChemDraw软件画出MC14脱掉1分子甲基的结构并进行碎片裂解,碎片离子/358.167 18 [M+H-OH]+、343.152 13 [M+H-OH-CH3]+、311.126 46 [M+H-H2O-OCH3-CH3]+、287.089 39 [M+H-C3H6-OCH3-CH3]+、273.074 16 [M+H-C4H8O-2CH3]+、241.048 03 [M+H-C6H12O-2OH]+和213.053 31 [M+H-C6H12O-2OCH3]+,推测是MC14脱甲基产物,与Xcalibur软件推测结果一致。通过ChemDraw软件得到其化学名为(6,7)-2,3,10- trimethoxy-6,7-dimethyl-5,6,7,8-tetrahydrodibenzo[a,c][8]annulene-1,7,11-triol。MC16的质谱图及裂解规律见图5。
3.2.4 三萜类代谢产物 三萜类化合物在大鼠体内主要以原型形式存在,在生物样品中共检测到4个三萜类相关代谢产物(MD1~MD4),经SciFinder检索,其中MD1和MD4是新化合物,MD3是未曾报道过的去氢茯苓酸的新代谢产物。
MD1的保留时间为26.12 min,准分子离子峰 [M+H]+/467.311 43,根据Xcalibur软件在5×10−6的质量偏差范围内推测其分子式为C30H42O4,与PD6(茯苓新酸B)相差18,推测为PD6脱水产物。利用ChemDraw软件对其进行碎片裂解,MD1脱去1分子羟基得碎片离子/449.302 37、支链上双键断裂得碎片离子/425.265 26和失去侧链得碎片离子/325.214 94,故推测是PD6脱水代谢产物,与Xcalibur软件推测结果一致。根据ChemDraw软件得到其化学名为()-2-((3,3a,6, 7,9b)-6-(2-carboxyethyl)-3a,6,9b-trimethyl-7-(prop-1-en-2-yl)-3a,4,6,7,8,9b-hexahydro-3-cyclopenta[a] naphthalen-3-yl)-6-methylhept-5-enoic acid。MD1的质谱图及裂解规律见图6。

图5 MC16的质谱图及可能的裂解规律
MD3的保留时间为13.11 min,准分子离子峰 [M-H]−/605.31665,根据Xcalibur软件在5×10−6的质量偏差范围内推测其分子式为C33H50O8S,比PD12(去氢茯苓酸)相对分子质量高80,碎片离子/525.358 76 [M-H-SO3H]−证实硫酸酯的存在,因此推测MD3是PD12硫酸酯化产物。
MD4的保留时间为26.36 min,准分子离子峰 [M+H]+/345.278 14,根据Xcalibur软件在5×10−6的质量偏差范围内推测其分子式为C23H36O2,利用ChemDraw软件画出PD12酯键断裂并失去侧链的结构进行碎片裂解,碎片离子/327.266 88 [M+H-H2O]+和309.256 59 [M+H-2H2O]+,推测是PD12结构上酯键断裂并失去侧链的产物。根据ChemDraw软件得到其化学名为(3,5,10,13, 14,16,17)-4,4,10,13,14,17-hexamethyl-2,3,4,5,6, 10,12,13,14,15,16,17-dodecahydro-1-cyclopenta[a] phenanthrene-3,16-diol。MD4的质谱图及裂解规律见图7。

图6 MD1的质谱图及可能的裂解规律
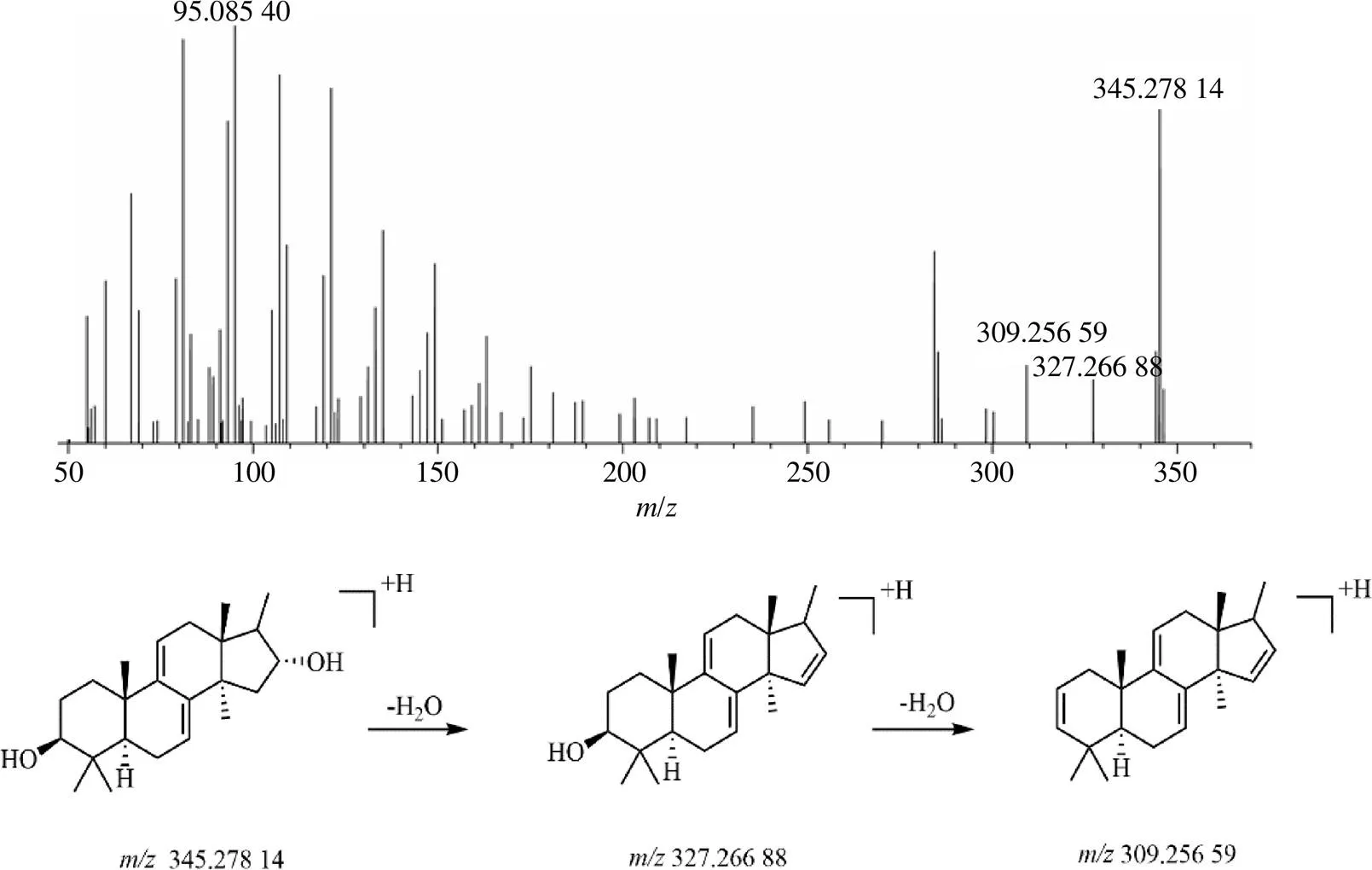
图7 MD4的质谱图及可能的裂解规律
3.2.5 酚酸类代谢产物 酚酸类化合物在大鼠体内主要发生脱甲基、脱羟基和水解反应等Ⅰ相代谢反应,硫酸酯化和甲基化等Ⅱ相代谢反应。在体内共检测到14个酚酸类代谢产物(ME1~ME14),其来源及碎片离子信息见表2。以PE1(原儿茶酸)为例分析酚酸类成分的代谢途径。ME1-ME4是PE1的相关代谢产物。ME1准分子离子峰 [M-H]−/216.980 09,较PE1增加64且含碎片离子/137.023 56 [M-H-SO3H]−,推测是PE1脱羟基后硫酸酯化产物;ME2准分子离子峰 [M-H]−/230.996 26,较ME1增加14,推测是ME1的甲基化产物;ME3准分子离子峰 [M-H]−/188.985 06较PE1增加36且含碎片离子/109.028 79 [M-H-SO3H]−,推测是PE1脱羧基后硫酸酯化产物,同理推测ME4为PE1脱羧基后羟基化后与硫酸酯结合产物。
4 讨论
本研究基于文献报道和课题组前期研究,采用UHPLC-Q-Exactive Orbitrap MS技术,在正、负离子模式下,对大鼠ig给予SJC后的生物样品进行鉴定。血浆中检测到19个原型和21个代谢产物;胆汁中检测到5个原型和31个代谢产物;尿液中检测到4个原型和44个代谢产物;粪便中检测到39个原型和37个代谢产物。
根据代谢物结构种类,将其分为5类,皂苷类、黄酮类、木脂素类、三萜类和酚酸类。其中,木脂素类和三萜类化合物在正离子模式下响应较好,皂苷类和有机酸类化合物在负离子模式下响应较好,黄酮类化合物在正、负离子模式下响应均较好,为尽可能全面获得SJC体内代谢产物信息,本研究选择在正、负离子2种模式下进行检测。
药物进入机体后主要经肝脏和胃肠道代谢,代谢产物由肾脏经尿液排出,一些生物利用度低的药物主要由粪便排出。在SJC中,皂苷类成分来源于君药人参茎叶总皂苷和黄芪,分子结构中常含有多个羟基和糖基,易发生脱羟基和脱糖基等Ⅰ相代谢反应。本研究中,检测到的皂苷类成分主要以原型形式经粪便排泄,吸收入血的成分较少。经分析,原因其一是中药复方化学成分复杂,各成分所占的配比低,含量较低,不易检测;其二是皂苷类成分极性大且相对分子质量大,在胃肠道吸收性差,生物利用度低;其三是由于在样品前处理过程中某些成分在血浆中回收率较低,没有检测到。黄酮类成分主要来源于君药黄芪,母核结构上常含有甲氧基和羟基,易发生脱甲基化、脱羟基化、脱甲氧基化和还原等Ⅰ相代谢反应及在Ⅰ相代谢物基础与葡萄糖醛酸或硫酸结合,使极性增大,经尿液和胆汁排泄。黄酮类化合物在体内经某些代谢酶作用可发生相互转化,如黄芪中代表性成分毛蕊异黄酮、芒柄花素、黄豆黄素和大豆苷元,毛蕊异黄酮通过脱羟基转变为芒柄花素,再继续脱甲基转变为大豆苷元,黄豆黄素脱甲氧基也可转变为大豆苷元,故四者具有共同的代谢物群。木脂素类化合物来源于五味子,具有联苯环辛烯型的母核结构且含有多个甲氧基和羟基,易发生脱水、脱甲基、脱甲氧基、脱羟基、羟基化和脱亚甲基等反应,其脂溶性较强,ig给药后在大鼠胃肠道的吸收较好,生物利用度较高,主要以原型和Ⅰ相代谢物形式存在于血浆和胆汁中。三萜类化合物主要来源于泽泻和茯苓药味,脂溶性较强,主要以原型形式在血浆中被检测到并经粪便排泄。酚酸类化合物分子结构中常含有多个羟基和羧基,在体内易与葡萄糖醛酸和硫酸结合,主要在胆汁中以Ⅱ相代谢物形式存在。
综上,本研究利用UHPLC-Q-Exactive Orbitrap MS方法,首次从ig给予SJC的大鼠血浆、胆汁、尿液和粪便样品中鉴定出125个化合物,包括47个原型和78个代谢产物,经SciFinder检索,其中2个为新代谢产物,4个为新化合物。本文初步阐明SJC的体内代谢特征,为明确SJC的药效物质基础和进一步阐明其活性成分作用机制及临床合理用药提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 张蕾, 王雷雷, 黎明东, 等. 参芪降糖颗粒辅助治疗气阴两虚型2型糖尿病临床研究 [J]. 新中医, 2019, 51(4): 166-168.
[2] Li R L, Dong T W, Wei J G,. Meta-analysis of the therapeutic effect of Shenqi Jiangtang Granule on type 2 diabetes mellitus [J]., 2020, 2020: 5754823.
[3] 赵能江, 杨叔禹, 李博, 等. 参芪降糖颗粒治疗2型糖尿病临床应用专家共识[J]. 中草药, 2020, 51(17): 4383-4387.
[4] 杨迎. 参芪降糖胶囊联合格列本脲片治疗2型糖尿病的疗效观察 [J]. 现代药物与临床, 2015, 30(2): 161-165.
[5] Li T L, Li H Z, Wu Y,. Efficacy and safety of Shenqi Jiangtang Granules plus oral hypoglycemic agent in patients with type 2 diabetes mellitus: A protocol for systematic review and meta-analysis of 15 RCTs [J]., 2021, 100(5): e23578.
[6] 郑谌, 朱俊, 何先凤, 等. 参芪降糖颗粒合吡格列酮二甲双胍对糖尿病合并代谢综合征的影响[J]. 世界中医药, 2022, 17(2): 237-242.
[7] 张慧, 张晓静, 姜慧洁, 等. UPLC-Q-TOF MS/MS法分析参芪降糖颗粒化学成分 [J]. 中成药, 2017, 39(10): 2101-2108.
[8] 王倩, 李冰冰, 黄文静, 等. 基于2种色谱-质谱联用技术的参芪降糖颗粒化学成分分析 [J]. 中草药, 2021, 52(6): 1568-1581.
[9] Zhang H, Chen R Y, Xu C,. Simultaneous determination of saponins and lignans in rat plasma by UPLC-MS/MS and its application to a pharmacokinetic study of Shenqi Jiangtang Granule [J]., 2021, 22(3): 224-231.
[10] Chen W Y, Liang G Y, Zheng Z L,. UPLC-ESI-Q-TOF/MS based metabolic profiling of protosappanin B in rat plasma, bile, feces, urine and intestinal bacteria samples [J]., 2021, 22(6): 491-499.
[11] Xie H L, Wang D X, Zhang W J,. Comparative pharmacokinetic studies of four ginsenosides in rat plasma by UPLC-MS/MS after oral administration of-andextracts [J]., 2019, 2019: 4972816.
[12] 刘亚丽, 魏韶锋, 宋永贵, 等. UPLC/Q-TOF-MS/MS法分析丰城鸡血藤中刺芒柄花素在大鼠肠道菌群中的代谢 [J]. 中国新药杂志, 2015, 24(23): 2715-2723.
[13] 杨慧敏, 杨彪, 胡玉梅, 等. 基于 UPLC-ESI-Q-TOF- MS/MS 技术的桂枝茯苓胶囊化学成分分析 [J]. 中国中药杂志, 2020, 45(4): 861-877.
[14] 陈家全, 王慧, 李冬玉, 等. 原儿茶酸在大鼠体内代谢产物的分析 [J]. 中成药, 2017, 39(3): 561-564.
[15] Yang L, Deng Y H, Xu S J,.pharmacokinetic and metabolism studies of ginsenoside Rd [J]., 2007, 854(1/2): 77-84.
[16] 王若柳, 王海强, 范骁辉, 等. LC-Q-TOF-MS和LC-IT-MS分析参麦注射液中化学成分 [J]. 中国中药杂志, 2020, 45(3): 555-564.
[17] Li Y, Peng Y, Wang M Y,. Rapid screening and identification of the differences between metabolites ofandwater extract in rats by UPLC-Q-TOF-MS combined pattern recognition analysis [J]., 2016, 131: 364-372.
[18] Simons A L, Renouf M, Hendrich S,. Metabolism of glycitein (7,4′-dihydroxy-6-methoxy-isoflavone) by human gut microflora [J]., 2005, 53(22): 8519-8525.
[19] 雷艳, 刘传鑫, 李尹, 等. 基于UPLC-Q-TOF-MSE的玉泉丸化学成分表征 [J]. 中药材, 2020, 43(7): 1639-1646.
[20] Wang J Y, Jiang B, Shan Y Y,. Metabolic mapping oflignans and their metabolites in rats using a metabolomic approach based on HPLC with quadrupole time-of-flight MS/MS spectrometry [J]., 2020, 43(2): 378-388.
[21] 李伟, 宋永贵, 刘匡一, 等. UHPLC-QTOF/MSE与代谢组学技术对北五味子炮制前后化学成分迁移研究 [J]. 药学学报, 2016, 51(9): 1445-1450.
[22] 方潇, 丁晓萍, 陈林霖, 等. 茯苓皮中三萜类化学成分的HPLC-LTQ-Orbitrap分析 [J]. 时珍国医国药, 2019, 30(9): 2117-2121.
[23] 邓岳, 刘阿娜, 王小明, 等. HPLC-TOF-MS分析泽泻提取物中三萜类化合物 [J]. 化学分析计量, 2015, 24(6): 11-14.
[24] Wang X Y, Yan K J, Ma X H,. Simultaneous determination and pharmacokinetic study of protocatechuic aldehyde and its major active metabolite protocatechuic acid in rat plasma by liquid chromatography-tandem mass spectrometry [J]., 2016, 54(5): 697-705.
[25] 雷冬梅, 姚长良, 陈雪冰, 等. 基于RP-Q-TOF-MS和HILIC-Q-TOF-MS的经典名方当归补血汤成分分析 [J]. 中国中药杂志, 2022, 47(8): 2109-2120.
[26] 刘晓亚. 黄芪甲苷和环黄芪醇的体内外代谢研究 [D]. 北京: 北京中医药大学, 2013.
[27] 贾璐. 黄芪建中汤化学成分体内代谢研究 [D]. 太原: 山西大学, 2020.
[28] Ding Y, Chen S T, Wang H L,. Identification of secondary metabolites inby UPLC-Q-exactive-orbitrap MS [J]., 2021, 2021: 1-8.
[29] Huang J, Chen H Y, Li C Y,. Screening and identification of the metabolites of water extracts of raw and honey-processedin rat urine based on UHPLC/ESI-Q-TOF-MS and multivariate statistical analysis [J]., 2018, 29(9): 1919-1935.
[30] 苏联麟, 程雪, 季德, 等. 基于UHPLC-QTOF/MS技术的生、醋五味子醇提物在大鼠血浆、胆汁、尿液、粪便中药物原形成分及其代谢产物的分析鉴定 [J]. 药学学报, 2016, 51(10): 1600-1608.
[31] Zhang H Z, Jiang Y M, Wu J J,. Metabolic mapping ofextract and its active lignans using a metabolomic approach based on ultra high performance liquid chromatography with high-resolution mass spectrometry [J]., 2017, 40(2): 574-586.
Identification of metabolites of Shenqi Jiangtang Capsules in rats based on UHPLC-Q-Exactive Orbitrap MS
YUAN Nan-nan, WANG Hong-jin, SUN Qi, ZHAO Lei, BAI Hua-fang, SUN Li-xin
College of Pharmacy, Shenyang Pharmaceutical University, Benxi 117004, China
To investigate the metabolites and their major metabolic pathways of Shenqi Jiangtang Capsules (SJC, 参芪降糖胶囊) in rat plasma, bile, urine and feces biological samples.Based on UHPLC-Q-Exactive Orbitrap MS technology, gradient elution was carried out with 0.1% formic acid solution (A)-acetonitrile (B) as the mobile phase, and full scanning and secondary mass spectrometry scanning were carried out with ESI ion source in positive and negative ion modes, respectively, to obtain the primary and secondary mass spectrometry data of the compounds. Combined with literature reports, the fragmentation pattern of reference substance and the law of drug metabolism reaction, the biological samples of rats after ig administration of SJC suspension were analyzed and identified.A total of 125 compounds were identified in rats, including 47 prototype components (PA1—PF) and 78 metabolites (MA1—ME14), of which two were novel metabolites, namely MC15 (glucuronic acid product after di-demethylation of schizandrin A) and MD3 (sulfuric acid esterification product of dehydropachymic acid), and four were new compounds, namely (6,7)-2,3,10,11-tetramethoxy-6,7-dimethyl-5,6,7,8-tetrahydrodibenzo[a,c][8] annulene-1,7-diol (MC14), (6,7)-2,3,10-trimethoxy-6,7-dimethyl-5,6,7,8-tetrahydrodibenzo [a,c][8]annulene-1,7,11-triol (MC16), ()-2-((3,3a,6,7,9b)-6-(2-carboxyethyl)-3a,6,9b-trimethyl-7-(prop-1-en-2-yl)-3a,4,6,7,8,9b-hexa hydro-3-cyclopenta[a] naphthalen- 3-yl)-6-methylhept-5-enoic acid (MD1) and (3,5,10,13,14,16,17)-4,4,10,13,14,17-hexamethyl-2,3,4,5,6,10,12,13,14,15, 16,17-dodecahydro-1-cyclopenta[a]phenanthrene-3,16-diol (MD4).Research revealed that dehydroxylation, demethylation, dehydration, hydrolysis, reductive hydrogenation, methylation, glucuronidation and sulfation were the main metabolic pathways of SJC in rat samples. The preliminarily clarifiedmetabolic characteristics of SJC provided a reference for exploring bioactive ingredients and action mechanisms of SJC.
Shenqi Jiangtang Capsules; UHPLC-Q-Exactive Orbitrap MS; metabolites; metabolic pathways; astragaloside IV; formononetin; schizandrin A
R284.1
A
0253 - 2670(2023)22 - 7358 - 16
10.7501/j.issn.0253-2670.2023.22.013
2023-03-18
辽宁省教育厅“辽宁特聘教授滚动支持项目”(辽教函[2018]35号)
苑楠楠(1995—),女,硕士,研究方向为药物分析。Tel: (024)43520599 E-mail: ynn950921@163.com
通信作者:孙立新(1967—),女,博士,教授,研究方向为药物分析。Tel: (024)43520599 E-mail: slx04@163.com
[责任编辑 王文倩]