PD-1单抗联合GC化疗治疗晚期尿路上皮癌的疗效及对肿瘤恶性程度的影响
刘文辉,沈宏亮
(首都医科大学附属北京友谊医院泌尿外科,北京 101125)
尿路上皮癌为泌尿系统恶性肿瘤之一,占尿路恶性肿瘤发病率的5%~10%,预后差,复发转移率高[1]。对无法切除的晚期尿路上皮癌患者而言,全身化疗为一种有效治疗手段。吉西他滨+顺铂(GC)化疗方案为治疗晚期尿路上皮癌的一线方案,可一定程度改善患者预后,延长患者生存周期,且不良反应较传统方案低[2]。但临床实践中显示,晚期尿路上皮癌经GC化疗后远期生存率仍处于低水平,仍需进一步探寻治疗方案。目前,程序性死亡受体-1(PD-1)/程序性死亡受体-1配体(PD-L1)免疫检查点抑制剂在肺癌、肾细胞癌、肝癌等研究中收获了良好效果,为恶性肿瘤治疗提供了新途径[3-5]。国外研究显示,免疫治疗联合一线化疗对延长尿路上皮癌患者生存周期具有一定积极效益[6]。但国内相关研究报道较为鲜见,仍需进一步研究论证。基于此,本研究尝试观察PD-1单抗联合GC化疗治疗晚期尿路上皮癌的疗效及对肿瘤恶性程度的影响。
1 资料与方法
1.1 一般资料
将本院2019年1月至2020年6月收治的64例晚期尿路上皮癌患者作为研究对象,以电脑随机数字表法分为联合组、化疗组,各32例。患者纳入标准:(1)均经病理检查证实为尿路上皮癌;(2)临床分期ⅢB~Ⅳ期;(3)无法进行手术或者术后出现复发转移;(4)存在客观可测定病灶;(5)经免疫组织化学法测定肿瘤细胞表面PD-L1表达阳性率均≥1%;(6)美国东部肿瘤协作组(ECOG)评分≤2分;(7)卡氏功能状态评分量表(KPS)≥70分;(8)预计生存期≥3个月;(9)知晓本研究治疗方法利弊,自愿签订知情同意书。排除标准:(1)合并自身免疫系统疾病、血液系统疾病、其他类型恶性肿瘤者;(2)合并严重心肺疾病者;(3)严重肝肾功能不全者;(4)近一个月有外伤、手术史者;(5)肿瘤出现脑转移者;(6)既往曾行免疫治疗者;(7)合并严重周围神经感觉异常者。研究经医院医学伦理委员会同意。2组患者性别、年龄、ECOG评分、肿瘤转移情况、分化程度、肿瘤部位等资料比较,差异无统计学意义(P>0.05),见表1。
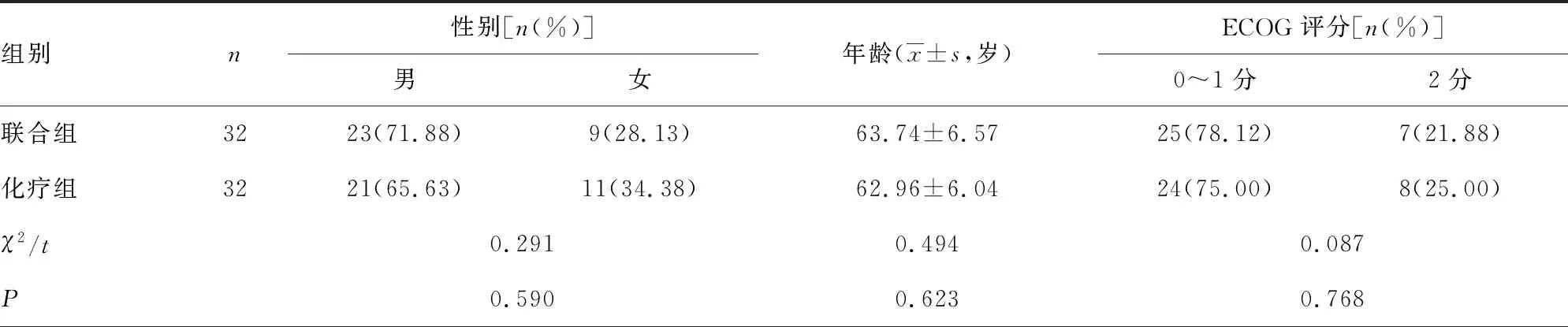
表1 2组一般资料比较
1.2 方法
化疗组予以GC化疗:第1天、第8天予以吉西他滨[山东睿鹰制药集团有限公司,国药准字H20213298]1 000 mg/m2;第2 天予以顺铂[吉斯美(武汉)制药有限公司,国药准字H20044945]70~75 mg/m2,3周为一个化疗周期。联合组予以PD-1单抗联合GC化疗:GC化疗方法同化疗组,在此基础上联合使用帕博利珠单抗(美国默沙东公司,批准文号S20180019),每21天予以200 mg帕博利珠单抗,静脉滴注。2组均治疗6周。注意在顺铂使用期间需充分水化,保证尿量≥2 000 mL/d。在化疗期间每周检测血常规与肝肾功能,若血常规检查示血小板、白细胞减少时需采取细胞刺激因子治疗,产生化疗有关非血液系统不良反应时需给予补液、止吐等对症治疗。
1.3 疗效评估标准
治疗6周后采取MRI或CT检查,参考原发病灶实体瘤疗效评价标准1.1版(RECIST1.1)评估患者疗效,分为疾病进展、疾病稳定、部分缓解、完全缓解,疾病缓解率=(部分缓解患者数+完全缓解患者数)/总患者数×100%;疾病控制率=(疾病稳定患者数+部分缓解患者数+完全缓解患者数)/总患者数×100%[7]。
1.4 观察指标
(1)2组治疗6周后疗效。(2)2组治疗前、治疗3周、治疗6周后血清肿瘤标志物水平,上述时间点分别采集患者5 mL清晨空腹静脉血样,以3 000 r/min转速低温下离心10 min(离心半径8 cm),取血清,以全自动免疫分析仪(美国Abbott Axsym公司)测定血清糖类抗原125(CA125)水平,酶联免疫吸附法测定肿瘤特异性生长因子(TSGF)水平,化学发光免疫分析法测定细胞角蛋白19片段(CYFRA21-1)水平,试剂盒均购自深圳瑞华同康生物公司。(3)治疗期间不良反应情况,参考常见不良反应事件评价标准4.0版(CTCAE4.0),分为Ⅰ~Ⅳ级。(4)治疗后通过电话、微信、门诊随访方式统计2组18个月内生存情况。
1.5 统计学处理
2 结 果
2.1 2组疗效
2组治疗6周后疾病缓解率(χ2=0.563,P<0.453)、疾病控制率(χ2=1.896,P<0.169)比较差异无统计学意义,见表2。

表2 2组疗效比较[n(%)]
2.2 组间组内血清肿瘤标志物水平
2组血清CA125、TSGF、CYFRA21-1水平组间、不同时间点及交互作用比较,差异有统计学意义(P<0.05),联合组血清CA125、TSGF、CYFRA21-1水平下降幅度较化疗组更明显。两两比较,2组治疗前上述指标水平差异无统计学意义(P>0.05);与治疗前比较,2组治疗3、6周后上述指标水平均下降,且联合组下降幅度较化疗组更明显(P<0.05),见表3。

表3 组间组内血清肿瘤标志物水平比较
2.3 2组不良反应率
治疗期间联合组皮疹、乏力发生率较化疗组更高(P<0.05),2组肺炎、发热、视力模糊、外周神经毒性、口腔黏膜炎、脱发、肝功能损害、肾功能损害、胃肠道反应、贫血、血小板减少症、白细胞减少症发生率差异无统计学意义(P>0.05),见表4。
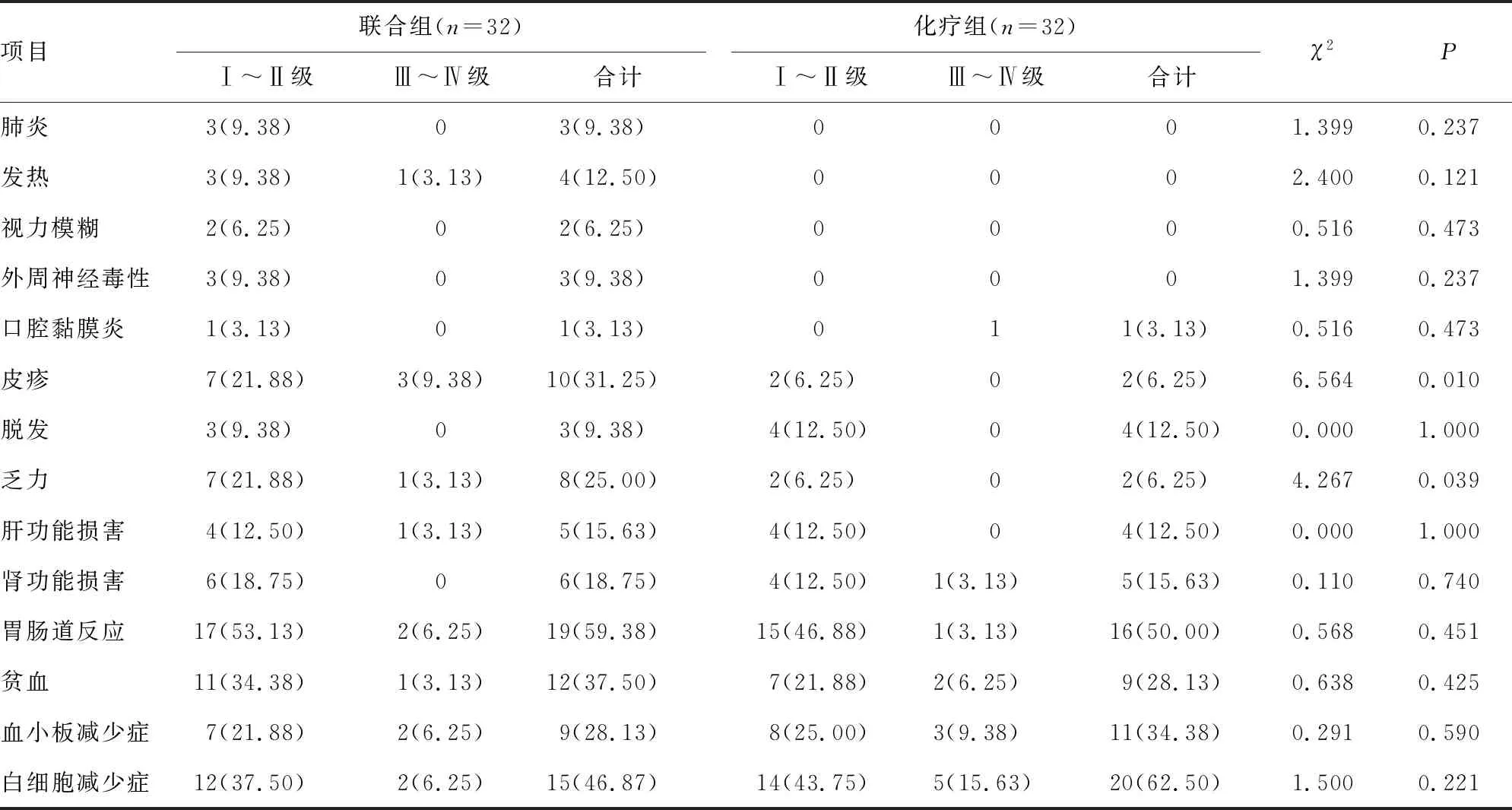
表4 2组不良反应率比较[n(%)]
2.4 2组生存情况
2组治疗后均进行18个月随访,共有3例病例脱落,联合组脱落1例,化疗组脱落2例。2组治疗后6、12个月生存率比较差异无统计学意义(P>0.05),联合组治疗18个月生存率高于化疗组(P<0.05),见表5、图1。
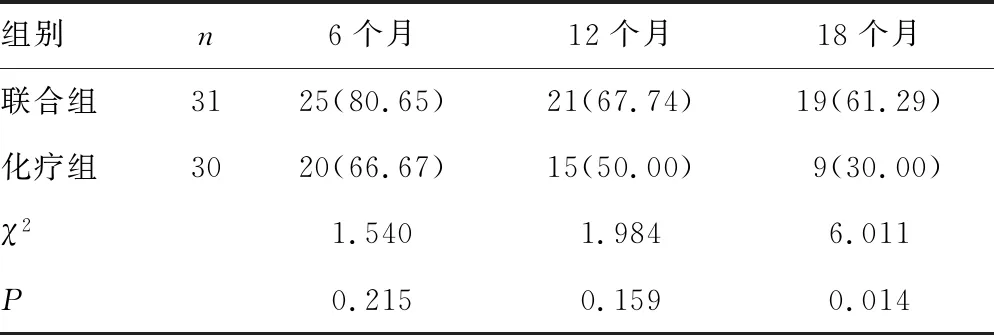
表5 2组生存率比较[n(%)]
3 讨 论
尿路上皮癌属化疗敏感性恶性肿瘤,对临床多种化疗方案均有效,其中GC化疗方案因其治疗有效率高、不良反应小被作为治疗尿路上皮癌标准一线方案[8-9]。刘涛[10]研究中显示,GC化疗治疗晚期膀胱癌客观缓解率为35.14%,中位生存期为14.3个月。可见单纯应用GC方案治疗仍有一定疗效,但难以提高患者远期生存受益,仍需探寻进一步改善手段。
国内外研究报道,PD-1单抗联合化疗应用于晚期肺癌、肝癌等均明显提升治疗反应率,改善临床获益[11-12]。本研究显示,对晚期尿路上皮癌应用PD-1单抗联合GC化疗治疗后疾病缓解率、疾病控制率虽增高不明显,但治疗后18个月生存率为61.29%,显著高于单一化疗患者。这与韩馥馨等[13]研究报道的PD-1单抗联合吉西他滨或者紫杉醇+铂类化疗可延长晚期尿路上皮癌患者中位无进展生存期结果相互支持。提示应用PD-1单抗联合GC化疗治疗可延长患者生存时间,疗效更理想。有关研究报道,化疗可杀伤癌细胞,凋亡的癌细胞可大量释放出肿瘤自身抗原,后者被抗原提呈细胞所摄取后会给肿瘤呈递特异性T淋巴细胞[14]。而帕博利珠单抗作为一种PD-1抑制剂,能同T淋巴细胞上的PD-1受体结合,进而阻断其同PD-L1及PD-L2结合,解除由PD-1通路诱导的免疫应答抑制,改善T细胞对癌细胞免疫监视作用,阻止癌细胞增殖并促使其凋亡,增强治疗效果,利于提升生存周期[15]。但也有国外研究报道,与单纯化疗比较,应用免疫治疗联合化疗治疗晚期尿路上皮癌患者未取得显著疗效优势[16]。由于应用PD-1单抗联合化疗治疗尿路上皮癌疗效尚处于持续论证阶段,其确切疗效仍需大量研究证实。
尿路上皮癌可导致体内肿瘤标志物表达变化,对这些标志物水平进行监测可为疾病病情转归及疗效评价提供参考。CA125可影响细胞黏附作用,且可抑制免疫细胞发挥正常功能,使癌细胞产生免疫逃逸,研究报道,其还可与腹膜上锚定糖蛋白相结合,促进肿瘤产生腹膜转移[17]。TSGF是肿瘤细胞与肿瘤血管新生过程中形成的糖脂、糖蛋白组成的物质,表达水平与肿瘤血管新生、肿瘤浸润、转移密切相关[18-19]。CYFRA21-1在正常人体液中呈低表达,当产生上皮细胞癌变后,细胞角蛋白会被蛋白酶降解,致使CYFRA21-1释放进入血液,导致血液CYFRA21-1表达增高,研究报道,其表达与膀胱尿路上皮癌患者预后有关[20]。由本研究可知,应用PD-1单抗联合GC化疗治疗后患者血清CA125、TSGF、CYFRA21-1水平下降较单一化疗更显著。也提示应用PD-1单抗联合GC化疗治疗可降低肿瘤恶性程度。分析帕博利珠单抗能阻止癌细胞增殖、侵袭,并促使其产生凋亡,使肿瘤局部病灶缩小或消失,有助于减少有关肿瘤标志物分泌[21]。
在用药安全性方面,应用PD-1单抗联合GC化疗患者出现了肺炎、发热、外周神经毒性、视力模糊等不良反应,且治疗期间皮疹、乏力发生率较高。提示在联合PD-1单抗治疗期间应注意防范皮疹、乏力,保证用药安全。
综上所述,应用PD-1单抗联合GC化疗治疗晚期尿路上皮癌可降低肿瘤恶性程度,延长生存时间,且可获得良好安全性,但需注意防范皮疹、乏力等不良反应发生。

