miR-24-3p/S1PR2信号轴对大鼠RMECs损伤的作用与机制研究
贺蛟龙,徐云玲
(1.吉首大学第一附属医院/湘西土家族苗族自治州人民医院重症医学科,湖南吉首 416000;2.浙江省立同德医院/浙江省中医药研究院/浙江省中药新药研发重点实验室,杭州 310007)
普遍研究认为,脂多糖(lipopolysaccharide,LPS)引起脓毒症的发生机制与炎症细胞因子“瀑布样释放”、血管氧化应激水平升高和内皮细胞中多糖-蛋白质复合物降解有关[1]。肾脏是脓毒症的易损器官,严重脓毒症患者中合并急性肾损伤(acute kidney injury,AKI)发生率高达50%以上[2]。作为一类特殊微血管类型的细胞,肾小球内皮细胞(retinal microvascular endothelial cells,RMECs)损伤已被证实与AKI密切相关[3]。1-磷酸鞘氨醇受体2(sphingosine-1-phosphate receptors 2,S1PR2)在成年鼠肾脏和人血管细胞、血管内皮细胞中广泛表达[4],不仅具有调节多种细胞增殖、生存及迁移等功能,还可以调节血管内皮细胞屏障的通透性[5-6],参与血管炎症反应[7-8],介导血管平滑肌细胞的迁移和增殖[9],被认为在LPS血症期间血管内皮的通透性和炎症反应中起关键作用。随着分子微生物学研究的不断进展,越来越多的研究发现,微RNA(microRNA,miRNA)是参与肾脏各个结构与功能维持的重要稳态调节因子,可通过不完全互补结合到目的基因mRNA 3′ UTR,抑制蛋白翻译进而抑制蛋白合成,从而调节多种生物学过程[10-11]。miRNA在AKI中多出现异常表达,可能参与AKI的发病机制,调节视网膜微血管内皮细胞凋亡、炎症等过程[12]。在众多miRNA中,miR-24-3p是研究较为广泛的一组[13-14]。miR-24-3p在肿瘤组织中高度表达,并促进细胞增殖、迁移和癌细胞的侵袭,在缺血/再灌注中发挥心脏保护作用。基于以上研究背景和预测,本研究拟验证在LPS诱导的RMECs中,miR-24-3p靶向调控S1PR2表达继而影响细胞损伤和凋亡过程,以期为AKI的临床治疗提供新的思路和实验依据。
1 材料与方法
1.1 材料
1.1.1实验动物与RMECs的分离培养鉴定
SPF级3~8 d龄SD大鼠6只购于北京阜华康生物科技股份有限公司[许可证号SYXK(赣)2020-0001]。动物适应环境:温度(23±2)℃,湿度50%~75%,普通饲料喂养。参照GREEN等[15]的三步梯度筛网法分离肾小球。无菌条件下摘取4~6周大鼠肾脏,磷酸缓冲盐溶液(PBS)冲洗后取肾皮质,剪碎后于70 μm细胞筛网研磨、过滤、离心得到肾小球。再取0.125%胰蛋白酶消化后的肾小球离心,弃上清液后加入配置好的内皮细胞培养基(20%胎牛血清,DMEM/F12,20 mg/L内皮生长因子),于37 ℃、5% CO2培养箱中培养,3 d后第1次换液,随后隔日换液。待细胞融合成单层时进行传代,经鉴定后取第4~10代细胞用于后续实验。
采用倒置显微镜观察分离培养的细胞。0.125%胰酶消化细胞后,按4×104/cm2将细胞接种于24孔板中,待细胞铺满单层后用PBS清洗,4%多聚甲醛固定,PBS再次清洗,加5%牛血清白蛋白(BSA),37 ℃封闭30 min,分别加入一抗vWF(1∶200)孵育4 h、二抗Cy3标记的(1∶200)孵育30 min,PBS洗3次加DAPI避光孵育5 min,50%甘油封闭,荧光显微镜观察。
1.1.2仪器与试剂
倒置荧光显微镜(CKX53)购于奥林巴斯(上海)有限公司;全自动酶标仪(WD-2102B)、电泳仪(DYY-8C)和蛋白垂直电泳仪(DYY-6C)均购于北京六一仪器厂;超高灵敏度化学发光成像系统(Chemi DocTMXRS+)、荧光PCR仪(CFX ConnectTM实时)均购于伯乐生命医学产品(上海)有限公司;化学发光图像分析系统(Tanon-5200,上海天能科技有限公司);多功能酶标仪(SuPerMax 3100)购于上海闪谱生物科技有限公司。胎牛血清(FBS,10099-141)、营养混合液F-12(DMEM/F-12)、OPTI-MEM培养基(31985-062)、GlutaMAXTM添加剂(10565018)、超敏发光液(RJ239676)购于美国Gibco公司;胰蛋白酶-乙二胺四乙酸(EDTA)消化液(T1300)、牛血清白蛋白(BSA,A8020)购于北京索莱宝科技有限公司;大鼠肿瘤坏死因子(tumor necrosis factor,TNF)-α ELISA试剂盒(MM-0180R2)、大鼠白细胞介素(interleukin,IL)-1β ELISA试剂盒(MM-0047R2)购于武汉伊莱瑞特生物科技股份有限公司;Trizon Reagent(CW0580S)、miRNA提取试剂盒(CW0627S)、超纯RNA提取试剂盒(CW0581M)、BCA蛋白定量试剂盒(CW0014S)购于北京康为世纪生物科技有限公司;cDNA第一链合成试剂盒(MR101-02)、实时荧光定量PCR(qPCR)试剂盒(MQ101-02)、逆转录(RT)-qPCR专用预混液(+gDNA wiper,R223-01)、通用型高敏感度染料法定量PCR检测试剂盒(Q711-02)购于南京诺唯赞生物科技股份有限公司;小鼠抗β-actin单克隆抗体(TA-09,1∶2 000)、辣根化物酶标记的山羊抗鼠免疫球蛋白G(IgG,H+L,ZB-2305,1∶2 000)、辣根化物酶标记的山羊抗兔IgG(H+L,ZB-2301,1∶2 000)购于北京中杉金桥生物技术有限公司;兔抗S1PR2抗体(21180-1-ap,1∶1 000)购于美国Proteintech公司;兔抗caspase-3(af6311,1∶500)、兔抗caspase-9(AC062,1∶500)、兔抗细胞分裂周期蛋白20(cell division cycle 20,CDC20,af4759,1∶1 000)、兔抗血管内皮生长因子(vascular endothelial growth factor,VEGF,af5131,1∶1 000)、vWF(AF3000,1∶200)均购于美国Affinity公司;Cy3标记的山羊抗兔IgG (H+L,As007,ABclonal,1∶200)购于武汉爱博泰克生物科技有限公司。miR-24-3p inhibitor、miR-24-3p inhibitor NC、LipofectamineTM2000转染试剂购于美国Invitrogen公司。
1.2 方法
1.2.1细胞实验分组
当细胞密度达70%时进行转染;按照LipofectamineTM2000转染试剂说明书进行转染操作。实验根据加入转染物的不同分为4组:对照组(control组),LPS模型组(LPS组),inhibitor NC+LPS组(转染miR-24-3pinhibitor NC试剂100 nmol/L),LPS+miR-24-3p inhibitor组(转染miR-24-3p inhibitor试剂100 nmol/L)。各组各设6个复孔,加药前24 h内换无血清培养液。
1.2.2总RNA提取及RT-qPCR检测
收集各组细胞,按试剂盒说明书操作提取细胞中总RNA,按miRNA逆转录试剂盒说明书操作逆转录合成cDNA,测定合成的cDNA水平和纯度,采用RT-qPCR检测miR-24-3p的mRNA水平。引物如下:miR-24-3p上游引物5′-GCGTGGCTCAGTTCAGCAG-3′,下游引物5′-AGTGCAGGGTCCGAGGTATT-3′;按照PCR试剂盒说明书要求建立反应体系,PCR循环条件如下:95 ℃ 10 min;95 ℃ 10 s,58 ℃ 30 s,40个循环;72 ℃ 30 s。以U6和β-actin作为内参,基因的相对表达水平用2-ΔΔCt法进行数据分析。
1.2.3CCK8检测与细胞活力计算
细胞生长至70%~80%融合时采用胰酶消化、重悬,细胞计数,调整细胞密度为1×104/孔;24 h后进行CCK8检测,在96孔板中配置100 μL的细胞悬液,每孔加入10 μL CCK8试剂,置于恒温培养箱中避光孵育2 h;在酶标仪450 nm波长处检测各孔的吸光度(A)值。细胞活力V细胞计算公式为:
V细胞=(A实验-A空白)/(A对照-A空白)×100%
(1)
1.2.4流式细胞术检测细胞凋亡及活性氧(reactive oxygen species,ROS)水平
转染miR-24-3p inhibitor成功后的RMECs细胞加入LPS(1 μg/mL)诱导处理24 h。收集并洗涤细胞3次,胰酶消化细胞、离心,按试剂盒方法加入染料,采用流式细胞仪检测。另取转染miR-24-3p inhibitor成功后的RMECs细胞加入LPS(1 μg/mL)诱导处理24 h。完成造模后,采用无血清培养基按照1∶1 000稀释2’,7’-二氯二氢荧光素二乙酸酯(DCFH-DA),终浓度为10 μmol/L;弃去细胞培养液,向细胞中加入稀释好的DCFH-DA,37 ℃培养箱孵育20 min;采用无血清培养液洗涤3次,充分去除多余的、未进入细胞的DCFH-DA;加1 mL PBS洗涤,1 500 r/min离心5 min,弃上清液;加500 μL PBS重悬细胞后采用流式细胞仪检测。
1.2.5细胞上清液TNF-α、IL-1β表达及SOD、MDA水平检测
转染miR-24-3p inhibitor成功后的RMECs细胞加入LPS(1 μg/mL)诱导处理24 h。完成造模后,收集上清液;上清液离心,分装,-80 ℃冻存。根据ELISA法测定培养液中TNF-α、IL-β。另取转染miR-24-3p inhibitor成功后的RMECs细胞加入LPS(1 μg/mL)诱导处理24 h。采用黄嘌呤氧化酶法测定SOD,硫代巴比妥酸比色分析法测定MDA,操作步骤按试剂盒说明书。SOD活力VSOD计算公式为:
VSOD=K/50%×i×(0.24 mL/0.02 mL)/S
(2)
其中,K代表SOD抑制率,i代表反应体系稀释倍数,S代表待测样本蛋白水平。
1.2.6qPCR检测
收集细胞,采用miRNA提取试剂盒提取总miRNA,测定其水平和纯度,通过HiScript Ⅱ Q RT SuperMix for qPCR逆转录试剂盒合成产物,利用PCR仪进行qPCR检测。引物如下:S1PR2上游引物5′-CGCCAAGGTCAAGCTCTA-3′,下游引物5′-GCAAGCCTCCAGATGGT-3′;GAPDH上游引物5′-GACAACTTTGGCATCGTGGA-3′,下游引物5′-ATGCAGGGATGATGTTCTGG -3′。 反应体系如下:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,cDNA 1 μL,上下游引物各0.4 μL,RNase Free dd H2O补足体积到20 μL。反应过程:95 ℃、10 min;95 ℃、10 s,57 ℃、30 s,40个循环;72 ℃、30 s。
1.2.7蛋白免疫印迹(Western blot)检测
收集转染后的RMECs细胞,提取细胞总蛋白,BCA法检测蛋白水平后进行聚丙烯酰胺凝胶电泳分离,转聚偏二氟乙烯膜孵育一抗,4 ℃过夜,洗膜3次后室温下孵育辣根过氧化物酶标记的山羊抗小鼠或兔IgG二抗2 h,洗膜后采用增强化学发光液显影拍照,Image J软件对蛋白条带进行半定量分析,半定量结果以目标条带与β-actin条带灰度值的比值表示目的蛋白的表达水平。
1.3 统计学处理

2 结 果
2.1 RMECs鉴定结果
RMECs原代分离培养3~4 d后,在倒置显微镜下可观察到贴壁生长的散在集落,细胞以梭形和多角形为主,6 d后逐渐整合成单层。免疫荧光检测可见RMECs呈多角形,细胞质Ⅷ因子相关抗原表达呈强阳性,说明分离培养的细胞为RMECs,见图1。
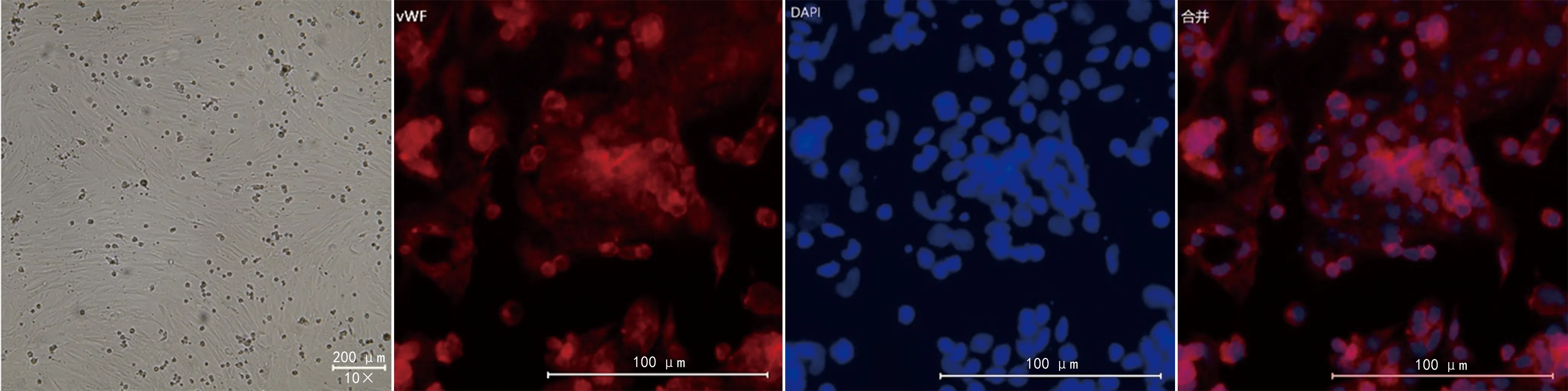
图1 RMECs的免疫荧光检测结果
2.2 4组RMECs增殖与凋亡情况比较
与control组比较,LPS组的凋亡率上升(P<0.05);与inhibitor NC+LPS组比较,miR-24-3p inhibitor+LPS组凋亡率上升(P<0.05),见图2。
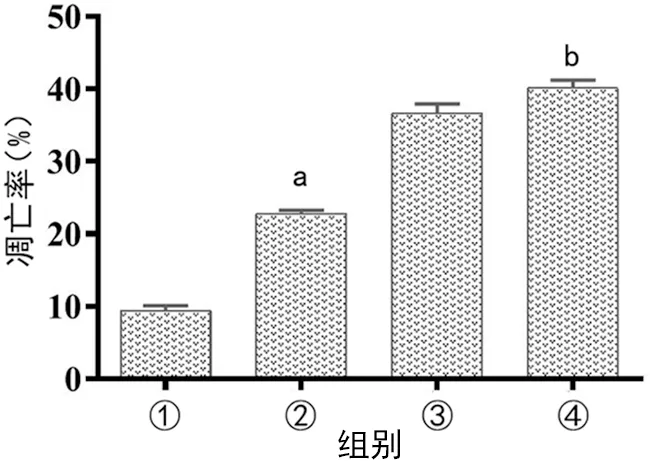
①:control组;②:LPS组;③:inhibitor NC+LPS组;④:LPS+miR-24-3p inhibitor组;a:P<0.05,与control组比较;b:P<0.05,与inhibitor NC+LPS组比较。
2.3 4组RMECs细胞炎症细胞因子表达水平比较
与control组比较,LPS组的TNF-α、IL-1β水平上升(P<0.05);与inhibitor NC+LPS组比较,miR-24-3p inhibitor+LPS组的TNF-α、IL-1β水平上升(P<0.05),见图3。
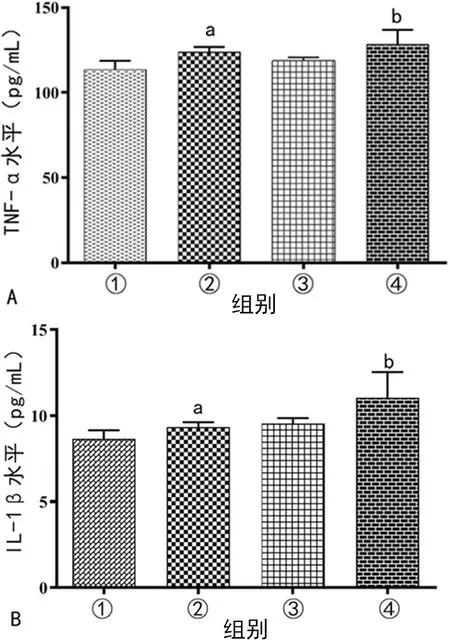
A:4组TNF-α水平比较;B:4组IL-1β水平比较;①:control组;②:LPS组;③:inhibitor NC+LPS组;④:LPS+miR-24-3p inhibitor组;a:P<0.05,与control组比较;b:P<0.05,与inhibitor NC+LPS组比较。
2.4 4组RMECs内ROS水平比较
与control组比较,其他3组的ROS表达明显降低,差异有统计学意义(P<0.05),见图4。
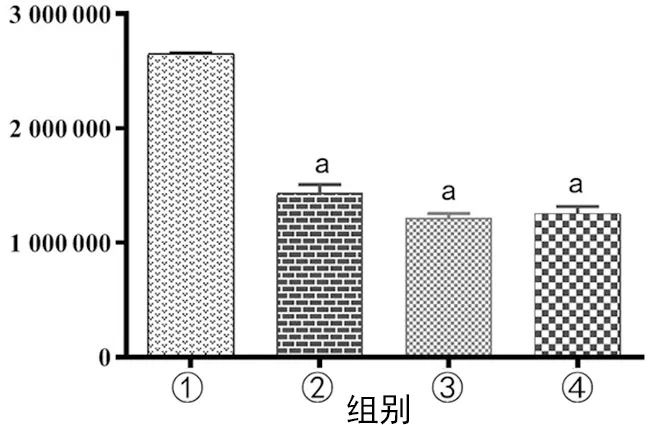
①:control组;②:LPS组;③:inhibitor NC+LPS组;④:LPS+miR-24-3p inhibitor组;a:P<0.05,与control组比较。
2.5 4组RMECs氧化应激损伤相关因子表达水平比较
与control组比较,LPS组的MDA、SOD表达水平上升(P<0.05);与inhibitor NC+LPS组比较,miR-24-3p inhibitor+LPS组的MDA表达水平上升(P<0.05),SOD表达水平下降(P<0.05),见图5。
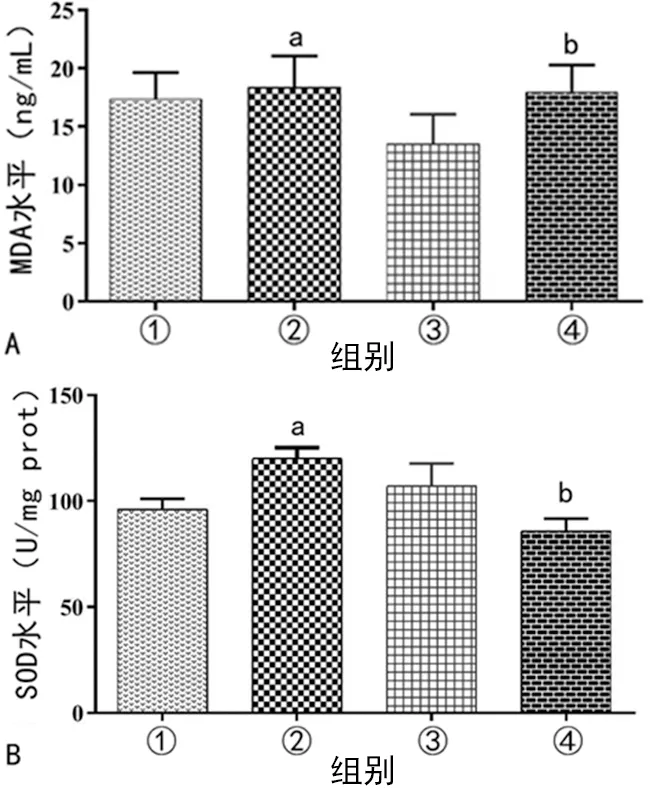
A:4组MDA水平比较;B:4组SOD水平比较;①:control组;②:LPS组;③:inhibitor NC+LPS组;④:LPS+miR-24-3p inhibitor组;a:P<0.05,与control组比较;b:P<0.05,与inhibitor NC+LPS组比较。
2.6 4组RMECs S1PR2表达水平比较
与control组比较,LPS组的S1PR2表达上升(P<0.05);与inhibitor NC+LPS组比较,miR-24-3p inhibitor+LPS组的S1PR2表达下降(P<0.05),见图6。
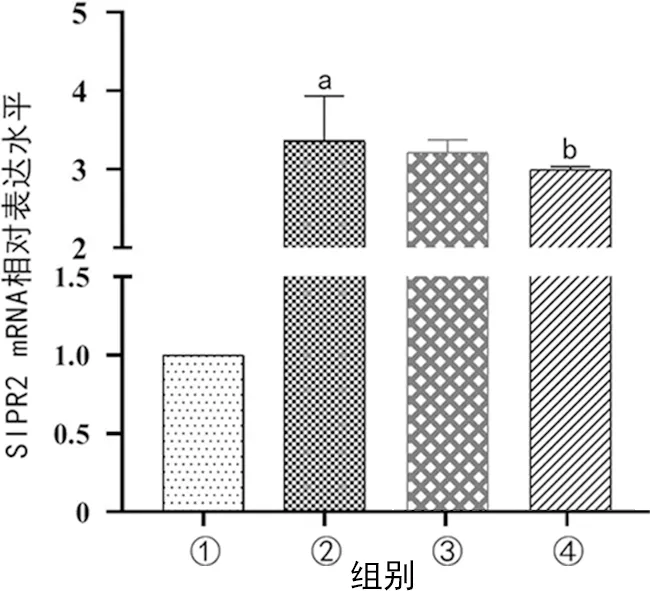
①:control组;②:LPS组;③:inhibitor NC+LPS组;④:LPS+miR-24-3p inhibitor组;a:P<0.05,与control组比较;b:P<0.05,与inhibitor NC+LPS组比较。
2.7 4组RMECs相关蛋白表达水平比较
与control组比较,LPS组的S1PR2、caspase-3、caspase-9蛋白表达水平上升,CDC20、VEGF蛋白表达水平下降,差异有统计学意义(P<0.05);与inhibitor NC+LPS组比较,miR-24-3p inhibitor+LPS组的S1PR2、caspase-9、caspase-3蛋白表达水平下降,CDC20、VEGF蛋白表达水平上升,差异有统计学意义(P<0.05),见图7。
3 讨 论
AKI是临床上常见的危重症。研究表明,肾脏微血管内皮细胞损伤与大部分肾脏疾病密切相关,是加重肾脏病进展的重要因素[16]。近年来,临床虽然对肾脏微血管内皮细胞损伤的具体因素及相关机制尚不清楚,而探寻上下游基因水平、调控机制对于治疗甚至干预AKI都有重要临床价值。
miRNA可以调节靶基因的表达,目前已有动物实验结果显示,某些miRNA可作为AKI早期诊断的标志物[17-18]。本研究结果表明miR-24-3p inhibitor通过联动抑制S1PR2的表达,进而下调caspase-3、caspase-9的表达水平,激活CDC20、VEGF的表达,降低细胞炎症细胞因子TNF-α与促进胞氧化应激损伤因子MDA的水平,保护细胞,减少LPS对细胞造成损伤。
脓毒症中大量LPS存在于循环血液,其可直接损伤内皮细胞或通过间接方式引起内皮细胞的激活和损伤[19]。有研究表明,LPS可以呈剂量依赖性引起RMECs的形态损伤,浓度为10 mg/L时即可使损伤标志物LPS明显增加[20],同时上调组织因子的合成及其在细胞表面的表达水平,促进凝血系统启动。本研究中,LPS所致的内皮细胞损伤在镜下表现为细胞器发生明显空泡性变性。
miR-24-3p inhibitor缓解LPS诱导RMECs凋亡的作用机制还有待于进一步研究,后续实验可围绕临床药物通过miR-24-3p介导靶向调控S1PR2分子轴来开展更深入的探索。

