内质网应激上调导致机械通气相关性膈肌功能障碍研究
张菊梅,吴松林,关发升,涂 锐,李学欣,刘 力
(西南医科大学附属医院麻醉科,四川泸州 646000)
机械通气(mechanical ventilation,MV)是一种挽救生命的干预措施,全球每年有超过1 500万患者在外科手术和危重疾病中使用机械通气来提供充足的肺通气[1-2]。然而,机械通气是一把“双刃剑”,长期的机械通气会导致膈肌纤维萎缩和收缩力下降,从而引起明显的膈肌功能障碍,称为机械通气相关性膈肌功能障碍(ventilation-induced diaphragmatic dysfunction,VIDD)。VIDD不仅对患者生存率和预后有明显的不良影响,也是临床上导致脱机困难的主要原因,会产生较大的医疗负担。超过50%的机械通气患者在气管插管24 h之内迅速出现VIDD,其发生率与通气时间延长、撤机困难、再插管率存在明显相关性[3-5]。目前,临床尚缺乏预防和治疗VIDD的相应措施,因此对VIDD机制的详细了解对临床防治膈肌功能障碍显得尤其重要。
内质网应激(endoplasmic reticulum stress,ERS)是指细胞受到内外因素(氧化应激、钙离子紊乱、缺氧、感染、营养物质缺乏等)的刺激时,内质网形态、功能的平衡状态受到破坏后发生分子生化的改变,蛋白质加工运输受阻,内质网内累积大量未折叠或错误折叠的蛋白质[6-7]。研究报道ERS在很多肌肉疾病中存在,其中ERS在脓毒症相关膈肌功能障碍中发挥了重要作用,脓毒症相关膈肌功能障碍和VIDD之间有许多共同致病机制,包括氧化应激、蛋白水解系统激活、线粒体功能障碍、细胞因子的大量激活等[8-11]。但ERS在VIDD是否上调,以及随通气时间延长膈肌功能障碍和ERS之间的关系尚缺乏报道。因此,本研究建立了大鼠不同通气时长的VIDD模型,探索ERS是否在大鼠VIDD中上调,以及随着通气时间延长ERS和膈肌功能障碍的关系。
1 材料与方法
1.1 实验动物
选择9~11周龄无特殊病原体(SPF)级雄性SD大鼠30只,平均体重(270±30)g,购自北京华阜康生物科技股份有限公司,动物生产许可证号:SCXK(京)2019-0008。大鼠饲养于无菌层流鼠笼内,温度(25±2)℃,相对湿度(50±5)%,白昼交替,大鼠可以自由进食水。动物实验遵循《实验动物管理与使用指南》,动物实验经西南医科大学动物实验中心伦理委员会批准[许可证号:SYXK(川)2018-065]。将30只大鼠按随机数字表法分为5组,分别为自主呼吸对照组(Con组)、机械通气6 h组(MV6 h组)、机械通气12 h组(MV12 h组)、机械通气18 h组(MV18 h组)、机械通气24 h组(MV24 h组),每组6只。
1.2 方法
1.2.1大鼠机械通气模型的建立
按照SMUDER等[12]的方法建立大鼠机械通气模型。具体步骤如下:腹腔注射60 mg/kg 的戊巴比妥钠进行基础麻醉。麻醉成功后,将大鼠置于温控加热毯上并固定。然后准备颈部皮肤(备皮、消毒),无菌操作解剖游离气管;行气管切开插管,接容量控制模式的小动物呼吸机(深圳市瑞沃德生命科技有限公司)。潮气量(VT)设定为8 mL/kg体重,呼气末正压(PEEP)设定为0 cmH2O,呼吸频率(RR)设定为70~75次/min。尾静脉行24GY型留置针(肝素预充)置管,以2 mL·kg-1·h-1的生理盐水和10 mg·kg-1·h-1的戊巴比妥钠持续泵入。在实验期间,通过使用加热毯将体温维持在 37 ℃;实验过程中,定时进行护理:翻身、按摩膀胱、吸痰等。
1.2.2功能学检测指标及方法
(1)复合肌肉动作电位(CMAP)检测:使用RM6240生物信息采集系统记录膈肌CMAP。将第一针作为接地电极插入大鼠尾巴近端皮下,下一针刺入对侧腹部作为参考电极,电极片贴于同侧肋骨下缘作为记录电极,最后两根针作为刺激电极,垂直插入锁骨同侧上方,距气管0.5 cm处。电极插入深度为1.0 cm,两针之间的距离为0.5 cm。所述近心端连接有红色刺激连接器,所述远心端连接有黑色刺激连接器,刺激方式采用单刺激,且为正电压刺激。刺激强度为12 V,波宽为1 ms,延迟为1 ms。刺激之间有30 s的间隔,连续重复3次刺激以获得平均响应。(2)疲劳指数:使用脉冲方波(强度15 V,波宽0.5 ms,延时20 ms)对肌肉进行50 Hz连续刺激2 min,以刺激2 min后的力比开始刺激的力,用该比值描述膈肌的疲劳指数。(3)频率-收缩曲线测量:将约3 mm宽、1 cm长的肋膈肌条置于Krebs-Hensleit溶液中,用95% O2、5% CO2气体平衡,并保持在37 ℃和pH 7.4。大鼠四肢肌肉用弹簧夹夹紧,并连接到电磁力传感器上,使用最大刺激电压(15 V)确定最佳收缩长度(Lo)。然后,以10、20、30、50、60、80、100、120 Hz连续刺激肌肉600 ms,每个刺激训练间隔1 min以确定频率收缩曲线关系,收缩力以生理横截面积归一化计算。
1.2.3膈肌组织病理学观察及膈肌纤维横截面积测定
膈肌组织用4%多聚甲醛固定24 h,经全自动脱水机梯度乙醇脱水,包埋、切片后进行染色。染色主要步骤:先将切片脱蜡至水,苏木素染色后使用盐酸乙醇分化,温水反蓝后置于85%的乙醇中5 min,用伊红染色,再次经梯度乙醇脱水后透明封固。光镜下观察膈肌组织的病理学改变,采用图像分析软件Motic Images Advanced测定膈肌纤维横截面积。
1.2.4膈肌组织中ERS标志物和膈肌萎缩指标基因检测
采用实时荧光定量逆转录PCR(RT-qPCR)检测膈肌组织中ERS标志物[C/EBP同源蛋白(CHOP)、葡萄糖调节蛋白78(GRP78)、葡萄糖调节蛋白94(GRP94)]和膈肌萎缩指标[肌肉特异性环指蛋白-1(MuRF-1)、肌肉萎缩F盒蛋白(Atrogin-1)]mRNA的表达。取适量大鼠膈肌组织,提取组织总RNA,逆转录成cDNA。按照试剂盒说明书进行实验,配制PCR反应液,总体系为25 μL,PCR反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。引物序列见表1。

表1 膈肌萎缩指标及ERS标志物基因引物序列(5′-3′)
1.2.5膈肌组织中ERS标志物和膈肌萎缩指标蛋白检测
采用Western blot检测ERS标志物(CHOP、GRP78和GRP94)和膈肌萎缩指标(MuRF-1和Atrogin-1)水平。取大鼠膈肌组织,常规提取蛋白,测定蛋白质含量、调整蛋白质浓度后,上样、十二烷基硫酸钠-聚丙烯酸胺凝胶电泳(SDS-PAGE)、转膜、封闭,加入稀释后的CHOP(1∶1 000)、GRP78(1∶1 000)、GRP94(1∶1 000)、MuRF-1(1∶1 000)、Atrogin-1(1∶1 000)一抗 4 ℃过夜。TBST洗涤,加入辣根过氧化物酶(HRP)标记的二抗(1∶5 000),室温孵育60 min。滴加电化学发光(ECL)试剂,于暗室中曝光、显影。使用Image J软件分析,以3-磷酸甘油醛脱氢酶(GAPDH)作为内参,以目的条带灰度值与GAPDH条带灰度值的比值作为目的蛋白相对表达水平。
1.3 统计学处理

2 结 果
2.1 膈肌功能学指标
2.1.1各组大鼠的CMAP比较
各组CMAP幅值分别为Con组(11.43±1.81)mV、MV6 h组(8.45±0.86)mV、MV12 h组(6.92±0.49)mV、MV18 h组(4.24±0.70)mV、MV24 h组(2.41±0.77)mV;各机械通气组与Con组相比,差异均有统计学意义(P<0.05),且随着通气时间延长,CMAP幅值逐渐减小,见图1A。各组CMAP时程分别为Con组(3.27±0.60)ms、MV6 h组(3.56±0.56)ms、MV12 h组(4.68±0.48)ms、MV18 h组(5.12±0.72)ms、MV24 h组(6.35±0.83)ms;MV12 h组、MV18 h组、MV24 h组与Con组相比,差异均有统计学意义(P<0.05),见图1B。CMAP的代表图,见图1C。
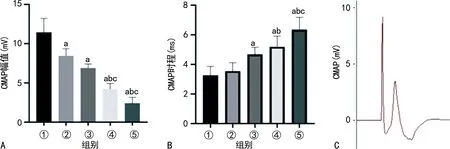
A:各组大鼠CMAP幅值比较柱状图;B:各组大鼠CMAP时程比较柱状图;C:CMAP的代表图;①:Con组;②:MV6 h组;③:MV12 h组;④:MV18 h组;⑤:MV24 h组;a:P<0.05,与Con组比较;b:P<0.05,与MV6 h组比较;c:P<0.05,与MV12 h组比较。
2.1.2大鼠膈肌的疲劳指数比较
各组的疲劳指数分别为Con组(38.68±1.53)%、MV6 h组(32.23±1.36)%、MV12 h组(25.84±1.25)%、MV18 h组(22.31±1.21)%、MV24 h组(20.47±0.88)%;各机械通气组与Con组相比,差异均有统计学意义(P<0.05),且随着通气时间的延长膈肌疲劳指数越来越小,见图2A。疲劳指数的代表图,见图2B。

A:各组大鼠疲劳指数比较柱状图;B:疲劳指数的代表图;①:Con组;②:MV6 h组;③:MV12 h组;④:MV18 h组;⑤:MV24 h组;a:P<0.05,与Con组比较;b:P<0.05,与MV6 h组比较;c:P<0.05,与MV12 h组比较。
2.1.3大鼠膈肌频率-收缩曲线比较
总体上随着刺激频率增加,各组大鼠单位平方厘米的膈肌收缩力增加。在同一刺激频率下,与Con组相比,MV18 h组和MV24 h组的收缩力明显减小(P<0.05),见图3。
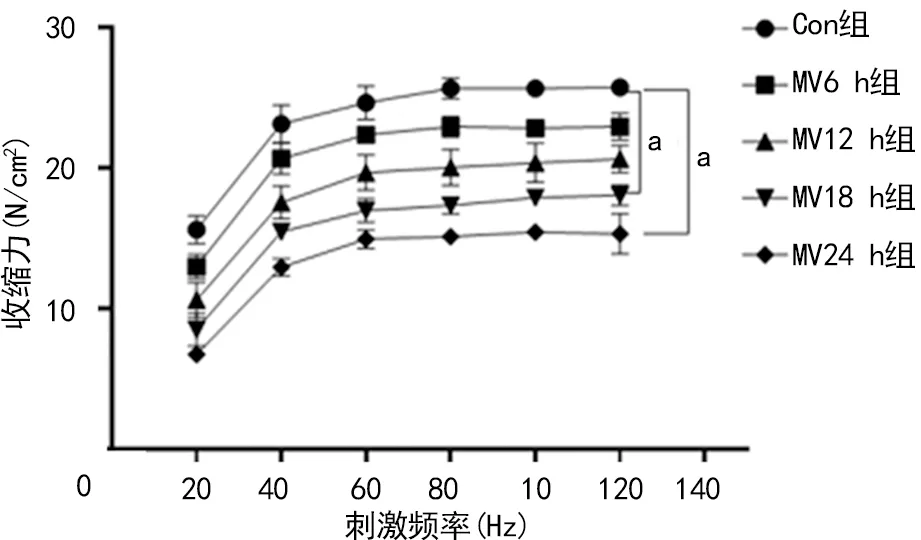
a:P<0.05,与Con组比较。
2.2 膈肌HE染色
光镜下可见,Con组大鼠膈肌组织肌束结构清晰、边界分明,肌纤维排列较为紧密,细胞核呈扁圆形或椭圆形,位于细胞周缘,细胞质染色较为均匀,未见明显肌纤维萎缩;机械通气组,随着通气时间的延长,肌束结构不清晰,细胞间隔略有增宽,肌纤维小簇性萎缩,萎缩程度轻重不一,MV24 h组萎缩最为严重,见图4。各组的膈肌纤维横截面积分别为Con组(6 161.34±345.32)μm2、MV6 h组(4 684.45±329.10)μm2、MV12 h组(3 404.56±412.28)μm2、MV18 h组(2 492.54±245.72)μm2、MV24 h组(2 147.00±189.12)μm2,与Con组相比,各机械通气组膈肌纤维横截面积均明显降低(P<0.05),且随着通气时间延长,膈肌萎缩加重,横截面积减小,见图5。

①:Con组;②:MV6 h组;③:MV12 h组;④:MV18 h组;⑤:MV24 h组;a:P<0.05,与Con组比较;b:P<0.05,与MV6 h组比较;c:P<0.05,与MV12 h组比较。
2.3 膈肌萎缩蛋白MuRF-1、Atrogin-1 mRNA及蛋白表达水平
与Con组相比,MV12 h组、MV18 h组、MV24 h组大鼠膈肌MuRF-1 mRNA相对表达水平均明显升高(P<0.05),且随着通气时间延长,MuRF-1 mRNA相对表达水平逐渐升高,见图6A。与Con组相比,各机械通气组大鼠膈肌Atrogin-1 mRNA相对表达水平均明显升高(P<0.05),且MV24 h组最高,见图6B。与Con组相比,各机械通气组大鼠膈肌MuRF-1、Atrogin-1相对表达水平均明显升高(P<0.05),且随着机械通气时间延长,MuRF-1、Atrogin-1相对表达水平逐渐升高,见图6C~E。
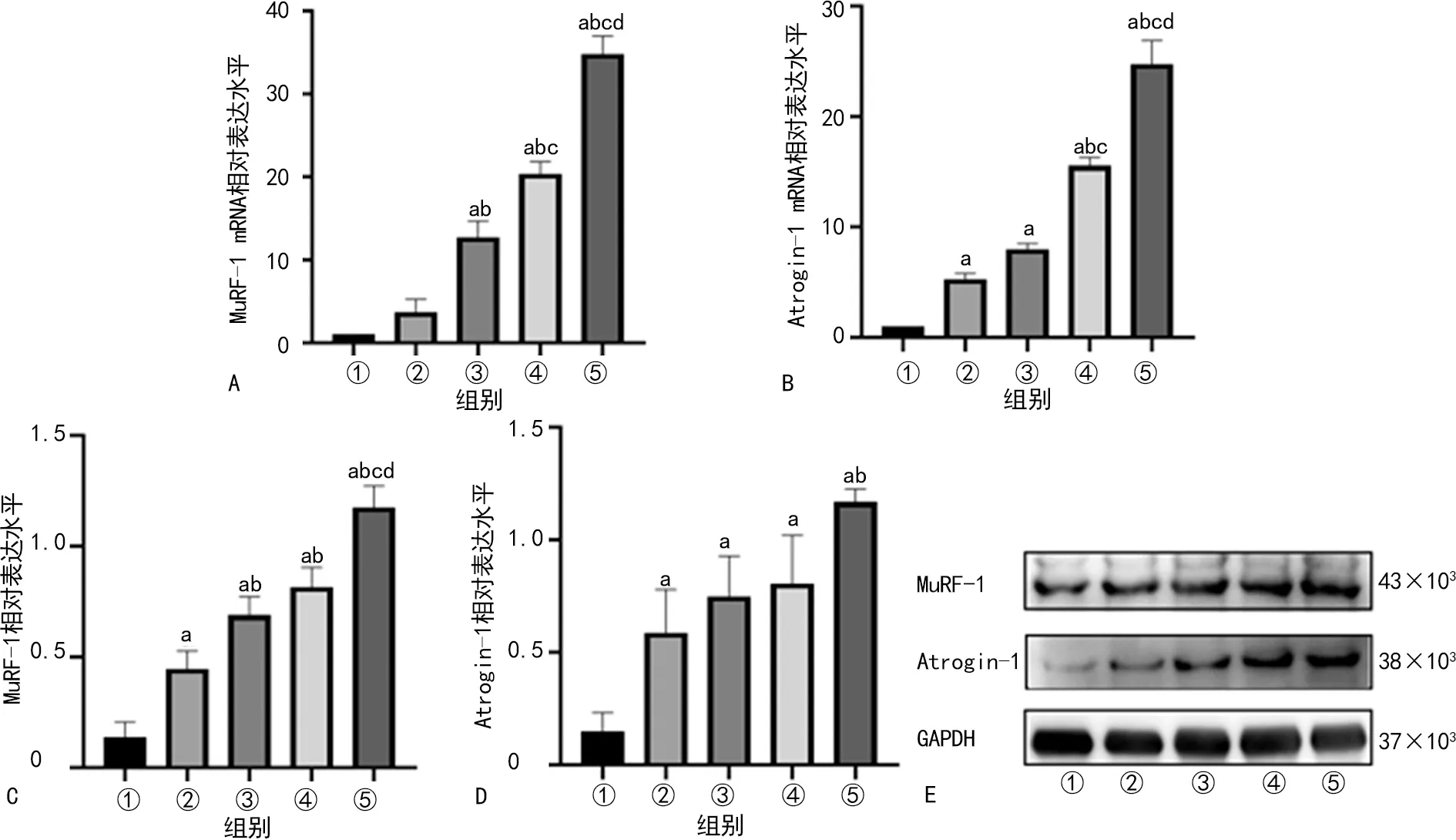
A:各组大鼠膈肌MuRF-1 mRNA相对表达水平比较柱状图;B:各组大鼠膈肌Atrogin-1 mRNA相对表达水平比较柱状图;C:各组大鼠膈肌MuRF-1相对表达水平比较柱状图;D:各组大鼠膈肌Atrogin-1相对表达水平比较柱状图;E各组大鼠膈肌MuRF-1和Atrogin-1电泳图;①:Con组;②:MV6 h组;③:MV12 h组;④:MV18 h组;⑤:MV24 h组;a:P<0.05,与Con组比较;b:P<0.05,与MV6 h组比较;c:P<0.05,与MV12 h组比较;d:P<0.05,与MV18 h组比较。
2.4 膈肌ERS标志物CHOP、GRP78、GRP94 mRNA及蛋白表达水平
与Con组相比,各机械通气组大鼠膈肌CHOP、GRP78、GRP94 mRNA相对表达水平均明显升高(P<0.05),且总体随着通气时间延长,各ERS标志物mRNA相对表达水平逐渐升高,见图7A~C。与Con组相比,MV12 h组、MV18 h组、MV24 h组大鼠膈肌CHOP、GRP78、GRP94相对表达水平均明显升高(P<0.05),且随着通气时间延长,各ERS标志物相对表达水平升高,MV24 h组最高,见图7D~G。
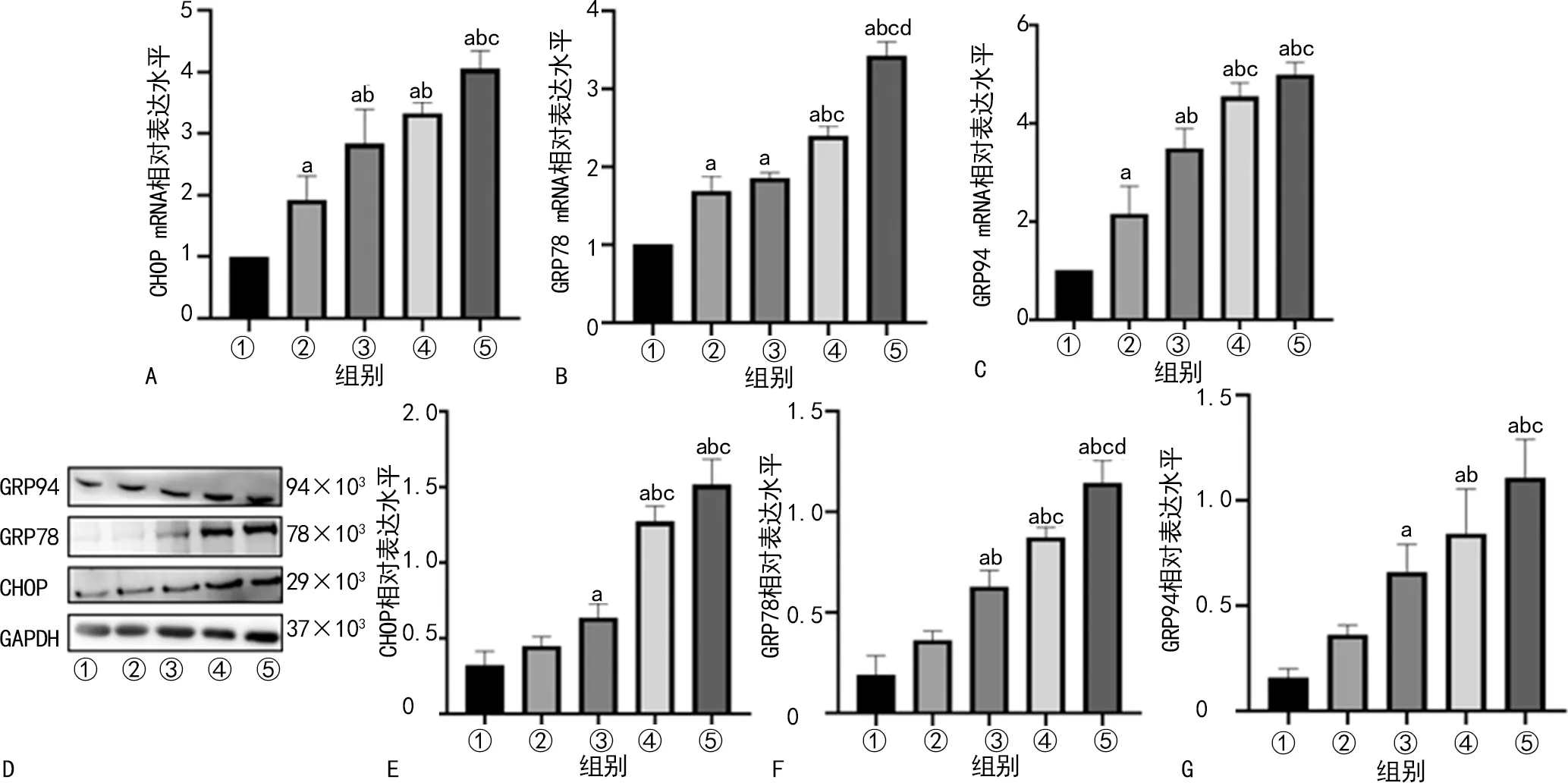
A:各组大鼠膈肌CHOP mRNA相对表达水平比较柱状图;B:各组大鼠膈肌GRP78 mRNA相对表达水平比较柱状图;C:各组大鼠膈肌GRP94 mRNA相对表达水平比较柱状图;D:各组大鼠膈肌CHOP、GRP78、GRP94电泳图;E:各组大鼠膈肌CHOP相对表达水平比较柱状图;F:各组大鼠膈肌GRP78相对表达水平比较柱状图;G:各组大鼠膈肌GRP94相对表达水平比较柱状图;①:Con组;②:MV6 h组;③:MV12 h组;④:MV18 h组;⑤:MV24 h组;a:P<0.05,与Con组比较;b:P<0.05,与MV6 h组比较;c:P<0.05,与MV12 h组比较;d:P<0.05,与MV18 h组比较。
3 讨 论
膈肌作为人体最主要的呼吸肌,正常呼吸过程中有75%~80%的呼吸功是靠膈肌完成,长时间的机械通气,膈肌处于废用状态,会导致膈肌萎缩和收缩力下降,称为VIDD[13-14]。当细胞存在缺氧、氧化应激、感染等情况,内质网形态、功能受到破坏,导致蛋白质加工运输受阻,表现为未折叠或错误折叠的蛋白质在内质网上累积,从而激活ERS感受器,触发下游凋亡通路[15-16]。本研究表明在机械通气的膈肌中会激活ERS,且随着通气时间延长,ERS程度加重,膈肌功能障碍加重。
在本研究中,与Con组相比,机械通气组随着通气时间延长,膈肌肌力逐渐减低,膈肌的抗疲劳性下降,CMAP的幅值减小,时程延长。膈肌功能障碍的程度随着机械通气时间的延长而逐渐加重,与临床上的机械通气患者类似,越长时间使用呼吸机的患者越难撤机,自主呼吸功能恢复也越缓慢[17]。随着通气时间延长,大鼠膈肌肌束结构不清晰,细胞间隔略有增宽,肌纤维小簇性萎缩,萎缩程度轻重不一,在MV24 h组膈肌萎缩最为严重,膈肌纤维横截面积最小;膈肌萎缩蛋白MuRF-1和Atrogin-1的表达也随着机械通气时间的延长逐渐升高。在机械通气的膈肌中,蛋白质分解加速,合成减少,随着通气时间延长,萎缩也越明显,包括膈肌纤维横截面积的减小和萎缩蛋白MuRF-1和Atrogin-1表达的增多。
ERS标志物CHOP、GRP78、GRP94在机械通气大鼠膈肌中的表达也随通气时间延长而升高。越来越多的证据表明,ERS在肌肉功能障碍的发病机制中起作用,内质网作为细胞中蛋白质的加工厂和钙离子的储存器,在肌肉收缩活动中有必不可少的作用[18-19]。在VIDD中,氧化应激、钙离子紊乱、线粒体功能障碍等均可激活ERS,从而引起ERS相关蛋白表达增加。内质网上有3个跨膜传感器:蛋白激酶r样内质网激酶(PERK)、肌醇-需要蛋白1(IRE1)和激活转录因子6(ATF6),生理情况下与GRP78结合处于失活状态,当发生ERS时,GRP78与传感器解离,传感器被激活,启动未折叠蛋白反应,缓解内质网的压力[20-21]。未折叠蛋白的积累过程中,内质网伴侣蛋白,包括GRP78和GRP94上调,GRP78和GRP94结合到错误折叠的多肽链上,以防止形成聚集物,并协助其正确折叠[22-23]。在发生ERS,内质网功能严重受损时,细胞会通过上调CHOP引发凋亡信号,CHOP在ERS介导的凋亡中起着至关重要的作用,CHOP作为转录因子,能够调节多种抗凋亡和促凋亡基因的表达,如 BCL-2家族蛋白,也可直接或间接影响caspase家族的活性[24-25]。随着通气时间的延长,上调的ERS可能通过介导细胞凋亡,影响钙离子稳态等加速膈肌功能障碍。
综上所述,长时间机械通气会导致膈肌功能障碍,膈肌纤维萎缩,在机械通气大鼠的膈肌中激活ERS,而上调的ERS可进一步引起膈肌功能障碍,抑制ERS可能是未来防治VIDD的一个重要靶点。

