三江源高寒草甸土壤化学计量特征及酶活性对不同退化程度的响应
郭龙欣, 杨永胜, 张秀娟, 王军邦, 张宇恒
(1. 长江大学 园艺园林学院,湖北 荆州 434025; 2. 中国科学院 西北高原生物研究所 高原生物适应与进化重点实验室,青海 西宁 810008;3. 青海三江源草地生态系统国家野外科学观测研究站,青海 西宁 810008; 4. 中国科学院 地理科学与资源研究所生态系统网络观测与模拟重点实验室,北京 100101; 5. 荆门市规划勘测设计研究院,湖北 荆门 448000)
0 引言
化学计量学是近年来生态学研究的热点之一,主要是研究多种化学元素的质量平衡和对生态系统的交互作用[1],土壤中碳(C)、氮(N)、磷(P)、钾(K)等化学计量特征值的相互作用及与外界环境的关系。化学计量特征影响植物生长发育过程,能够有效反映土壤的肥力状况。土壤碳氮比(C/N)值过低,表明土壤有机质矿化速率较高,土壤肥力水平低,若土壤碳磷比(C/P)比值过低,则表明相应土壤P 的有效性高[2]。土壤肥力退化不仅反映在C、N、P、K 等化学计量特征值的变化上,还与土壤酶活性变化密切相关,土壤酶作为土壤组分中最活跃的一种有机成分[3],在草地生态系统代谢过程中起重要作用,参与土壤生态系统物质循环和能量流动,其活性大小对土壤肥力变化具有明显指示作用,是生态系统养分循环的重要因素[4]。研究表明高寒草甸土壤酶活性主要受到植物特征如凋落物量、根系纤维素含量和根系木质素含量影响[5],草甸退化过程中土壤肥力退化,影响植物特征进而对土壤酶活性产生一定影响。
土壤水解酶能够将大分子有机化合物分解为小分子化合物,供土壤微生物利用和植物吸收[6],其能够快速响应植物和土壤的变化,对理解土壤-植物之间的相互关系起重要作用[7]。其中,β-纤维二糖苷酶(BCE)、β-葡萄糖苷酶(BG)、β-N-乙酰氨基葡萄糖苷酶(NAG)及β-1,4-木糖苷酶(BX)分别属于土壤水解酶中的纤维素酶、几丁质酶、木聚糖酶,是参与土壤中碳水化合物纤维素及植物残体半纤维素水解的重要酶,参与土壤及植物的C、N 循环过程;酸性磷酸酶(AP)能水解土壤中有机P 化合物并生成能直接被植物吸收利用的无机P,参与土壤P循环[8]。因上述水解酶在土壤C、N、P循环中的重要作用,受到越来越多学者的关注[9]。
目前,国内外学者对高寒草地退化过程中土壤理化性质和生物特征开展了一系列研究。许世洋等[10]在甘肃省甘南藏族自治州高寒草甸的研究中发现随着退化程度的加剧,物种多样性、土壤酶活性和土壤TN、TP、TK 等均呈降低趋势,土壤pH 值、全盐、容重、黏粒、真菌数量等呈上升趋势。在若尔盖湿地开展的研究认为土壤含水量、SOC 和TN 含量会随着退化程度的加剧而降低,低土壤含水量导致植物C 潜在输入量下降是造成土壤SOC 含量降低的主要原因[11]。土壤退化不仅改变土壤物理性质,还会间接改变土壤化学性质[12]。植被生产力和土壤C、N 的降低具有明显的正反馈效应,土壤质地、养分和水分等的复杂变化及其相互关系共同决定群落物种多样性和生产力[13]。可以看出,相关研究多集中在土壤理化性质、植物群落结构和生产力对高寒草甸退化过程的响应过程上,对于高寒草甸退化过程中土壤化学计量特征与酶活性相关性的系统研究相对薄弱。鉴于土壤化学计量特征与酶活性在高寒草甸土壤生态系统养分循环和能量流动中的重要作用[7,9],亟需开展相关研究。
近30年来,在全球气候剧烈变化和人类活动过度等多种因素的综合影响下,作为青藏高原水源涵养的主体基质之一的高寒草甸区域发生了严重退化,其中约16%严重退化为次生裸地“黑土滩”[14],这不仅导致物种多样性减少、水源涵养能力降低、毒杂草增多、土壤沙化等诸多生态问题[15],也严重影响了当地牧民的生产生活和经济的可持续发展。研究三江源高寒草甸土壤化学计量特征及酶活性对不同退化程度的响应特征,对深入理解高寒草甸退化的关键过程及机制具有重要的理论价值。为此,本研究以青海省果洛藏族自治州达日县高寒草甸为研究对象,采用野外采样与室内分析相结合的方法,分析三江源高寒草甸退化过程中土壤C、N、P、K 含量,pH 值,土壤化学计量比,酶活性的变化特征,深入研究土壤化学计量特征变化及与酶活性的相互作用关系。本研究拟回答以下问题:(1)不同退化程度高寒草甸土壤化学计量特征和酶活性是如何变化的。 (2)退化高寒草甸中土壤化学计量特征与土壤酶活性是否存在联系;若存在联系,哪些特征值是影响酶活性的主要因子。同时,从中得到影响高寒草甸退化过程的关键因素,进而为退化高寒草甸的可持续恢复提供一定的理论依据。
1 材料与方法
1.1 研究区概况
研究区位于青海省果洛藏族自治州达日县(33°54′48″ N,100°25′17″ E),海拔4 005~4 150 m,属于高寒半湿润气候,没有明显的四季之分,只有冷暖两季,冷季风雪大,气候寒冷,持续时间长,有7~8 个月,多有风雪灾害;暖季气候湿润,持续时间4~5 个月[16]。最高气温23.2 ℃,最低气温-34 ℃,年平均气温-0.5 ℃,昼夜温差为15~25 ℃,年均降水量595 mm,年均蒸发量1 205.9 mm,全年无绝对无霜期。土壤为高山草甸土、高山灌丛草甸土和沼泽土。草地类型为不同退化程度的高寒草甸,草甸植被的优势种分别为针茅(Stipa capillata)、小嵩草(Kobresia humilis)、矮嵩草(Kobresia humilis)、肉果草(Lancea tibetica)、密花香薷(Elsholtzia densa)、黄帚橐吾(Ligularia virgaurea)、细叶亚菊(Ajania tenuifolia)等(表1)。

表1 样地基本概况Table 1 Environmental conditions of the sampling plots
1.2 土壤取样方法
参照赵新全等[17]对草地退化等级划分标准,设置原生植被(ND)、轻度退化(LD)、中度退化(MD)重度退化(SD)4 种不同程度退化草地处理,在每个处理中随机选取面积为50 cm×50 cm 的样方进行土壤取样,各重复5次。本实验于2021年8月,以直径7 cm 的土钻分层(0~5 cm、5~10 cm、10~20 cm),每个土层采集3钻样品合为一个土样,用2 mm 筛子过滤植物根系等杂质,将过滤后的土样分别再过1 mm和0.25 mm 筛,用自封袋封存冷藏带回实验室,以测定土壤各项化学指标和土壤酶活性。
1.3 土壤样品分析
1.3.1 土壤化学性质测定
土壤pH 值按照水土比(1/2.5)加入离子水后使用pH 酸度计进行测定[18];土壤SOC 采用重铬酸钾外加热法测定;土壤TC 采用元素分析仪测定;土壤TN 采用半微量凯氏定氮法测定;土壤TP 和TK 分别采用分光光度计和火焰光度计测定,具体操作方法参考鲍士旦[19]的土壤分析测定方法。
1.3.2 土壤酶活性测定
土壤BX、NAG、AP、BCE、BG 活性主要使用荧光法进行测定[20]。具体操作如下: 提前12 h取出保存在约-20 ℃下的原始土壤样品置于4 ℃条件下解冻备用,用无菌去离子水和微量天平在125 mL琥珀色玻璃瓶中制备基质和荧光标准溶液备用,称取1~2 g 土壤样品,记录质量后将其放入标有500 mL标签的容器中,加入125 mL醋酸盐缓冲液(50 nmol,pH 为8.3),以JK-DMS-ProN 磁力搅拌器搅拌机最高速度搅拌1 min,制成浆液即粗酶液。设置粗酶液对照组、缓冲液对照组和样品测量组。粗酶液对照组:200 μL 粗酶液+50 μL 醋酸钠缓冲液,200 μL 粗酶液+50 μL MUB 缓冲溶液;缓冲液对照组:250 μL醋酸钠缓冲液,200 μL 醋酸钠缓冲液+50 μL MUB缓冲溶液,200 μL+50 μL 底物;样品测量组:200 μL粗酶液+50 μL 底物,各土壤酶底物见表2,在室温下培养荧光板和氧化酶板,培养时间根据酶的不同有所差异。培养结束后,在荧光板中依次添加10 μL NaOH(1 mol·L-1)以终止反应,在365 nm激发和450 nm 发射下读取荧光板,表达单位为μmol·h-1·g-1。

表2 土壤酶活性测定底物Table 2 Substrate for determination of soil enzyme activity
1.4 数据分析
采用Excel 对数据进行统计分析,通过SPSS 26.0 统计分析软件对各样地土壤养分、化学计量比及酶活性进行单因素方差分析(One-way ANOVE)和多重比较(LSD 法,P=0.05),分析比较土壤各化学计量特征之间和酶活性之间差异显著性。使用Origin2021 插件Correlation Plot 进行皮尔逊相关性分析(Pearson correlation analysis)作图。C/N,C/P,C/K,N/P,N/K,P/K 均采用质量比,与C 相关的比值均采用SOC数据。
2 结果与分析
2.1 草甸退化对土壤养分含量及pH值的影响
退化程度对高寒草甸土壤化学性质的影响因其指标不同而异(图1)。其中,土壤SOC、TN 及TC[图1(a)、1(b)、1(f)]随着退化程度的加剧呈下降趋势,且随着土壤深度的增加,退化程度对三者的影响逐步减弱。与原生植被样地0~5 cm 土壤SOC、TN 及TC 含量相比,重度退化样地分别显著下降58.35%、62.88%、58.32%,与原生植被样地10~20 cm土壤SOC、TN 及TC 含量相比,重度退化样地分别显著下降49.29%、43.63%、49.33%。不同土层土壤TP 含量随退化程度的加剧呈先增加后降低趋势[图1(c)],轻度退化样地0~5、5~10、10~20 cm 土壤全磷含量分别较原生植被样地高18.32%、50.92%、107.08%,重度退化样地0~5、5~10、10~20 cm 土壤TP 含量分别较轻度退化样地下降22.52%、15.97%、25.96%。土壤TK 随退化程度的加剧呈增加趋势[图1(d)],重度退化样地0~5 cm、5~10 cm、10~20 cm 土壤TK 含量分别较原生植被样地显著增加62.63%、42.24%、49.12%。随退化程度加剧,高寒草甸0~5 cm、5~10 cm 土壤pH 值呈波动上升趋势,10~20 cm土壤pH值无明显变化规律[图1(e)]。
2.2 草甸退化对土壤化学计量比的影响
除C/N 随退化程度呈相对稳定的趋势外,其余土壤C、N、P、K 化学计量比随着退化程度的加剧基本呈降低趋势,且降低趋势随着深度的增加逐渐减小(图2)。其中与原生植被样地0~5 cm C/K、C/P、P/K、N/K、N/P 相比,重度退化样地分别显著下降73.28%、54.66%、42.86%、75.58%、59.25%,与原生植被样地10~20 cm C/K、C/P、P/K、N/K、N/P 相比,重度退化样地分别下降75.68%、60.49%、15.42%、31.95%、21.13%,除P/K 外,差异均达到显著水平(P<0.05)。高寒草甸0~5 cm、5~10 cm C/N随退化程度的加剧无明显变化,二者分别稳定在19.03、21.02 上下,10~20 cm SOC/N 随退化程度的加剧呈先下降后稳定的趋势,与原生植被样地10~20 cm C/N 相比,轻度退化样地显著降低32.59%,轻度退化至重度退化样地10~20 cm C/N 无显著变化,基本稳定在18.41 cm上下。

图2 高寒草甸不同退化程度土壤化学计量比变化:土壤有机碳/全氮(a);土壤有机碳/全钾(b);土壤有机碳/全磷(c);土壤全磷/全钾(d);土壤全氮/全钾(e);土壤全氮/全磷(f)Fig. 2 Changes of soil stoichiometric ratio at different degradation stages in an alpine meadow:C/N (a); C/K (b); C/P (c); P/K (d); N/K (e); N/P (f)
2.3 草甸退化对土壤酶活性的影响
随着退化程度的加剧,高寒草甸不同深度土壤BX、NAG、AP、BCE、BG 活性均呈先增加后降低趋势,在轻度退化阶段达到最高值(图3)。同时,也可以看到无论高寒草甸发生退化与否,上述五种酶活性随着深度的增加均呈降低趋势。其中,轻度退化样地0~5 cm 土壤BX、NAG、AP、BCE、BG 活性分别较原生植被样地显著增加168.43%、167.13%、75.76%、1 308.48%、197.23%,重度退化样地0~5cm 土壤BX、NAG、AP、BCE、BG分别较轻度退化样地显著下降85.72%、92.53%、75.87%、92.93%、76.71%。

图3 高寒草甸不同退化程度土壤酶活性变化:β-1,4-木糖苷酶BX(a);β-纤维二糖苷酶BCE(b);β-葡萄糖苷酶BG(c);酸性磷酸酶AP(d);β-N-乙酰氨基葡萄糖苷酶NAG(e)Fig. 3 Changes of soil enzyme activities in different degraded levels of alpine meadow: β-xylosidase (a);β-fibrodiglycosidase (b); β-D-Glucosidase (c); acid phosphatase (d); β-N-acetylglucosaminidase (e)
2.4 土壤化学计量特征与酶活性相关性分析
土壤化学计量特征与酶活性相关系数矩阵如图4 所示。结果表明土壤SOC 含量与土壤TN 含量、C/P、C/K、N/P、N/K 呈显著正相关,其中,与TN的相关系数为0.90。同时,土壤SOC 含量与土壤TP含量、P/K呈正相关,与pH值呈负相关。土壤TN与TP、C/K、N/P、N/K、P/K呈显著正相关,与土壤TK呈负相关,与BX、AP、BG 三种酶呈正相关关系。土壤TK 含量与C/K、N/P 呈显著负相关。P/K 与BX、NAG、AP、BCE、BG 五种酶活性呈显著的正相关关系。
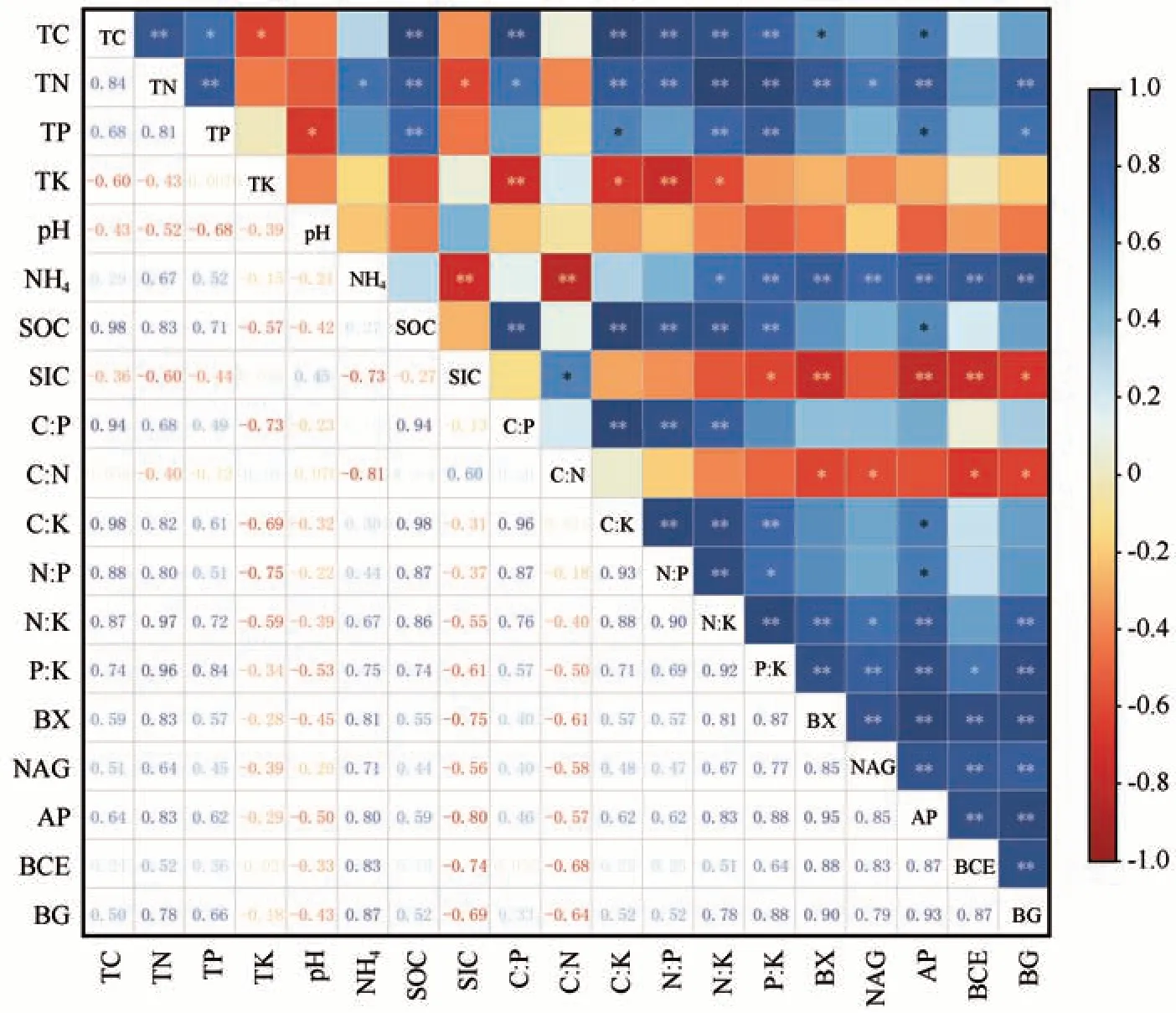
图4 土壤C、N、P、K化学计量特征与酶活性关系的相关关系矩阵(*P<0.05, **P<0.01)Fig. 4 Correlation matrix of the relationship between soil C, N, P and K stoichiometric characteristics and enzyme activities (*P<0.05, **P<0.01)
进一步对土壤化学计量特征进行Monte-Carlo检验,得到土壤化学计量特征的解释量与显著性检验结果(表3),发现土壤化学计量特征值P/K、N/K、TP 对酶活性影响较大,其中P/K 对酶活性的影响达到极显著水平(P=0.002<0.01),N/K、TP、C/P 对酶活性影响达到显著水平(P<0.05)。P/K、N/K、TP 化学计量特征所占解释量分别为65.6%、13.4%、6.3%,是影响酶活性的主要因子,土壤pH 值、N/P、TK、SOC、TN、C/K、C/N 的影响均未达到显著水平(P>0.05)。
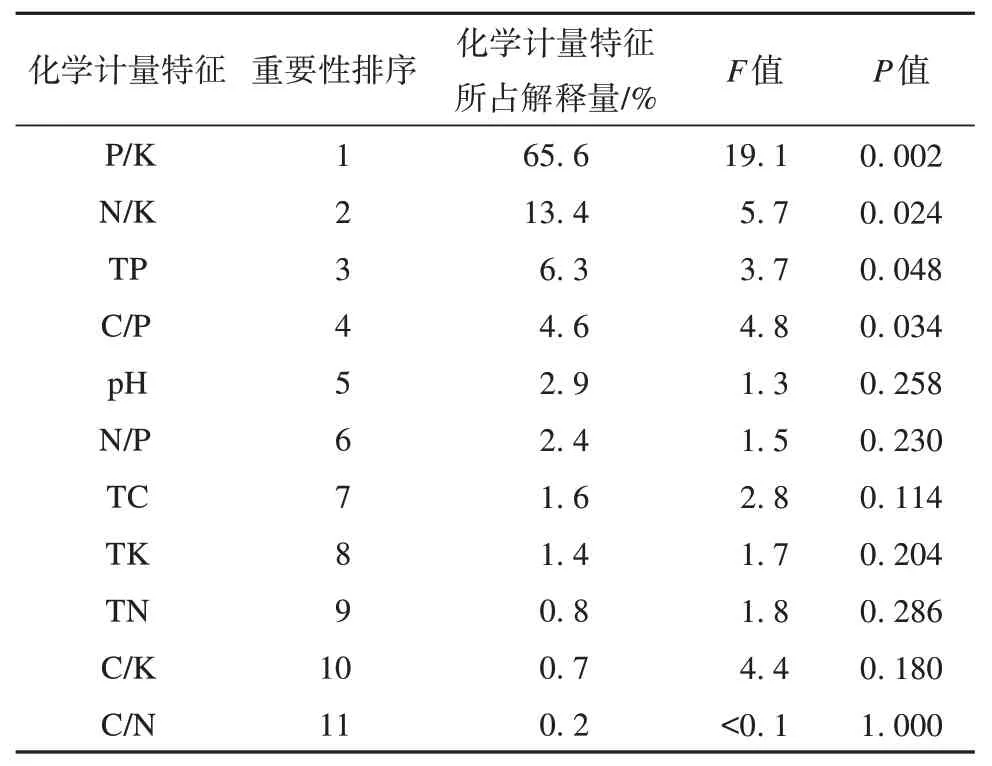
表3 土壤化学计量特征解释量与显著性检验Table 3 Interpretive quantity and significance test of soil stoichiometric characteristics
3 讨论
3.1 土壤化学计量特征对不同退化程度的响应规律
土壤C、N、P、K 化学计量及其计量比是反映土壤有机质组成和质量程度的重要指标[21],对草地植被的生长发育和演替具有重要影响。本研究表明,随着退化程度的加剧和土层的加深,土壤SOC、TC及TN 含量呈下降趋势,这一结果与伍星等[22]的研究结果一致,这可能是因为:(1)由于草地退化导致植被盖度降低,土壤含水量下降,降低了土壤微生物活性,限制了土壤养分的转化速率[23],最终降低了土壤中C、N 的积累量;(2)随退化程度的加剧,导致草地退化的主要原因由放牧、气候变化等外因转化为土壤养分失衡的内因[24],进而降低草地C 素和N 素的积累速率,影响草地的C、N 含量;(3)高寒草甸的退化过程加剧了土壤呼吸作用[25],加速了土壤SOC 和N 素含量的流失[26]。(4)随着深度的增加,高寒草甸地下生物量明显减少[26],限制了土壤中的有机质积累,降低了深层土C、N 含量。土壤TP 含量随着退化程度的加剧呈先增加后降低的趋势,在轻度退化阶段达到最高值,pH值随退化程度加剧变化无明显规律,这与李雪萍等[27]的结果一致,这是由于草地退化导致微生物活性降低,对土壤中的有机P 矿化作用减弱,植物对P 的吸收减少,在轻度退化阶段增加了P的积累量[13]。随退化程度的进一步加剧,土壤肥力逐渐降低,P 含量也逐渐下降。pH 值的变化可能是由于不同退化阶段的采样地点相隔较远,植被类型和土壤母质存在一定的差异。土壤中TK 含量表现为重度退化显著高于其他退化程度,这是由于土壤TK 含量受风化因素影响较大,草地退化后加速了土壤的风化,使得土壤中的K 得到更多的释放[28]。同时,由于退化导致植被覆盖度降低,土壤中植物对K 的需求量减少,所以重度退化草地土壤中TK 含量高于原生植被、轻度退化和中度退化草地[10]。土壤C/N 整体呈较为稳定的状态,这与林丽等[29]的研究结果一致,但罗亚勇等[30]等的研究表明高寒草甸C/N 随退化程度加剧呈下降趋势,出现这种差异的原因可能与所选样地的土壤肥力有关,C/N 是土壤肥力的表征,数值越大,土壤肥力越强。本研究所选的高寒草甸样地具有较好的肥力条件,C/N 变化不明显。土壤C/P、C/K、N/K、N/P 随退化程度和土层的加深而降低,这与罗亚勇等[30]的研究结果一致,较低的C/P 是磷有效性高的一个指标[3],不同土层中度退化和重度退化的C/P比值均低于全球生态系统土壤的平均水平C/P(186)[31],表明在中度和重度退化土壤中有效P含量较高,结合该退化程度下土壤P含量变化较为稳定,这可能是由于退化过程增加高寒草甸浅层土壤pH值,导致土壤中的铁和铝等对P 的固定和沉降作用减弱,使得土壤中的有效P 含量处于一个较高的状态[32]。
3.2 土壤酶活性对不同退化程度的响应规律
土壤酶的催化作用对土壤中C、N和P等元素的循环与迁移有着重要作用,酶活性在一定程度上能够用来作为表征土壤生产力和土壤肥力质量的指标。其中,水解酶对于土壤生态系统中的C 和N 循环具有重要作用[6]。本研究发现随着退化程度的加剧,高寒草甸五种水解酶均呈现先增加后降低趋势,轻度退化样地土壤水解酶活性均呈现出较高水平。这与谈嫣蓉等[33]、蔡晓布等[34]的研究结果一致。这可能是由于三江源地区寒冷的气候条件对土壤微生物的活动和数量产生了影响,原生植被阶段植被浓密且盖度较高,造成表层土壤接收到的太阳辐射相对较低,土壤微生物的种类和数量较少,导致土壤水解酶活性相对较低[26]。至轻度退化阶段,植被盖度降低,促使地表接收到更多的太阳辐射,表层土壤温度增加,地上总生物量达到最高[35],明显提高了土壤水解酶活性。由轻度退化至重度退化阶段,尽管植被盖度进一步减少,有利于表层土壤温度的提高。然而,由于地上生物量和土壤养分,特别是速效养分的急剧减少[36],导致土壤酶活性没有进一步提高,反而快速降低。AP活性与土壤中P 含量具有密切关系,在缺P 胁迫条件下,植物根系会诱导分泌AP 使土壤中的有机P 矿化为无机磷供植物吸收利用,P 的消耗会提高土壤中AP 的活性[37]。本研究中轻度退化草地AP 活性显著高于原生植被,这与蒋永梅等[38]的研究结果一致,主要是由于该地区原生植被土壤条件较好,养分足够供给植物生长,不需要大量的AP 分解有机P,造成AP 活性相对较低[28]。本研究中五种酶活性在不同土层退化草地随土壤深度的增加而递减,这与秦嘉海等[39]的研究结果一致,这主要是因为表层土壤与空气接触面积更大且较为松软,所以微生物较为活跃,随着土层的加深,土壤紧实度加大,土壤温度降低,微生物的活动受到抑制[40]。
3.3 土壤化学计量特征与酶活性的相互作用关系
通过皮尔逊分析得出高寒草甸退化过程中土壤的化学计量特征与酶活性之间不是相互独立的,它们之间存在一定的相关性(图4)。本研究发现,不同退化程度草甸土壤SOC、TN、TP 含量与五种水解酶活性呈正相关关系。这与李以康等[41]认为高寒草甸土壤酶活性与营养成分含量之间相关不显著研究结果存在差异。这主要是由于本研究所涉及的五种水解酶与土壤C、N、P 循环关系更为密切[8],水解酶活性降低,会抑制土壤SOC和氮化合物等的转化,进而影响土壤C、N 循环过程。同时,微生物依靠基质碳分泌酶,土壤酶活性会随着土壤SOC 含量的降低而降低[42],AP 能将土壤中的有机磷化合物水解为无机态P,供植物直接吸收利用,参与土壤P 循环[43]。高寒草甸退化过程中土壤TK 含量及C/N 与水解酶活性呈负相关,这可能是由于风化等因素导致高寒草甸退化过程中TK 含量的积累[28],同时K+对本研究涉及的五种水解酶激活作用较弱,由于目前涉及K+对土壤酶激活作用的研究相对较少,二者相互作用关系有待进一步探究。C/N与酶活性呈负相关关系,表明在退化过程中土壤水解酶活性相较于土壤TN 含量受SOC 含量影响较大,这是因为从原生植被到中度退化过程中SOC 流失速度大于N 的流失速度,从中度退化到重度退化阶段土壤中N 的流失速度大于SOC 的流失速度[44]。同时,酶活性在轻度退化呈现出较高水平,所以本研究所涉及的五种水解酶活性与土壤SOC 含量的关系更为密切。这一结果可为施加不同比例C、N、P 等土壤养分能够加快高寒草甸的恢复提供一定理论依据。不同退化程度下影响高寒草甸土壤酶活性的重要因子有P/K、N/K、TP,其中,土壤P、K 主要受土壤母质影响,N除受到母质影响外,还受地表枯落物分解作用和植物吸收利用的影响[45],P/K 与酶活性极显著正相关表明酶活性与土壤母质存在较强的联系,其作用机制还有待进一步探究。鉴于TP可通过直接效应作用于磷酸酶[44],是土壤中影响酶活性的重要因子,造成TP与酶活性呈显著正相关。
4 结论
本研究表明,高寒草甸草地退化与土壤化学计量特征及酶活性关系密切:
(1)随着高寒草甸草地退化程度的加剧,不同土层土壤中的SOC 和TN 含量随退化程度的加深整体呈现降低趋势,TK 含量呈波状增加,TP含量变化相对不显著,土壤C、N、P、K化学计量比整体上随着退化程度的加剧呈现降低趋势。五种水解酶活性在轻度退化草地中均表现出较高水平,在中度和重度退化中呈阶梯式下降。
(2)通过皮尔逊分析得出土壤化学计量特征与酶活性之间不是相互独立的,它们之间具有紧密的联系,具有一定的相关性,P/K 和N/K 是影响土壤水解酶活性的重要因子,土壤化学计量特征和酶活性对高寒草甸土壤具有共同影响。
研究结果对加快退化高寒草甸恢复工作的推进,实现高寒草甸可持续发展具有一定启示作用。

