色林错表层水体真核微生物多样性和群落分布格局
薛 曌, 王 兰, 孟华旦尚, 王亚龙, 郭小芳, 德 吉
(1. 西藏大学 生态环境学院,西藏 拉萨 850000; 2. 西藏民族大学附属中学,陕西 咸阳 712082)
0 引言
青藏高原是世界海拔最高的高原,是除南极、北极外冰川覆盖最广的地区[1]。这些冰川作为亚洲大江大河的源头,为20多亿人提供淡水和其他生态系统服务[2-4]。近几十年来,青藏高原气温平均每十年上升0.3 ℃,是全球气候变暖速度的3倍[5]。青藏高原作为北半球乃至全球气候变化的“感应器”和“哨所”,是维持我国气候系统稳定的重要屏障。青藏高原共有1 055 个湖泊,合计面积41 831.7 km2,分别占全国湖泊总数量和总面积的39.2% 和51.4%,是拥有湖泊数量最多、面积最大的湖区[6]。湖泊是地球表层水圈重要组成部分,也是地球五大圈循环和交流的纽带[7],同时作为载体和媒介参与生物圈的物质能量循环。湖泊能够真实反映动物和人类活动的信息,是其周边流域各种物质的集合点和储存库,且湖泊对周边气候变化敏感,是揭示全球气候变化与区域响应的重要信息载体[6]。青藏高原整个区域的气候和地形差异较大、地区人口稀少,湖泊的自然条件保持较好,较少受到人类活动的影响[8],是研究微生物多样性的天然实验室和理想场所。微生物几乎存在于地球的任何环境中,且形态多样、种类丰富[9-10]。真核微生物作为湖泊生态系统食物网的关键组成部分,具有重要的生态功能[11]。有研究表明,真核微生物既是有机质的生产者,也是细菌生物量的主要消费者,对维持湖泊生态平衡和促进生态系统营养流动过程至关重要[12]。
近几年专家学者对于湖泊真核微生物的研究逐渐增多。李春筱[13]对抚仙湖和星云湖的微生物多样性研究发现,隐藻目、褐藻门为抚仙湖的优势菌群;隐藻目、节肢动物门、双鞭毛门为星云湖的优势菌种;温度、DO、NH4+-N 等是影响两个湖泊真核微生物群落结构变化的显著环境因子。黄祎等[14]对南昌城市湖泊浮游微生物群落进行研究发现,DO、WT 与pH 是影响浮游真菌群落结构的显著水体理化指标,浮游真菌群落主要受确定性过程影响。王艳红[15]对纳木错酵母菌群落结构季节性变化研究发现,纳木错酵母菌资源较为丰富,3 个季节共计分离得到5 324株酵母菌,分属于38个属、74个种以及5 个潜在新分类单元;酵母菌群落结构季节性变化主要受到TDS、EC 和Salt的显著影响。薛文凯等[16]对纳木错可培养丝状真菌优势种的时空特征研究发现,纳木错可培养优势种包括普通青霉、酒色青霉、冻土毛霉等23 种,优势种季节更替率较高,种间竞争激烈,群落结构不稳定,在不同的环境中有着不同的优势度。刘洋等[17-18]对色林错-普若岗日国家公园和巴松错夏季浮游植物群落进行研究,发现两者物种组成均为硅藻-绿藻-蓝藻型,EC是影响巴松错夏季浮游植物水平群落变异的主要环境因子,TUR 是影响垂直变异的主要环境因子。Yu等[19]对色林错硅藻群落空间分布进行研究,共鉴定出硅藻30 属143 种,其中大部分为嗜盐、嗜碱性;硅藻群落的空间分布主要受水深的影响。
色林错位于青藏高原腹地,是西藏自治区内面积最大的湖泊。然而由于色林错特殊的地理位置及恶劣的环境,国内外对色林错流域的生物学研究多与昆虫学[20]、动物学[21-22]和鸟类学[23]相关,有关微生物学的研究较少[17,19,24],有关真核微生物多样性的研究较少[19],缺乏实测数据。色林错真核微生物群落多样性、分布格局及其对环境变化的响应情况对于阐释青藏高原湖泊真核微生物-环境互作机制有关键作用。本研究选取色林错表层水体为研究对象,以高通量测序技术为研究方法并结合环境因子进行相关性检验,旨在阐明色林错的真核微生物群落结构组成情况及与环境的关系,为未来色林错收缩或扩张变化后的真核微生物群落动态研究提供参考依据。
1 材料与方法
1.1 研究区概况
色林错又名奇林湖,位于青藏高原中部、藏北内流区的东南部,跨班戈、尼玛、申扎三县,是仅次于青海湖的中国第二大咸水湖。湖面海拔约4 530 m,形状呈“十”字型、不规则,长轴呈东西向延伸,长77.7 km,最大宽45.5 km,湖岸周长约255 km,岸线发展系数1.77[25]。集水域内有众多河流与湖泊相互连通,组成了一个封闭的内陆湖群。色林错总流域面积达45 530 km2,平均海拔4 600 m 以上,是西藏最大的内陆湖水系,色林错处于全流域的最低洼处,是水流汇集的中心。湖水主要依赖地表径流补给,入湖河流主要有扎根藏布、扎加藏布、波曲藏布、阿里藏布4 条。湖泊矿化度18.27~18.81 g·L-1,属硫酸盐型钠组Ⅰ型微咸水尾闾湖[26]。
1.2 水样采集
色林错湖面积在1976—2014 年间发生了急速扩张,色林错北岸湖面向北扩展了22.812 km,南岸湖面向南延伸同雅根错发生联通,湖泊面积进一步扩大,总体而言湖面扩张主要以南北方向为主[27]。有研究表明,湖泊微生物群落存在着明显的生物地理分布格局[28],且表层水体微生物群落更易受到环境及非环境因素的影响[29],推测色林错南北岸真核微生物群落会随着经纬度的变化和离岸距离的远近表现出不同的水平。笔者团队于2022 年6 月对色林错进行了环湖采样,利用无菌水体采样器采集色林错表层水体(深度约为50 cm)水样,以色林错东西轴为分界线,除入水口(RSK)4 个样点外,将各样点分成南岸(NA)区域和北岸(BA)区域两组,样点分布见图1。每个样点采集共计5 L 的水样,在2个2.5 L 无菌水样桶中避光低温保存,用于后续环境因子的测定及DNA的提取。
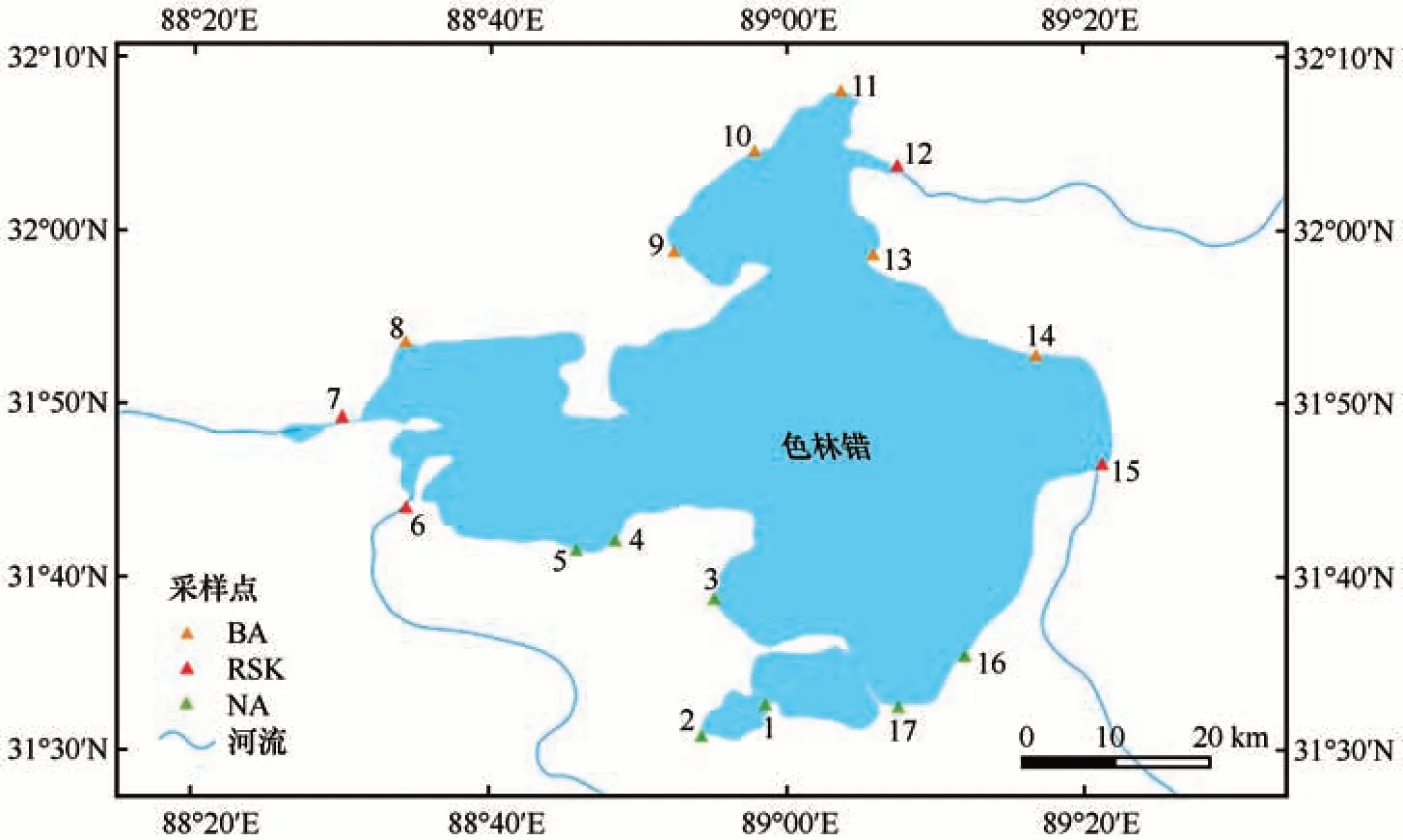
图1 色林错样点分布Fig. 1 Distribution of sampling sites in Selin Co
1.3 环境因子测定
水体温度(T)、酸碱度(pH)、电导率(EC)、溶解性总固体(TDS)和盐度(Salt)使用多功能参数仪(Multi-Parameter PCS Testr TM35)原位测量3次;一份水样(2.5 L)送拉萨博源环境监测科技有限公司进行总氮(TN)、氨氮(NH4+-N)、总磷(TP)、浊度(TUR)和化学需氧量(COD)5 个理化指标的测定。TN、TP、NH4+-N 测定方法分别为碱性过硫酸钾消解紫外分光光度法、钼酸铵分光光度法和水杨酸分光光度法,使用仪器均为UV 1800 PC紫外可见分光光度计,采用重铬酸盐法测定COD,采用浊度计法测定TUR(WGZ-1000 B便携式浊度计)。
1.4 DNA的提取和高通量测序
一份水样(2.5 L)送至实验室进行抽滤,取400 mL水样利用砂芯过滤器经0.22 μm无菌醋酸纤维水系滤膜过滤收集菌株,每个样点设置4个重复(共抽取1.6 L水体),滤膜送广东美格科技有限公司进行DNA的提取。DNA 的提取采用试剂盒法,进行基因组DNA抽提后,利用Thermo Nano Drop One检测DNA的纯度和浓度。使用真核微生物18S rRNA 基因V4区引物528F(5′-GCGGTAATTCCAGCTCCAA-3′)、706R(5′-AATCCRAGAATTTCACCTCT-3′)[30-31]及TaKaRa Premix Taq®V2.0 进行PCR 扩增(PCR 仪:BioRad S1000),每个样本进行3 个重复,并将同一样本的PCR 产物进行混合,PCR 扩增产物使用1.5%琼脂糖凝胶电泳检测。利用Gene Tools Analysis Software 对PCR 产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR 产物进行混合。使用E.Z.N.A.®Gel Extraction Kit凝胶回收试剂盒回收PCR 混合产物,TE 缓冲液洗脱回收目标DNA 片段。按照NEBNext®UltraTMII DNA Library Prep Kit for Illumina®标准流程进行建库操作,使用Illumina Nova 6000 平台对构建的扩增子文库进行PE 250测序。
1.5 数据处理及绘图
对于得到的测序数据利用fastp 分别对双端的Raw Reads 数据进行滑窗质量剪裁,同时,根据序列首尾两端的引物信息,利用cutadapt 软件(https://github. com/marcelm/cutadapt/)去除引物,得到质控后的paired-end Clean Reads。再根据PE reads 之间的overlap 的关系,利用usearch-fastq_mergepairs(V10,http://www. drive5. com/usearch/预设参数包含最小overlap长度设置为16 bp,拼接序列的overlap区允许的最大错配5 bp),过滤不符合的Tags,获得原始的拼接序列(Raw Tags)。 最后利用fastp(V0.14.1,https://github. com/OpenGene/fastp)对Raw Tags数据进行滑窗质量剪裁,得到有效的拼接片段(Clean Tags)。使用Uparse V7.0.1001 软件对过滤后的数据进行聚类,以97%的一致性将序列聚类成为可操作分类单元(OTU, operational taxonomic units),使用Qiime V1.9.1 软件中的Blast 方法结合Silva 数据库进行物种注释分析,得到原始OTU 表,随后将原始OTU表进行标准化处理用于后续分析。
样点图采用ArcGIS(V10.8)绘制,基于OTU丰度表,使用usearch-alpha_div(V10,http://www.drive5.com/usearch/)进行α 多样性指数的计算。相关性分析和差异性分析采用SPSS 27.0 软件的Spearman 相关性系数法和单因素方差分析(ANOVA),多重比较分析使用Duncan检验法。非度量多维尺度分析(NMDS)和ANOSIM 检验使用R 4.0.2软件进行,冗余分析使用CANOCO 5 软件进行,使用LEfSe 软件进行线性判别分析和效应大小分析,LDA 评分默认设置为4。其他绘图使用R 4.0.2 软件和Origin 2022软件进行。
川藏高速公路位于四川盆地和青藏高原过渡带,山体高大陡峻,峡谷深切,活动断裂发育,处于我国著名的强烈地震带——NE向龙门山断裂带和NW向鲜水河断裂带及SN向安宁河断裂带构成的“Y”字形构造带。高速公路分别经过基本地震烈度为Ⅶ、Ⅷ、Ⅸ度地区,其中Ⅶ度区占线路总长的57%,Ⅷ区占线路总长的37%,Ⅸ度区占线路总长的6%。
2 结果与分析
2.1 色林错水体理化性质
色林错各样点环境因子如表1~2所示。各样点pH 范围在9.32~9.62 之间,属于碱性盐湖[32],12 号样点和17号样点间pH值差异性最显著。12号样点水温T最高,17 号样点最低,平均为15.75 ℃。2 号样点的EC、TDS、Salt值最大,12号样点的EC、TDS、Salt 值最小,两者之间存在显著差异。各样点水体COD 均值为15.59 mg·L-1,5 号样点COD 显著低于其他样点,表明5 号样点水体中有机物含量较少。各样点水体NH4+-N 均值为0.05 mg·L-1,7 号、13 号、16 号水体中NH4+-N 含量相同,为0.07 mg·L-1,2 号水体含量最低,为0.03 mg·L-1。1号样点水体TN 含量最高,9号样点次之,13号样点水体TN含量最低。各样点水体TP 含量处于0.1~0.3 mg·L-1间,无显著差异。13 号样点水体TUR 最高,12 号样点次之,1号样点最低。
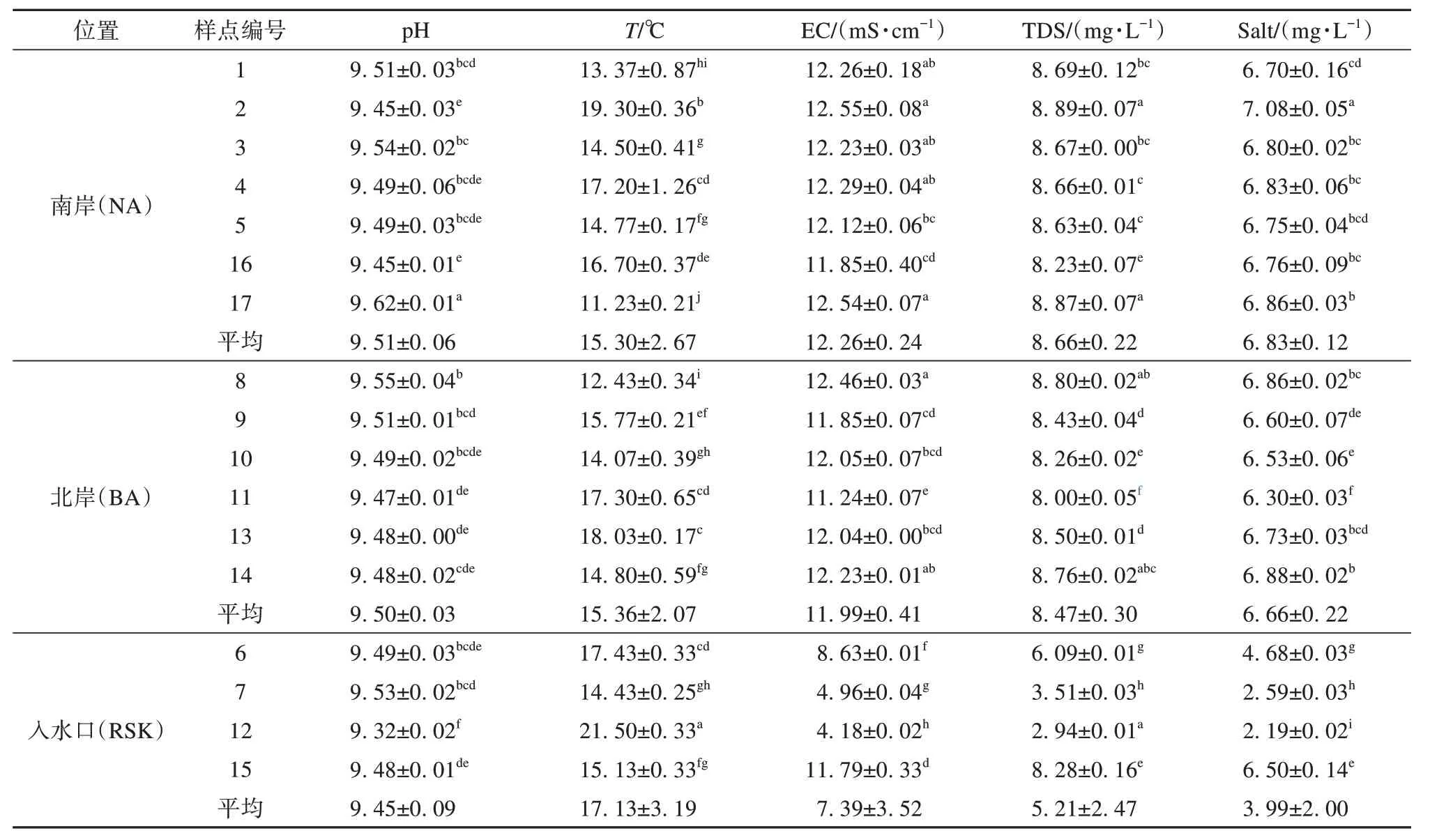
表1 色林错各样点自测环境因子Table 1 Self-measured environmental factors of different sampling sites in Selin Co
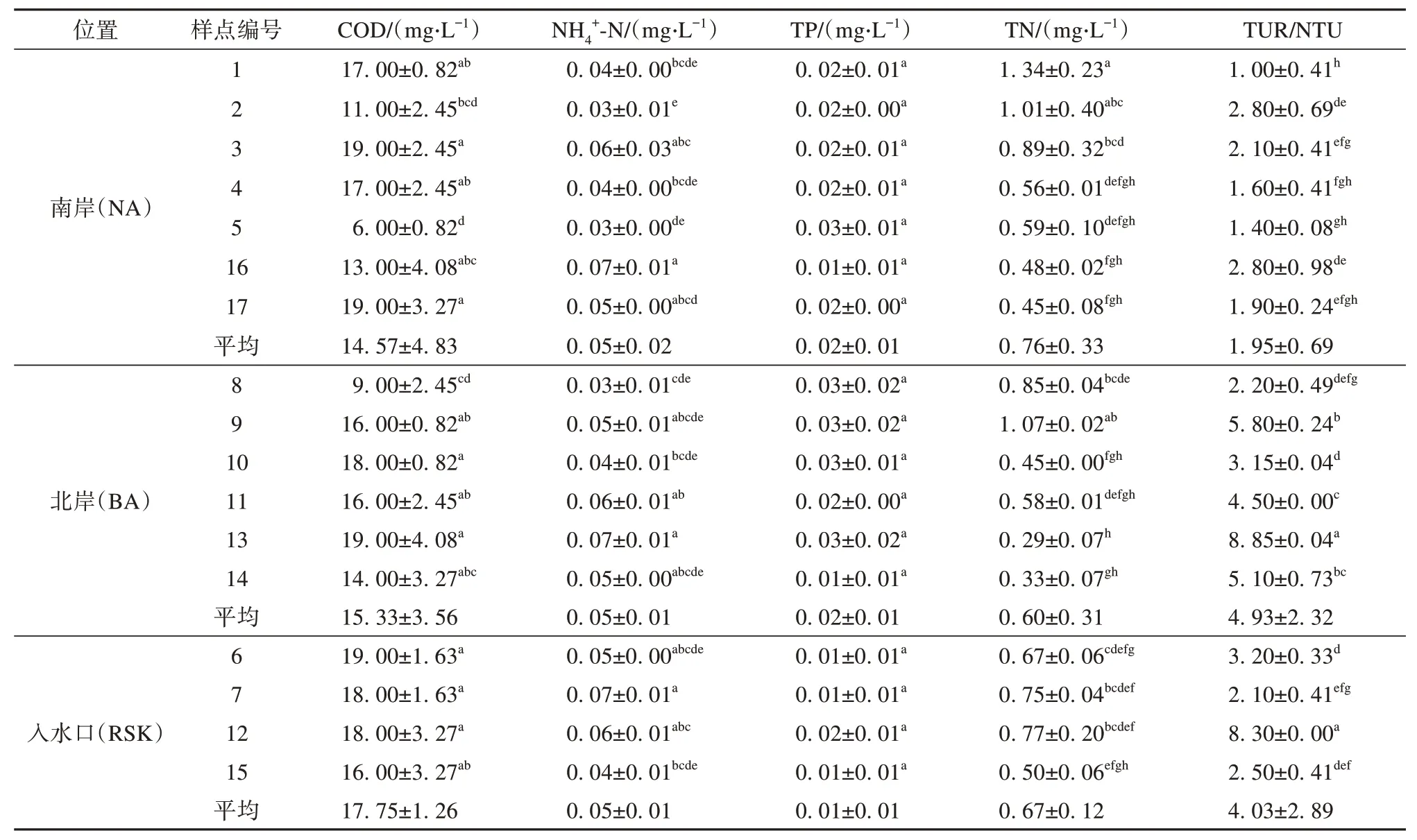
表2 色林错各样点送测环境因子Table 2 Send-measured environmental factors of different sampling sites in Selin Co
2.2 色林错表层水体真核微生物α多样性特征
本次实验各样点覆盖度指数均达到99.7%以上,测序深度基本覆盖了样品中的所有真核微生物群落,可以反映色林错表层水体真核微生物群落的真实情况(图2)。从17 个样点表层水体中共得到1 343 条OTU,其中16 号样点水体中OTU 最丰富(105 条),1 号样点水体中OTU 最少(53 条)。使用Venn图对各样点、各区域共有及特有OTU进行统计分析,结果如图3所示。各样点共、特有OTU数不尽相同[图3(a)],各样点共有OTU 数为21条,16号样点特有OTU 最丰富(33 条),4 号、17 号样点无特有OTU。各区域OTU数目[图3(b)]由多到少分别为:NA(514 条)>RSK(369 条)>BA(460 条)。三个区域共有OTU数为97条,NA区域特有OTU最丰富为59条,BA 区域特有OTU 最少,仅28条,虽然NA 和BA区域OTU数目最多,但两者共有OTU数仅为14。

图2 色林错各样点在97%水平上的稀疏曲线Fig. 2 Rarefaction curves of different sampling sites in Selin Co at cutoff level of 97%
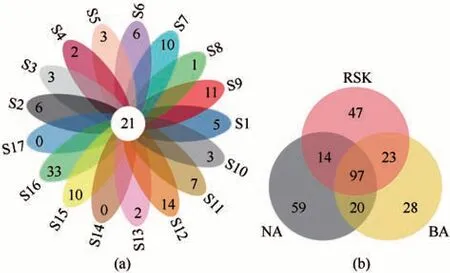
图3 各样点(S1~S17)(a)及各区域(b)OTU水平Venn图Fig. 3 Venn diagram of OTU levels in different sampling sites (S1~S17) (a) and different sampling regions (b)
Shannon 多样性指数和Simpson 多样性指数变化趋势基本相反(图4),11 号样点Shannon 指数最大而Simpson 指数最小,表明11 号样点真核微生物群多样性最丰富。Chao1 指数和ACE 指数(图4)变化趋势基本一致。进行各区域间α多样性指数差异性分析(图5)发现,色林错各区域间真核微生物多样性均无显著差异。

图4 各样点(S1~S17) α多样性指数Fig. 4 The α diversity index in different sampling sites (S1~S17)
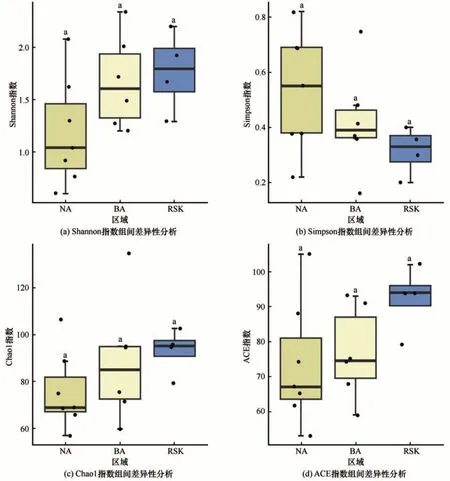
图5 各区域间α多样性指数差异性分析Fig. 5 Analysis on the difference of α diversity index among different sampling regions:Shannon index (a), Simpson index (b), Chao1 index (c) and ACE index (d)
2.3 色林错表层水体真核微生物群落结构
为探明色林错表层水体真核微生物群落结构组成情况,分别在门、属分类水平上剔除未注释类群生成Circos 图(图6)和堆叠柱状统计图(图7),以求直观的展现各样点的已知真核微生物类群分布、比例及优势类群等信息。由于目前数据库的局限性,本研究中有较多OTU 属于未知真核微生物类群,类似的结果在其他研究中也有出现[33-35]。1~17号样点门分类水平下未注释类群占比分别为16.5%、2.3%、18.6%、73.0%、1.0%、18.3%、5.9%、70.4%、23.2%、61.0%、14.1%、8.5%、2.2%、18.2%、1.5%、11.7%、1.5%,门水平未注释类群平均相对丰度为20.5%;属分类水平下未注释类群占比分别为55.5%、12.5%、19.7%、80.0%、16.3%、37.1%、27.2%、76.0%、26.1%、66.8%、55.8%、48.0%、68.1%、26.0%、2.1%、12.0%、2.0%,属水平未注释类群平均相对丰度达到37.13%。
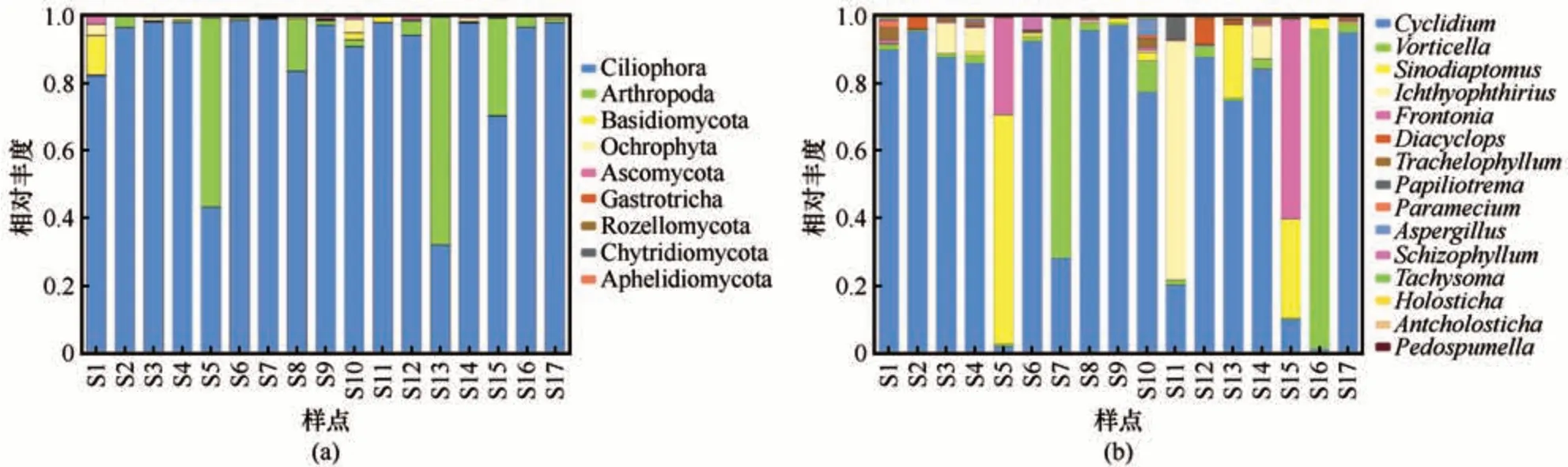
图7 各样点(S1~S17)门水平(a)和属水平(b)堆叠图Fig. 7 Stack diagram in phylum (a) and genus (b) levels in different sampling points (S1~S17)
门水平上[图6(a),图7(a)],纤毛门(Ciliophora)平均相对丰度最高,为86.54%,其次为节足动物门(Arthropoda),平均相对丰度为10.9%。从真核微生物门水平堆叠图可以看出纤毛门分布最广、占比最高,为色林错表层水体真核微生物的绝对优势门(相对丰度>85%),节足动物门主要分布于5 号、13 号、15 号样点,是仅次于纤毛门的优势门。各区域门水平Circos 图显示,纤毛门在NA 和RSK 的相对丰度均在90%左右,在BA 的含量约75%。不同的是,节足动物门在BA 丰度较高,达到了22.4%,在NA 和RSK 的丰度均不到10%。除此之外,褐藻门(Ochrophyta)在BA 的丰度也比NA 和RSK 高。纤毛门和节足动物门占基因序列总数的比例高达97.44%,是色林错表层水体优势门类。
属水平上[图6(b),图7(b)],膜袋虫属(Cyclidium)平均相对丰度为66.09%,而后依次为钟虫属(Vorticella)(11.62%)、中镖水蚤属(Sinodiaptomus)(7.60%)、纤毛虫属(Frontonia)(5.86%)和椭圆形纤毛虫属(Ichthyophthirius)(5.54%),四者占基因序列总数的比例高达97.44%,是色林错表层水体优势属类。钟虫属主要分布于16号、7号,中镖水蚤属主要分布于5 号样点,椭圆形纤毛虫属主要分布于15号样点,纤毛虫属主要分布于11号样点。从真核微生物属水平堆叠图可以看出膜袋虫属占比最高、分布最广且均匀,判断膜袋虫属为色林错表层水体真核微生物的绝对优势属(平均相对丰度>65%)。钟虫属、中镖水蚤属、椭圆形纤毛虫属和纤毛虫属均分布广泛,但不均匀。各区域属水平Circos 图显示,各区域真核微生物群落分布差异较大。膜袋虫属在各区域丰度均为最高,不同的是钟虫属在NA和RSK 的丰度分别为38.7%和25.8%,在BA 中的丰度却仅为1.6%;纤毛虫属在NA和RSK 的丰度均不足1%,在BA 中却高达18.7%;管叶虫属(Trachelophyllum)在BA 中的丰度为1.7%,约为NA和RSK丰度的数十倍。
2.4 色林错真核微生物群落空间分布格局
采用基于OTU 水平Bray-Curtis 距离的NMDS排序和ANOSIM 检验来表现色林错地区的真核微生物群落差异性。ANOSIM 检验结果显示,色林错NA、BA、RSK 3 个区域间的真核微生物群落区域间差异大于区域内差异,表明色林错真核微生物群落在不同区域分布具有空间差异(R=0.021,P<0.05)(图8)。

图8 基于Bray-Curtis距离的非度量多维尺度(NMDS)分析(a)和ANOSIM检验(b)结果Fig. 8 Results of nonmetric multidimensional scaling (NMDS) analysis using Bray-Curtis dissimilarity distance (a) and ANOSIM test (b)
2.5 色林错各区域表层水体真核微生物群落的物种差异
利用LEfSe 寻找生物标志物,从而找到群体间丰度差异显著的物种,采用秩和检验检测不同组别不同物种,通过LDA 获得LDA 评分(LDA 评分=4),最后,绘制不同物种的进化支[图9(a)]和LDA 值[图9(b)]分布直方图。在分支图中,从内向外辐射的圆圈表示从门到物种的分类水平。不同分类水平的每个小圆圈代表该级别的一个分类学,小圆圈的直径与物种的相对丰度成正比。图中显示了LDA 得分大于设定值的物种,即不同组间差异显著的物种。直方图的长度表示具有显著差异的物种的影响大小。本研究于3 个区域共获得5 个生物标志物,其中BA 区域样品中2 个分类群和RSK 区域样品中3个分类群,NA区域样品中未获得生物标志物。具体而言,BA 和RSK 中的标志物分别分属于纤毛门和节足动物门。

图9 各区域LEfSe分析结果(a)和LDA值分布直方图(b)Fig. 9 The LEfSe analysis result (a) and histogram of LDA score (b) in different sampling regions
2.6 影响色林错表层水体真核微生物群落空间分布格局的因素
为探究影响色林错表层水体真核微生物群落空间格局的因素,进行了色林错样品理化性质和多样性指数Pearson 相关性分析和色林错水体真核微生物群落门水平类群和环境因子冗余分析。
图10 结果显示:①环境因子间 pH与水温(T)呈极显著负相关,与TUR 呈显著负相关;水温与TUR呈极显著正相关;EC 与TDS、Salt 呈极显著正相关;TDS与Salt呈极显著正相关;COD 与NH4+-N 呈显著正相关。②多样性指数间 Shannon 指数与Simpson指数呈极显著负相关;Chao1 指数与ACE 指数呈极显著正相关。③环境因子和多样性指数间 EC 与Simpson指数呈显著正相关,与Shannon指数呈显著负相关;TDS 与Shannon 指数、Chao1 指数呈显著负相关;Salt 与Shannon 指数呈极显著负相关,与Simpson 指数呈显著正相关。结合以上分析得知,EC、TDS 和Salt 是影响色林错水体真核微生物群落多样性和丰富度的主要环境因子。

图10 α多样性指数和环境因子的Pearson相关系数Fig. 10 Pearson correlation coefficients between α diversity index and environmental factors
对色林错水体真核微生物群落门水平上物种进行DCA 分析,结果排序轴梯度最大值小于3,故采用RDA 分析(图11)。第一、二排序轴物种-环境累计方差的解释率分别为32.38%和19.39%,第一、二排序轴物种-环境因子的相关系数分别为0.9722 和0.9155,前两轴累计方差为51.77%,表明前两轴能较好地反映色林错水体真核微生物相对丰度与各环境因子的关系,且主要由第一排序轴决定。第一排序轴与EC 呈负相关,第二排序轴与EC呈正相关,子囊菌门(Ascomycota)和褐藻门与EC呈正相关,担子菌门、罗兹菌门、纤毛门、腹毛动物门和节足动物门与EC 呈负相关。利用蒙特卡拟合方法对环境因子进行显著性检验,通过筛选得出EC(F=3.7,P=0.002)为极显著解释性变量,对群落变异的解释率为19.9%。因此EC 是影响色林错水体真核微生物群落结构的最主要环境因子,其次为TDS和Salt,结果同相关性分析一致。
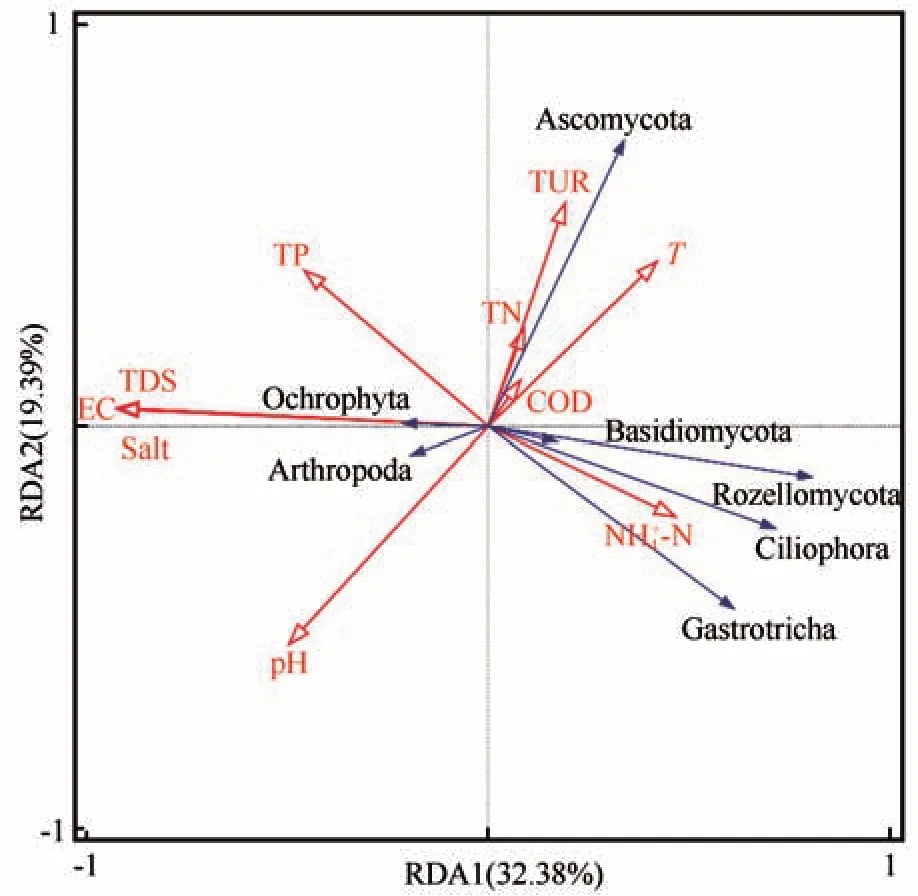
图11 真核微生物与理化因子的RDA分析Fig. 11 Redundancy analysis (RDA) of eukaryotic microbesand physicochemical factors
3 讨论
3.1 色林错表层水体真核微生物的丰富度和多样性
本研究基于18S rDNA 高通量测序技术,对色林错湖17 个样点表层水体进行分析,共得到1 343条有效OTU,已注释OTU 分属于9 门15 属。在得到的288 种OTU 中有48.96%的OTU 未被注释,说明色林错真核微生物未知种类较多、真核微生物资源有待开发。色林错湖水环境相对稳定,各区域间微生物的多样性变化并不明显无显著差异。多样性高的群落具有更高的初级生产力和稳定性,对环境变化的适应能力也强[36]。本研究发现色林错真核微生物群落α 多样性指数较低(图4),表明色林错真核微生物群落多样性较低,反映了色林错真核微生物群落结构较为简单,对外部环境改变和内部群落变动的抵抗能力较小,这可能是由色林错高海拔咸水湖泊的特点所决定的。
由Shannon 多样性指数和Simpson 多样性指数变化可以看出,NA、BA、RSK 3 个区域的生物多样性逐渐升高,ACE 指数和Chao1 指数也显示各区域内群落所含OTU 数逐渐增加。韦恩图显示S16 特有OTU 数最多,推测是该样地临近洼地,附近与大片因雨水聚集而形成的沼泽地相连,表层水体中混入大量土壤和雨水外来菌种所致。虽然NA 区域特有OTU 最多(59 条),但除去S16 特有OTU 数目后剩余样地特有OTU 数仅为26 条,和BA 区域特有OTU 数(28 条)相差不大但两者特有OTU 数均低于RSK(47 条)。RSK 区域特有OTU 数目较多推测原因是此区域采样点均位于入湖口附近,有大量冰川和冻土融水携带外源微生物由此入湖。冰川融水为pH 呈中性的淡水,因此RSK 区域水体平均pH 略低于NA 和BA 区域(表1),为9.45。过高的pH 会抑制微生物的生命活动,如张海涵等[37]的研究表明真核微生物群落结构组成在夏季主要受到pH 的影响,由此推测pH 是限制RSK 附近微生物向全湖扩散的原因之一。除此之外,以真核微生物为代表的微生物被认为具有较强的扩散能力,但其扩散能力的强弱依赖于其生存载体的特性[38]。色林错湖面较宽,湖岸线长,水体深且湖水流速慢,这些因素影响到以水体为载体进行扩散的真核微生物的扩散能力和影响区域生物群落的物种组成、多样性和群落功能,限制了不同区域间微生物的交换,最终因长期的地理隔离形成了区域特有的微生物群落结构[39-40]。这与多数水环境微生物地理格局的研究结果相似,如Lu等[41]对长江上游真核浮游生物群落生物地理学研究表明,地理距离对于构建真核浮游生物群落很重要;Wu 等[42]对中国东海和南海表层水体中丰富微生物类群的研究发现,扩散限制主导了其群落的构建;高鹏飞等[28]对中国湖泊细菌群落的生物地理分布格局及驱动机制研究中发现,空间扩散限制是青藏高原湖泊浮游及沉积物细菌群落构建的主要驱动因素。
3.2 色林错表层水体真核微生物的群落结构
结果显示,同青藏高原其他湖泊相比(表3),色林错表层水体真核微生物优势类群和其他湖泊有较大差异。色林错表层水体真核微生物优势门类(平均相对丰度>1%)为纤毛门、节足动物门和褐藻门,优势属类为膜袋虫属、钟虫属、中镖水蚤属、椭圆形纤毛虫属和纤毛虫属。担子菌门(0.92%)、子囊菌门(0.55%)等真菌是色林错表层水体中的稀有门群(平均相对丰度<1%)。羊卓雍错表层水体中子囊菌门和担子菌门为优势门类,巴松错水体中纤毛门同为优势门类,青海湖中浮游藻类为优势门类。

表3 色林错表层水体真核微生物优势类群与其他高原湖泊的比较Table 3 Comparison of dominant groups of eukaryotic microbes in surface water between Selin Co and other plateau lakes
本研究结果中原生动物为优势类群,而真菌类群丰富度较低属于稀有类群,推测与季节变化有关[43]。因本研究采样时间为2022 年6 月,正值夏季气温回升,降水充沛,冰川融雪水经地表径流汇入色林错补充水源的同时,又为湖水引入矿质元素,引起色林错本地微生物群落动态变化[44]。夏季高原光照充足,水体浮游植物和藻类生长加速,光合作用增强释放氧气,强烈的光照提高了湖泊的水温和溶解氧含量。原生动物作为水生态环境中的初级消费者以水体中的浮游藻类为食,有着丰富的碳源来源,充足的光照、适宜的温度和丰富的养料供养其快速繁殖,最终成为优势类群,而担子菌、子囊菌等水生真菌可能由于受到原生动物竞争和压迫导致生存压力上升[47],在色林错表层水环境中处于劣势地位成为稀有类群,本研究的调查时间有限,具体变化趋势的原因有待在更大时空尺度上的进一步研究讨论。
3.3 色林错表层水体真核微生物群落与环境的关系
真核微生物是水生态环境改变最先和最直接的反映者,其生长特性和群落结构组成与环境因子密切相关[48]。本研究显示,影响色林错表层水体真核微生物群落结构的最主要环境驱动因子为EC,TDS 和Salt 为主要环境驱动因子,对环境因子进行各区域间差异性分析(图12),发现EC、TDS、Salt 和TUR在各区域间具有显著性差异。
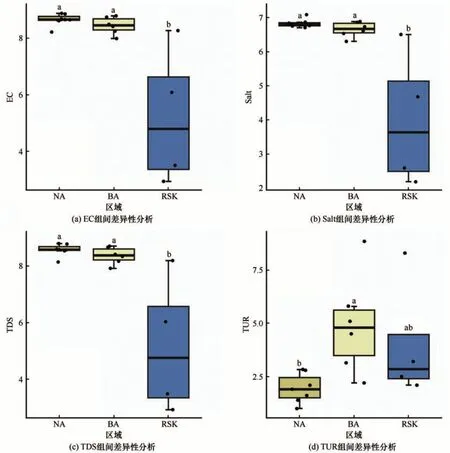
图12 各区域间环境因子差异性分析Fig. 12 Analysis on the difference of environmental factors among different sampling regions:EC (a), Salt (b), TDS (c) and TUR (d)
在本研究结果中(图11),EC、TDS 和Salt 同担子菌门、罗兹菌门、纤毛门、腹毛动物门和节足动物门的相对丰度呈负相关。EC、TDS 和Salt 对真核微生物的影响主要表现在对真核微生物细胞的渗透压上,高渗环境可能会导致真核微生物细胞死亡、裂解或休眠,并且会影响真核微生物对环境中TP、TN 等营养盐的摄取[49]。查阅文献可知,TUR(浊度)主要在两方面影响真核微生物的群落结构。一方面,浊度通过影响水体的透光度来影响水体中浮游藻类和浮游植物的光合作用强度,进而促进纤毛门群落的生长繁殖。本研究中,浊度明显促进纤毛门和节足动物门的生长发育(图11),原因可能是色林错水体主要来源为高山冰川雪融水,水质本身较为清洁,再加上湖泊周围人为干扰弱,在一定范围内浊度对真核微生物群落有积极影响。王昱等[50]的研究发现节肢动物在水质为清洁—轻污染情况下为优势类群,根据西藏自治区生态环境厅网站发布的《2020 年西藏自治区生态环境状况公报》(http://ee. xizang. gov. cn/)公示,依据《地表水环境质量标准》(GB 3838—2002)、《地表水环境质量评价办法(试行)》,色林错水质达到Ⅲ类标准,这就相互印证了色林错水质良好较为清洁的事实。另一方面,在一定范围内,浊度的升高有利于水生态环境中细菌的生存和繁殖,进而对以细菌为食物来源的纤毛门的生存繁殖有促进作用[38],这也许是纤毛门和节足动物门成为色林错表层水体优势类群的又一重要原因。
4 结论
本研究选择西藏自治区第一大湖色林错为研究区域,探讨了色林错表层水体真核微生物多样性及群落结构,并分析了水环境因子对其的影响,揭示了色林错地区真核微生物群落分布格局及其对周边环境的响应情况,主要结论如下:
(1)本研究共从色林错水体中得到1 343 条OTU,已注释OTU 分属9 门15 属,真核微生物群落主要由纤毛门和节足动物门等组成。
(2)对色林错各样点α 多样性指数进行差异性分析发现,11 号样点真核微生物多样性最丰富,色林错各区域间α多样性指数无显著差异(P>0.05)。
(3)NMDS 分析及ANOSIM 检验显示,色林错真核微生物群落在不同区域分布具有空间差异(R=0.021,P<0.05)。
(4)相关性分析及RDA 分析结果表明,EC、TDS和Salt是影响色林错表层水体真核微生物群落结构的主要环境驱动因子。

