一株林麝源弗格森埃希菌的分离鉴定及耐药性
彭茜翎,王如意,乔美萍,周 磊,王洪永,蒋本模,吴 杰,杨 杰,其美拉姆,颜其贵
(1.四川农业大学动物医学院,成都,611130;2.四川农业大学动物医学院动物疫病与人类健康四川省重点实验室,成都,611130;3.青川九药麝业开发有限公司,广元,628100;4.四川养麝研究所,都江堰,611845;5.凤县逢春济民可信科技养殖有限公司,宝鸡,721000;6.上察隅镇农牧综合服务中心,林芝,860614)
林麝(Moschus berezovskii)是国家一级重点保护野生动物,也是名贵中药材麝香的基源动物[1]。王永奇等[2]分析2001—2012 年陕西339 只林麝死亡病例,发现导致林麝死亡的主要为呼吸道、消化道和不明原因疾病。引起林麝各类疾病的病原较为复杂,目前报道有大肠埃希氏菌(Escherichia coli)[3]、绿脓杆菌(Pseudomonas aeruginosa)[4]、支气管败血波氏杆 菌(Bordetella bronchiseptica)[5]和黏质沙雷氏菌(Serratia marcescens)[6]等。弗格森埃希菌(Escherichia fergusonii)于1885 年 被Theodor Escherich 首次发现,与大肠埃希氏菌同属于埃希氏菌属(Escherichia)成员[7]。弗格森埃希菌不仅能引起人类疾病,在动物体内也能引发一系列感染,主要从伤口感染、尿路 感染、菌血症、腹泻、胰腺癌、眼内炎和胸膜炎等症状的患者和动物体内分离得到[8-11]。Farmer等[12]于1985 年首次报道从猪、马及火鸡体内分离得到弗格森埃希菌;随后从患肺炎的牛[13]、腹泻驯鹿(Rangifer tarandus tarandus)[14]和腹泻马[15]的体内均分离出弗格森埃希菌。作为人兽共患病病原微生物,弗格森埃希菌也许会对动物食品安全存在潜在的威胁。
与大肠埃希氏菌感染的治疗方式类似,弗格森埃希菌的治疗方式是以抗生素药物治疗为主,但随着耐药菌株的不断出现,治疗效果有所下降。弗格森埃希菌的多重耐药性和产超广谱β-内酰胺酶(extended spectrum beta-lactamases,ESBLs)菌株的出现均有报道[16-21]。Tang等[22]于2019年从中国3个省份1 400 份动物样本(猪、鸡和鸭)中分离得到133 株弗格森埃希菌,并检测其耐药基因,发现弗格森埃希菌已在我国动物中广泛流行且具有较高的耐药性。
目前在野生动物中分离出弗格森埃希菌的相关报道较少。本试验从死亡林麝体内分离得到1 株弗格森埃希菌,对其培养特性和生化特性进行研究,分析16S rDNA 基因序列及耐药性,为深入研究弗格森埃希菌的生物学特性、致病性及预防治疗弗格森埃希菌引起的相关疾病提供科学有效的参考依据。
1 材料与方法
1.1 试验样品
2020 年,在四川省广元市青川县某林麝养殖场内对1只死亡林麝的脾、肾和腹腔积液进行采样。
1.2 引物合成
16S rDNA 通用引物及耐药基因bla-OXA1/4/30[23]、bla-CTX-M[24]、bla-AAK和bla-SHV共5 对引物由生工生物工程(上海)股份有限公司合成。序列信息如表1所示。

表1 引物信息Tab.1 Primers sequence
1.3 细菌分离纯化
无菌采集养殖场内死亡林麝的脾、肾和腹腔积液做致病性细菌分离。使用无菌接种环从病料上采集样本,连续划线接种于含5%胎牛血清的TSA培养基(青岛高科技工业园海博生物技术有限公司),37 ℃培养24 h。根据菌落形态特征挑取单菌落,并将单菌落接种于固体培养基上进一步纯化,再用无菌接种环挑取单个菌落进行革兰氏染色镜检。
1.4 分离菌株16S rDNA扩增与序列分析
用细菌基因组DNA 提取试剂盒(天根生化科技(北京)有限公司)提取分离菌株的DNA,以分离菌株DNA 为模板,PCR 扩增16S rDNA。反应体系20 µL:2×T5 Super PCR Mix(Colony)(北京擎科生物科技有限公司)10 µL,上、下游引物(表1)各1 µL,DNA 模板1 µL,ddH2O 补足反应体系。PCR 反应程序:98 ℃预变性3 min;98 ℃变性15 s,58 ℃退火15 s,72 ℃延伸25 s,35 个循环;72 ℃终延伸5 min。扩增后的PCR 产物经1%琼脂糖凝胶电泳检测后送往生工生物工程(上海)股份有限公司测序。在GenBank 上筛选4 株相关细菌的16S rDNA 序列,将测序结果与其进行同源性分析,利用DNA Star 构建系统发育进化树。
1.5 分离菌株的生化鉴定
细菌生化鉴定步骤按照青岛高科技工业园海博生物技术有限公司的细菌生化微量鉴定管操作说明书进行。鉴定项目为葡萄糖、山梨醇、麦芽糖、甘露醇、乳糖、蔗糖、尿素、枸橼酸盐、硫化氢、赖氨酸脱羧酶、纤维二糖、丙二酸盐、甲基红、靛基质和鸟氨酸脱羧酶。
1.6 药敏试验及耐药基因检测
采用药敏纸片扩散法对分离菌株进行药敏试验。药敏纸片购自杭州微生物试剂有限公司,测定药物包括阿米卡星、呋喃唑酮、氨苄西林、头孢噻肟、多西环素、庆大霉素、环丙沙星、头孢噻吩、卡那霉素、头孢他啶、四环素、复方新诺明、氯霉素、青霉素和链霉素。
将菌株接种于TSB液体培养基中,37 ℃,180 r/min振荡培养18 h。用0.5麦氏比浊管与菌液对比,将浓度调至1.5×108cfu/mL。在无菌条件下,将100 µL菌液均匀涂布于MH 培养基后,将药敏纸片贴在涂布有菌液的MH 培养基上,37 ℃倒置培养18~20 h。参照美国临床实验室标准化协会(CLSI)的标准,根据各抑菌环的直径判定。
参照GenBank 中耐药基因的序列及文献,合成4 对引物[23-24],随后以提取的细菌DNA 为模板,扩增β-内酰胺类耐药基因。反应体系20 µL:2×TaqPCR Master 10 µL,上、下游引物(表1)各1 µL,DNA 模板1 µL,ddH2O 补足反应体系。PCR 反应程序:95 ℃预变性3 min;95 ℃变性30 s,退火温度根据上、下游引物计算,退火30 s,72 ℃延伸8 s,35 个循环;72 ℃终延伸5 min。扩增后的PCR 产物经2%琼脂糖凝胶电泳检测后送往生工生物工程(上海)股份有限公司测序。
2 结果
2.1 弗格森埃希菌的分离和同源性
接种死亡林麝脾、肾和腹腔积液的TSA 在37 ℃培养24 h 后生长出灰白色、湿润的光滑型(S)菌落(图1A),通过革兰氏染色镜检鉴定为革兰氏阴性杆菌,无芽孢(图1B)。
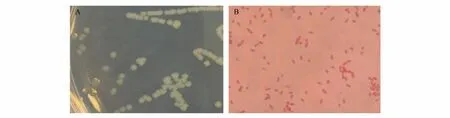
图1 培养后的分离菌株菌落(A)和菌株形态(B;革兰氏染色,10×100)Fig.1 Colony(A)and strain morphology(B;Gram staining,10×100)of isolated strains after culture
以菌株DNA 为模板,用引物(表1)扩增分离菌株的16S rDNA 基因,扩增产物在1 400 bp 存在目的条带(图2)。
测序后经BLAST 比对分析,显示分离菌株的16S rDNA 序列与GenBank 上弗格森埃希菌T3-3(登录号MT416423.1)的16S rDNA 序列同源性最高,将其命名为CD20200904。同时构建系统发育进化树,结果显示分离菌株CD20200904 与弗格森埃希菌T3-3 菌株亲缘关系最近(图3),初步确定该分离菌株为弗格森埃希菌。
2.2 弗格森埃希菌的生化鉴定
通过比较,发现试验分离菌株的生化特性与文献[25]中弗格森埃希菌的生化特性高度一致,进一步确定该分离菌株为弗格森埃希菌(表2)。
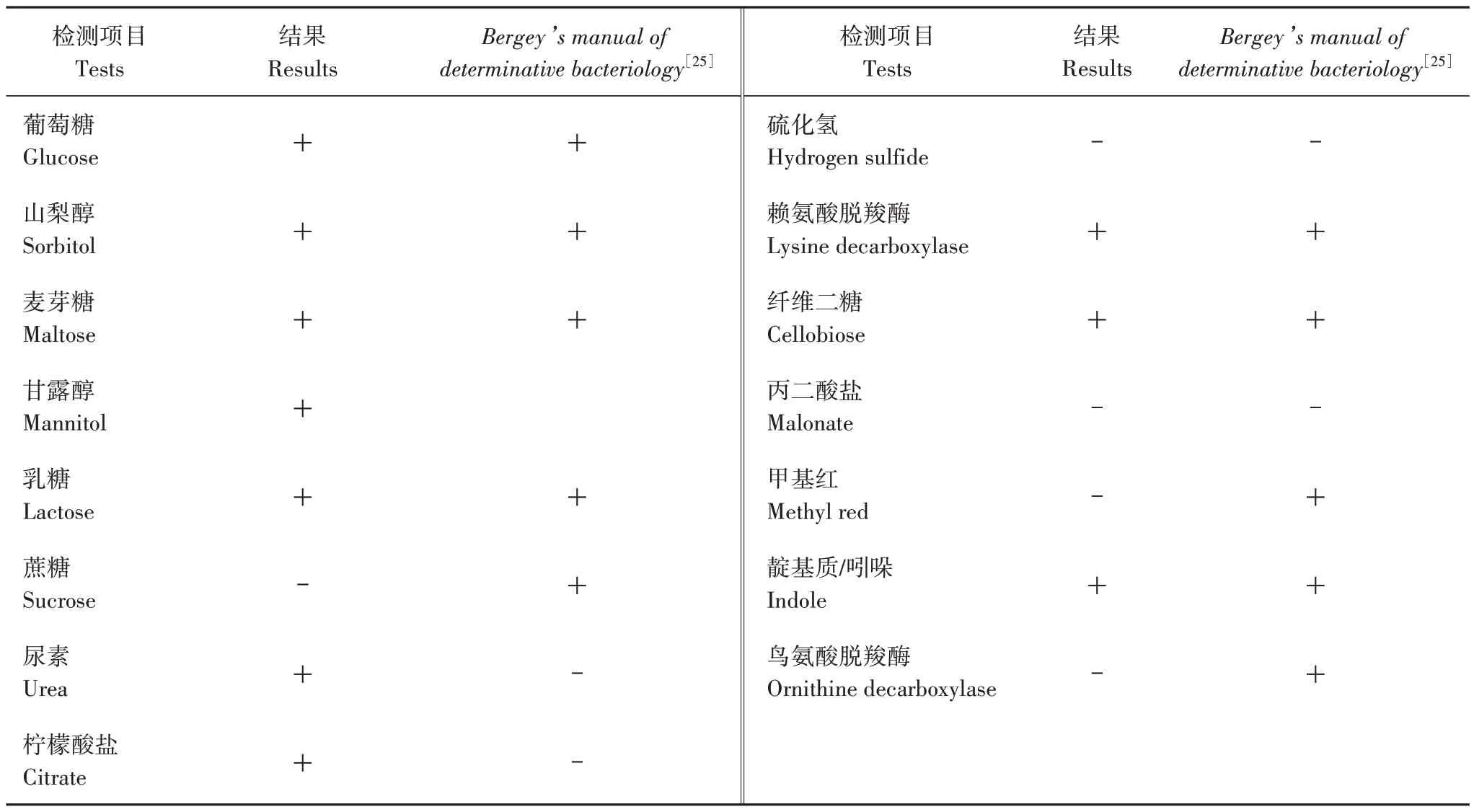
表2 分离菌株的生化反应特性Tab.2 The results of biochemical reactions of strain
2.3 药敏试验及耐药基因检测
分离菌株对头孢噻肟、头孢噻吩及青霉素具有耐药性,对阿米卡星、庆大霉素和链霉素等氨基糖苷类抗生素,对呋喃唑酮、环丙沙星、卡那霉素和头孢他啶等药物敏感(表3)。对分离菌株进行4 种耐药基因检测,可检测到bla-OXA1/4/30、bla-CTX-M和bla-SHV三种耐药基因(图4)。
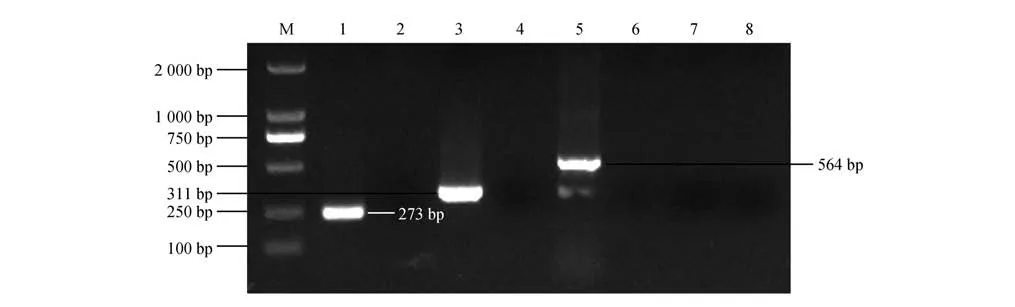
图4 分离菌株的耐药基因检测结果Fig.4 Antibiotic resistance genes amplification results of the isolate

表3 分离菌株的药敏试验结果Tab.3 The results of drug sensitivity test
3 讨论
作为人兽共患病病原微生物,弗格森埃希菌感染人和动物的病例在世界各地均有报道,由于抗生素药物的广泛使用,弗格森埃希菌的耐药性水平也日渐升高。因此,对弗格森埃希菌耐药基因进行检测,研究耐药表型的变化能够为该菌的治疗和防控提供参考。2010年Lagacé-Wiens等[19]首次分离得到表达ESBLs 的弗格森埃希菌菌株。2016 年Simmons等[26]从鸡泄殖腔和盲肠样本中收集到245 株弗格森埃希菌分离株,经药敏试验和耐药基因检测后发现最常见的耐药抗生素是氨苄西林、链霉素和四环素,而携带基因blaCMY2、blaCEM、blaACT、blaSHV和blaCTX-M-15的检出率分别为94.5%、24.4%、6.3%、4.7%和3.2%。Rayamajhi 等[21]发现2008—2009 年部分分离菌株携带CTX-M-15 质粒复制子,耐药基因的传播是导致许多耐药菌株不断出现的原因之一[27-28],而弗格森埃希菌可能与大肠埃希菌相似,在耐药基因的传播链中发挥着重要作用。
目前,弗格森埃希菌在我国食用动物中的流行情况、流行特征及耐药性已有研究报道[22],但在野生动物上的报道较为少见。2005年,Herráez等[29]从成年鸵鸟(Struthio camelus)肠道中分离出弗格森埃希菌;2015 年,叶泥等[30]从野生扭角羚(Budorcas taxicolor)肝脏中分离出1 株弗格森埃希菌,仅对氨苄西林有强耐药性;2021 年,Gracy 等[31]从黑髯墓蝠(Taphozous melanopogon)肠道中分离得到1 株能够降解甲壳素的弗格森埃希菌。本试验首次从死亡林麝体内分离纯化出1 株林麝源弗格森埃希菌,并选用15 种抗菌药物进行药敏试验,发现分离菌株对头孢噻肟、头孢噻吩及青霉素具有耐药性,对氨基糖苷类药物、喹诺酮类敏感,对氨基青霉素类中介。由于青霉素、头孢噻肟及头孢噻吩同属于β-内酰胺类抗生素,随后对分离菌株进行ESBLs 的检测。ESBLs 种类较多,主要包括Temoneira(TEM)、Sulfhydryl variable(SHV)、Cefotaxime(CTX-M)和 Oxacillinase(OXA)等,并且以上述4 种β-内酰胺酶最为常见。SHV因对头孢噻吩中巯基的水解作用而得名[32],携带SHV型耐药基因的菌株对第三代头孢菌素呈现多重耐药性,例如头孢他啶、头孢噻吩,大多数肠杆菌科(Enterobacteriaceae)细菌、绿脓杆菌和鲍曼不动杆菌(Acinetobacter baumannii)等常携带SHV耐药基因[33-34]。CTX-M存在于不同的肠杆菌科细菌中,最常见的宿主菌是大肠埃希菌,其次是肺炎克雷伯氏菌(Klebsiella pneumoniae)及沙门氏菌(Salmonella)[35],而携带CTX-M型耐药基因的菌株能够水解头孢噻吩和头孢噻肟[36]。OXA主要存在于绿脓杆菌中[37],其中OXA-1型耐药基因能够降低对头孢匹罗和头孢吡肟的敏感性[38]。耐药基因检测结果显示,分离菌株携带bla-OXA1/4/30、bla-CTX-M和bla-SHV三种耐药基因,与该分离菌株对青霉素、头孢噻吩和头孢噻肟的耐药性密切相关。
根据测序结果发现,分离菌株携带的bla-OXA1/4/30、bla-CTX-M和bla-SHV三种耐药基因分别由绿脓杆菌、大肠埃希氏菌和肺炎克雷伯氏菌的基因组所编码,表明耐药基因在不同菌株间转移的现象十分普遍。
4 结论
本试验从死亡林麝的脏器样本中分离得到1 株弗格森埃希菌CD20200904,该菌株经细菌分离培养、革兰氏染色镜检、生化鉴定和16S rDNA 基因测序及分析等试验鉴定,表明其为弗格森埃希菌,该菌对头孢噻肟、头孢噻吩及青霉素具有耐药性,并且携带bla-OXA1/4/30、bla-CTX-M和bla-SHV三种耐药基因。

