辣椒CUL家族基因的鉴定与表达分析
刘 芳, 段盼盼, 魏 敏, 匡小妍, 马 艳, 张 涛, 马玉虎, 魏兵强
(甘肃农业大学园艺学院,甘肃 兰州 730070)
辣椒(CapsicumannuumL.)在世界范围内被广泛种植,在种植的早期,主要用于调味和作为药用植物。如今,辣椒被鲜食或加工成蔬菜和香料。辣椒也被视为观赏植物,其提取物被用于各种医药产品和化妆品中[1]。辣椒对逆境胁迫反应敏感,具有喜温不耐热的特性。干旱、低温、高盐等胁迫会严重影响辣椒的生长发育和代谢调控,进而导致辣椒产量与品质的下降[2]。缺水、干旱和高盐等非生物胁迫因素会对植物生产力产生破坏性影响,因为它们会导致蛋白质变性,并损害叶绿体[3]。研究发现,辣椒在营养生长阶段,更容易受到干旱胁迫带来的危害[4];在盐胁迫下,辣椒的多项生理指标都受到负调节作用[5];低温弱光可抑制辣椒幼苗的生长和光合特性[6]。植物在受到这些逆境胁迫时会产生防御机制,例如:植物受到干旱胁迫会形成坚硬的叶子,不会因萎蔫而受到永久性损害,气孔变小和数量的减少也是干旱条件下植物生存的另一种适应[7]。外源脱落酸(ABA)能够显著提高超氧化物歧化酶(SOD)和过氧化物酶(POD)活性及其基因表达水平,进而增强辣椒对低温诱导氧化胁迫的抵抗性[8]。富含水飞蓟素的蜂蜜作为一种天然的多生物刺激剂,可以通过重塑抗氧化防御系统和提高植物生产力来减轻辣椒植物的盐胁迫效应[9]。在辣椒的生长发育过程和生产中经常遭到干旱、盐碱和低温等胁迫,导致辣椒的品质下降、产量降低[10],所以对辣椒响应逆境胁迫中的功能方面的研究很有必要。
CUL蛋白是一种分子支架,在涉及泛素的细胞蛋白质的翻译后修饰中起着关键作用。在真核生物中,CUL蛋白(特别是Cullin-4)因其在介导蛋白质泛素化中的作用而闻名,与形成E3连接酶或Cullin RING连接酶(CRL)的复合物的多种细胞成分结合[11]。CUL基因参与水稻植株的生长和发育,在胁迫响应中也起着重要作用,植物中CUL基因的突变会导致植物表型受干扰[12-13]。前人研究发现,CUL家族是一类在进化上非常保守的蛋白质家族,酵母中CDC53是最早被发现的CUL蛋白[14]。目前在酵母中发现3个CUL基因,线虫有6个CUL基因(CUL1~CUL6)[15],果蝇中有5种CUL基因(CUL1~CUL5)[16]。人类基因组中共发现9个CUL基因,分别为Cullin1、Cullin2、Cullin3、Cullin4A、Cullin4B、Cullin5、Cullin7以及Cullin类似基因(PARC、APC2)[16]。CUL基因在植物中也广泛存在,目前已在水稻中鉴定了13个CUL基因[11];在拟南芥中发现5个CUL基因[16];从矮牵牛雄蕊中共鉴定出8个CUL基因,其中5个为Cullin1类型,2个为Cullin3类型,1个为Cullin4类型[17]。CUL家族基因参与植物生长发育、细胞周期调控、花粉的自交不亲和性以及植物的免疫反应等过程,在植物的整个生命过程中发挥重要作用[18]。对辣椒中CUL基因的研究尚未见报道。本研究对辣椒CUL基因家族进行生物信息学以及表达模式分析,将帮助我们全面了解CUL基因家族的生物学功能。
1 材料和方法
1.1 辣椒CUL基因家族成员的鉴定
根据已报道的文献获得了水稻CUL家族的基因账号(ID)[11]。首先,从水稻基因组数据库(http://rice.uga.edu/)中下载水稻的CUL蛋白序列。然后,使用隐马尔可夫模型(HMM)在线工具(HMMER v3.3.2,http://hmmer.janelia.org/)初步获得辣椒的CUL蛋白。根据水稻的CUL蛋白序列,通过茄科植物基因组数据库(sol genomics network)中的辣椒品种遵辣1号基因组数据库进行BLASTP搜索[19]。使用Pfam蛋白家族数据库(Pfam:Home page(xfam.org))[20]和SMART[SMART:Main page(embl heidelberg.de)][21]在线工具验证辣椒的CUL候选基因。为了进一步了解CUL蛋白物理和化学性质,我们使用ProtParam(ExPASy Compute pI/Mw工具)[22]预测辣椒CUL蛋白的等电点(pI)和相对分子质量(Mw)。利用Euk-mPLoc 2.0服务器(sjtu.edu.cn)预测亚细胞定位[23]。
1.2 系统发育树的构建和分析
对辣椒、拟南芥、番茄和马铃薯CUL蛋白序列使用ClustaW进行多序列比对。系统发育树使用MEGA-X中的最大似然法(Maximum likelihood)构建。在系统发育树中,将参数设置为:bootstraps重复次数1 000,其余设置选择默认选项。然后通过Evolview (https://evolg enius.info/evolview-v2)[24]显示结果。
1.3 染色体定位、基因结构、保守基序和启动子顺式作用元件分析
利用Mapchart 2.2对辣椒染色体上CUL基因的物理位置进行定位,绘制物理位置图。使用在线工具GSDS 2.0(http://gsds.cbi.pku.edu.cn/)显示基因结构。通过在线软件 (http://meme-suite.org/index.html)预测CaCUL的保守基序[25]。使用TBtools提取CaCUL基因起始密码子上游2 000 bp的区域。然后,通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库预测每个CaCUL启动子中的顺式作用元件。
1.4 共线性分析
我们使用MCScanX分析辣椒和拟南芥CUL基因的共线性,用Circos软件(http://circos.ca/software/download/circos/)展示CUL基因的共线性关系图。
1.5 材料及CUL家族基因的表达谱分析
通过PepperHub(http//pepperhub.hzau.edu.cn/)数据库下载辣椒CUL基因的不同组织及不同发育阶段、激素和非生物胁迫的转录组数据,获得基因表达量[26],最后使用TBtools绘制表达量热图。
2 结果与分析
2.1 辣椒CUL基因成员的鉴定与分析
在辣椒基因组中共鉴定出12个CUL基因,并根据与拟南芥CUL基因的序列相似性对12个基因进行了命名(表1)。CaCUL的编码序列(CDS)长度为777~2 952 bp。CaCUL蛋白由258~983个氨基酸组成,相对分子质量大小为29 553 240~114 416 790。CUL蛋白家族成员的等电点为5.28~8.65;CaCUL4.3的等电点最高(8.65),CaCUL1.5的等电点最低(5.28)。CaCUL的不稳定性指数均大于40.00,其蛋白质相对不稳定。此外,其蛋白质亲水性平均系数(GRAVY)范围为-0.507(CaCUL3A.2)~-0.094(CaCUL1.7),表明它们是亲水性蛋白质(GRAVY<0)。亚细胞定位结果表明,所有CUL都被预测位于细胞质和细胞核。CaCUL4.2具有双重定位(细胞质和细胞核),CaCUL3A.1、CaCUL4.1、CaCUL4.3、CaCUL3A.2、CaCUL1.5、CaCUL1.7蛋白均位于细胞质。CaCUL1.1、CaCUL1.2、CaCUL1.3、CaCUL1.4、CaCUL1.6均位于细胞核。
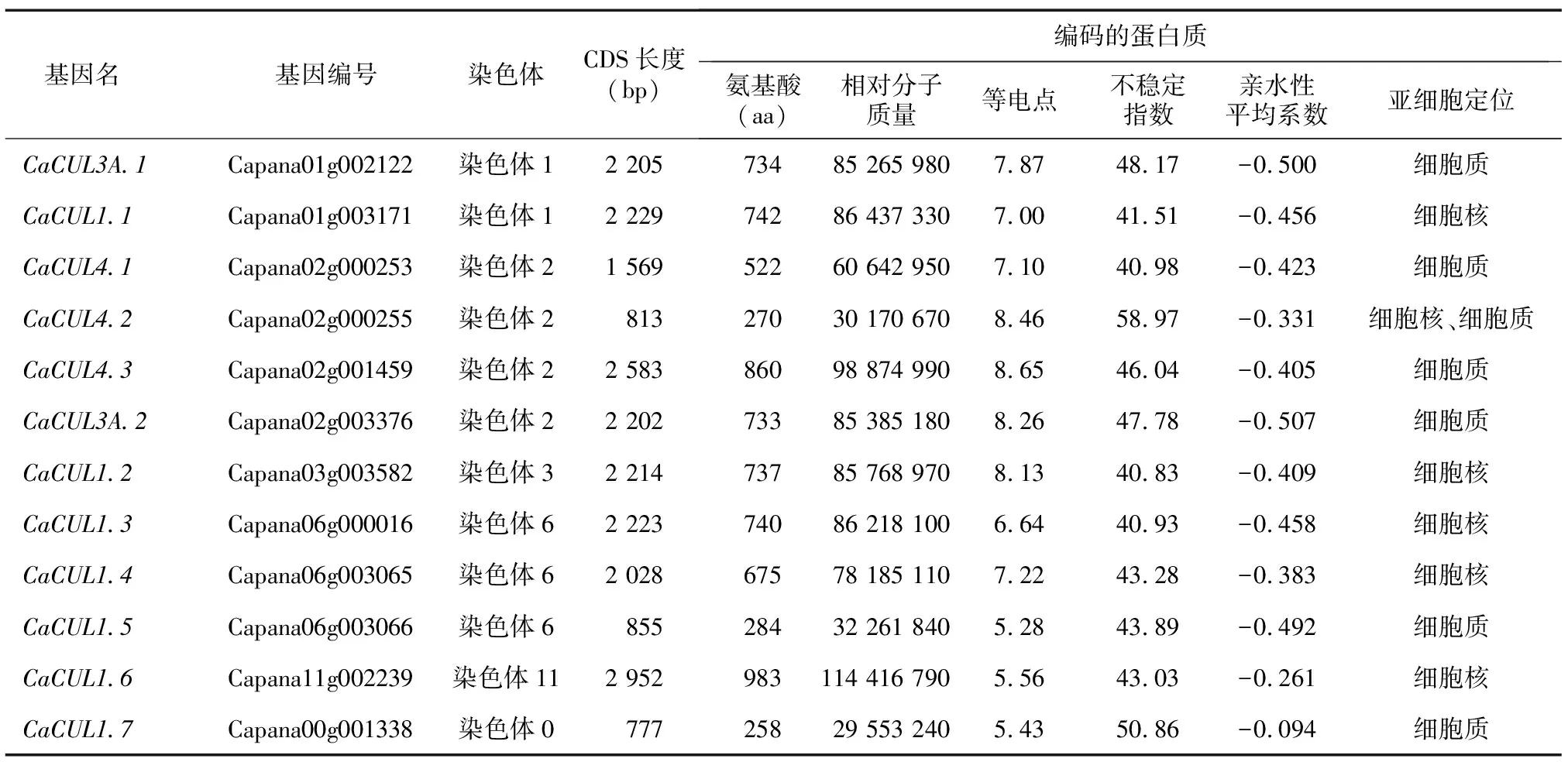
表1 辣椒CaCUL基因家族编码的蛋白质理化性质
2.2 辣椒CUL基因家族的染色体位置和系统发育树分析
辣椒CUL基因随机且不均匀地分布在1号、2号、3号、6号、11号、0号染色体上(图1)。第2条染色体上有4个基因,分布密度较高;第6条染色体上有3个基因,其余每条染色体上只有1~2个基因。

图1 辣椒CUL基因家族在染色体上的分布
为了更好地理解辣椒和其他植物物种之间的进化关系,在5个拟南芥CUL基因、12个辣椒CUL基因、16个马铃薯CUL基因和18个番茄CUL基因编码的蛋白质之间构建了一个系统发育树(图2)。系统发育树分支显示,CaCUL基因家族共分为4个亚家族,其中第1亚族只有CaCUL1.2和CaCUL1.62个基因;第2亚族有4个基因,占CaCUL基因家族总数的33.3%;第3亚族无CUL基因;第4亚族有6个基因,在CaCUL基因家族中占比最大,为50.0%。系统发育树进化距离表明,辣椒与双子叶植物番茄的亲缘关系最近。
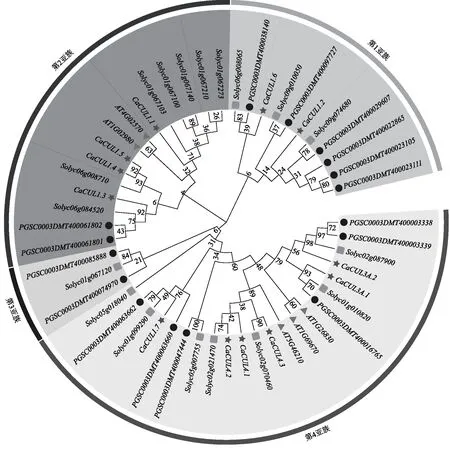
五角星、正方形、圆形和三角形分别代表辣椒、番茄、马铃薯和拟南芥,数字表示进化距离。
2.3 辣椒CUL基因家族的基因结构和保守基序及其编码的蛋白质结构域分析
外显子/内含子模式分析结果(图3)表明,所有CaCUL基因的编码序列都包含内含子,CaCUL基因的内含子数量在1到18个之间,CaCUL1.1、CaCUL1.2、CaCUL1.3具有的内含子数目最多。CaCUL3A.1、CaCUL3A.2仅有1个内含子。辣椒CUL基因序列中共鉴定出10个保守基序(图4A),motif 1、motif 4分布得最多。CaCUL3A.1、CaCUL3A.2、CaCUL1.1、CaCUL1.2、CaCUL1.3含所有保守基序,motif 10在CaCUL4.3中缺失,motif 8在CaCUL1.4中缺失,而CaCUL4.2只有motif 4。保守结构域分析结果(图4B)表明,所有CaCUL蛋白均含有Cullin结构域,但有4个成员(CaCUL1.5、CaCUL1.6、CaCUL1.7和CaCUL4.2)缺少Cullin-Nedd8结构域,而且只有CaCUL1.6有NB-ARC结构域。

图3 辣椒CUL基因家族基因结构分析
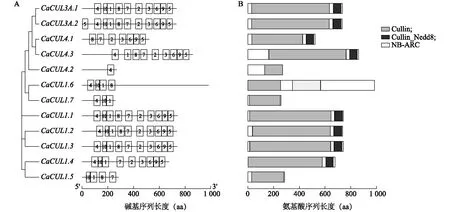
A图中方框中的数字表示motif序号。
2.4 辣椒CUL基因家族的启动子顺式作用元件分析
在本研究中,为了分析CaCUL启动子内的顺式作用元件,从TBtools中检索了每个CaCUL基因起始密码子(ATG)上游的2 000 bp序列。顺式作用元件借助PlantCARE数据库预测。使用Microsoft Office Excel软件处理数据,然后构建表格和图表。结果表明,有9个顺式作用元件主要对低温和非生物胁迫作出反应(图5)。植物响应低温、激素信号的顺式元件普遍存在于CaCUL的启动子区域。这些顺式作用元件包括脱落酸反应元件、茉莉酸甲酯反应元件、水杨酸反应元件、生长素反应元件和赤霉素反应元件,表明这些激素可能调节CaCUL的表达。值得注意的是,厌氧诱导响应元件广泛存在于CaCUL1.2中,提示CaCUL1.2可能受到厌氧诱导信号的调控;茉莉酸甲酯响应元件在CaCUL4.1中广泛存在,CaCUL4.1可能受到茉莉酸甲酯信号的调控。分析结果表明,CaCUL可能参与辣椒的生长发育调控,以及在响应低温和非生物胁迫等方面发挥重要作用。
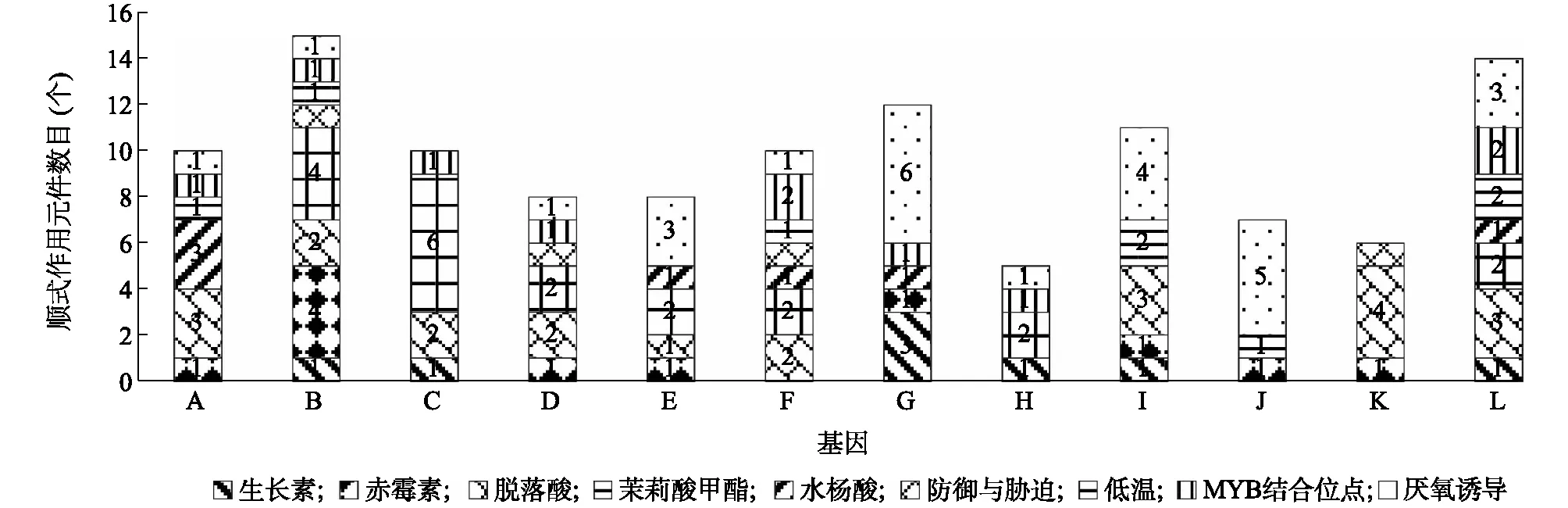
A:CaCUL3A.1;B:CaCUL1.1;C:CaCUL4.1;D:CaCUL4.2;E:CaCUL4.3;F:CaCUL3A.2;G:CaCUL1.2;H:CaCUL1.3;I:CaCUL1.4;J:CaCUL1.5;K:CaCUL1.6;L:CaCUL1.7。
2.5 辣椒CUL基因家族的共线性分析
本研究构建了辣椒与拟南芥的共线图,以进一步推测CUL家族的系统发育机制。在辣椒CUL基因内,存在1对共线基因对(CaCUL1.2和CaCUL1.3)(图6A)。在辣椒与拟南芥CUL基因间,存在5个共线基因对。共有4个CaCUL基因与4个拟南芥CUL基因表现出共线性关系,其中CaCUL1.2与AT1G02980,CaCUL1.2和AT4G02570共线,CaCUL1.4与AT1G02980共线,CaCUL4.3与AT5G46210;CaCUL3A.2与AT1G69670共线(图6B)。
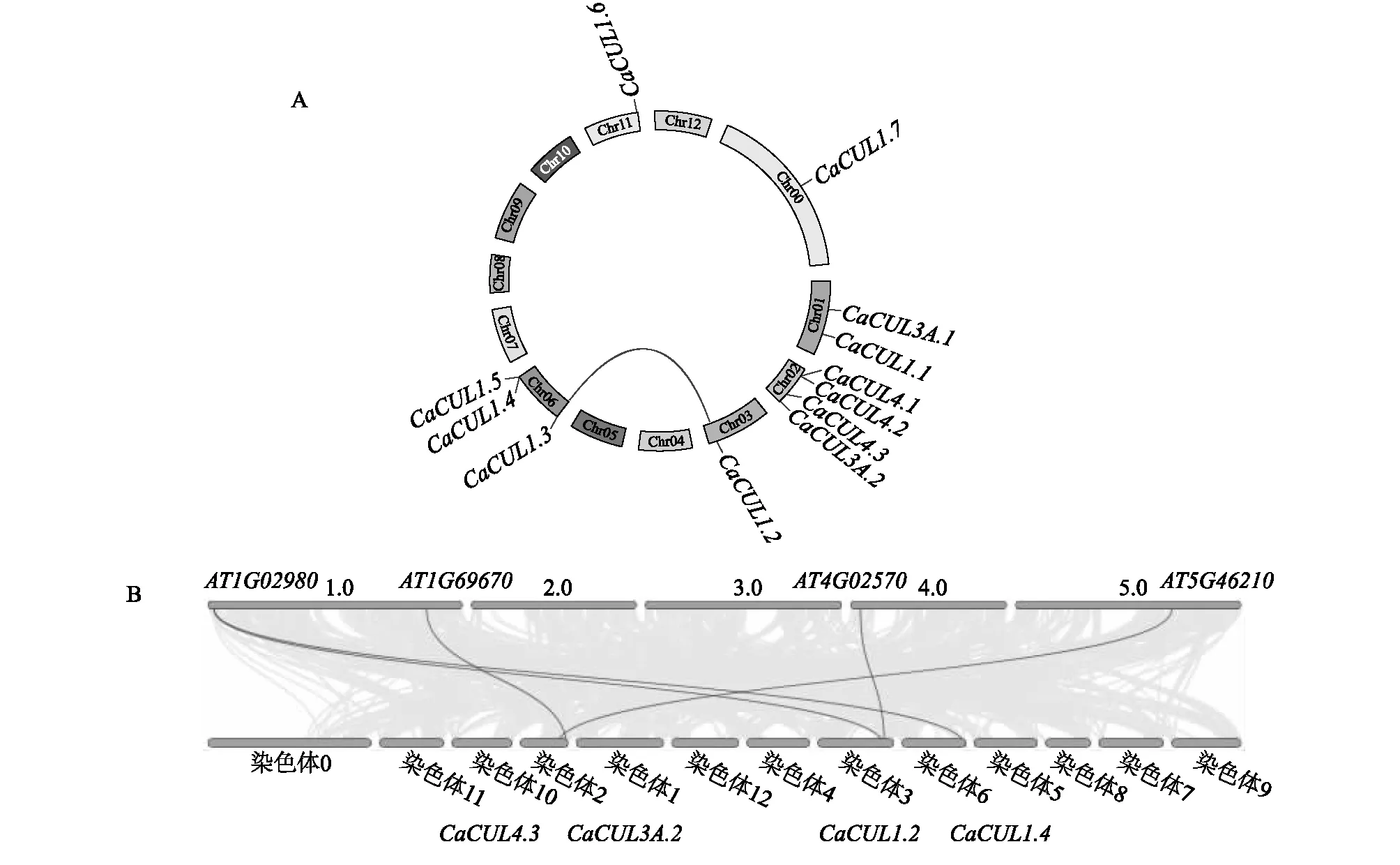
图6 CUL基因共线性分析
2.6 CaCUL基因的表达模式分析
2.6.1CaCUL基因在不同组织中的表达模式分析 辣椒CUL基因在不同生长阶段、不同组织中存在明显的表达差异(图7),CaCUL1.3的相对表达量整体较高,在成熟的根、授粉后55 d的胎座、授粉后60 d的种子中高表达,且在成熟的根中的相对表达量约为幼叶的6倍,表明CaCUL1.3可能参与了根的发育。相反,CaCUL1.6在所测组织中相对表达量较低。此外,CaCUL1.5在F5~F7阶段都有表达,在F7(花蕾大小为1.20 cm)中的相对表达量最高,而在其他组织中几乎不表达,这一结果进一步表明,CaCUL1.5可能与花的发育有关。CaCUL1.1在授粉后50 d、55 d、60 d的果皮和授粉后55 d的胎座中的相对表达量略高于其他组织。而CaCUL1.4基因在这些组织中的相对表达量很低甚至不表达,由此推测CaCUL1.4基因在辣椒这些组织中不具有组织表达特异性。
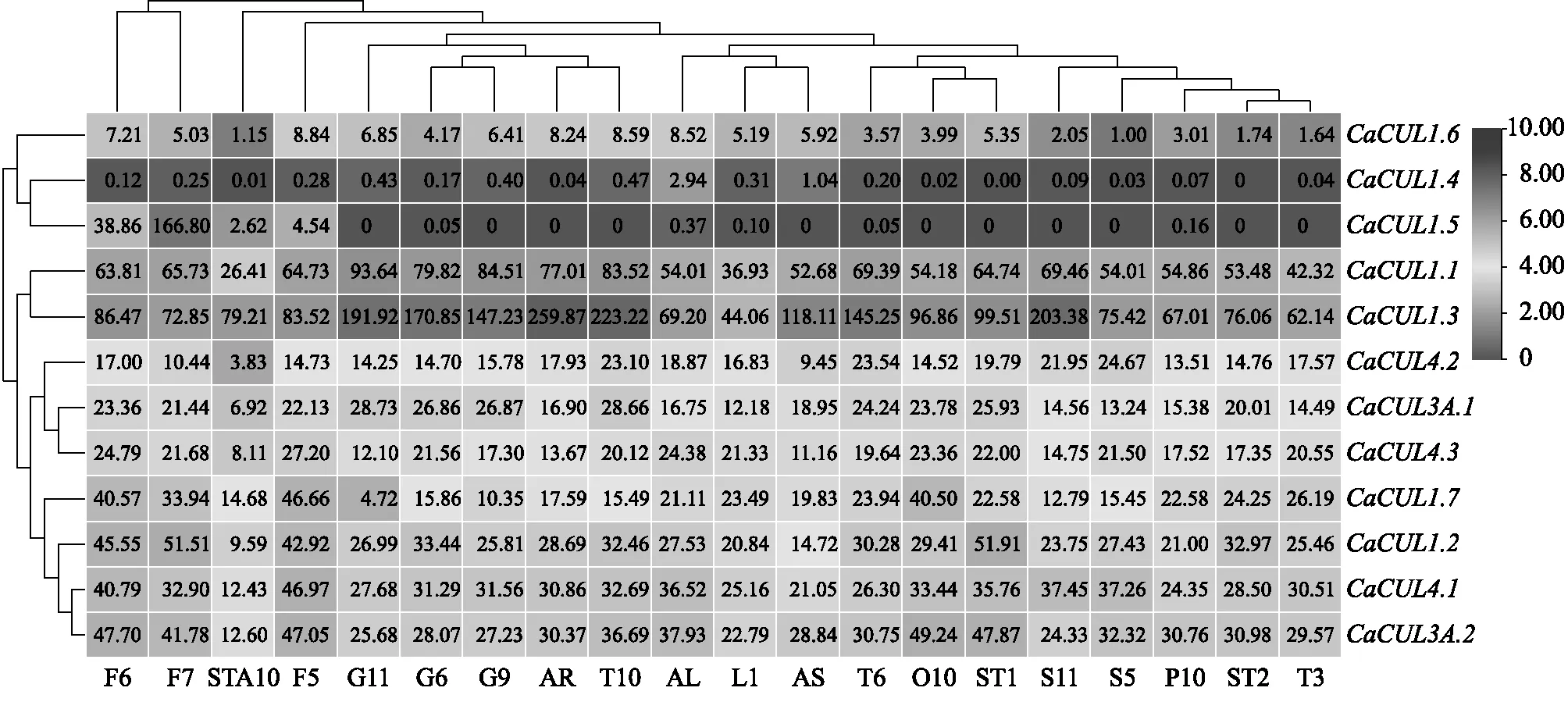
L1:幼叶;AL:成熟的叶;AR:成熟的根;AS:成熟的茎;F5:花蕾大小为0.80 cm的花;F6:花蕾大小为1.00 cm的花;F7:花蕾大小为1.20 cm的花;P10:花瓣;O10:子房;STA10:花药;G6:授粉后35 d的果皮;G9:授粉后50 d的果皮;G11:授粉后60 d的果皮;ST1:授粉后10 d的胎座和种子;ST2:授粉后20 d的胎座和种子;S5:授粉后30 d的种子;S11:授粉后60 d的种子;T3:授粉后20 d的胎座;T6:授粉后35 d的胎座;T10:授粉后55 d的胎座。图中数据表示相对表达量。
2.6.2CaCUL基因在低温、NaCl处理下的表达模式分析 由图8可知,低温处理后CaCUL1.1、CaCUL1.3、CaCUL1.6、CaCUL4.2在叶片中表达量下调,表达受到抑制;与对照相比,CaCUL1.1、CaCUL1.2、CaCUL1.6、CaCUL4.2和CaCUL4.3在根中上调表达。在经过低温处理1.5 h后,CaCUL1.3基因在辣椒根中的表达量显著上调,达到峰值,其表达量在处理12.0 h后又下降,但与对照差距不大。低温处理后CaCUL1.3基因在辣椒叶片中的表达量呈现持续下降趋势。低温处理后CaCUL1.1在辣椒根中的表达量上调,在处理12.0 h后下降。CaCUL1.4和CaCUL1.5基因在低温处理后没有显著变化,说明这2个基因不参与低温调控机制,对低温胁迫没有应答反应。
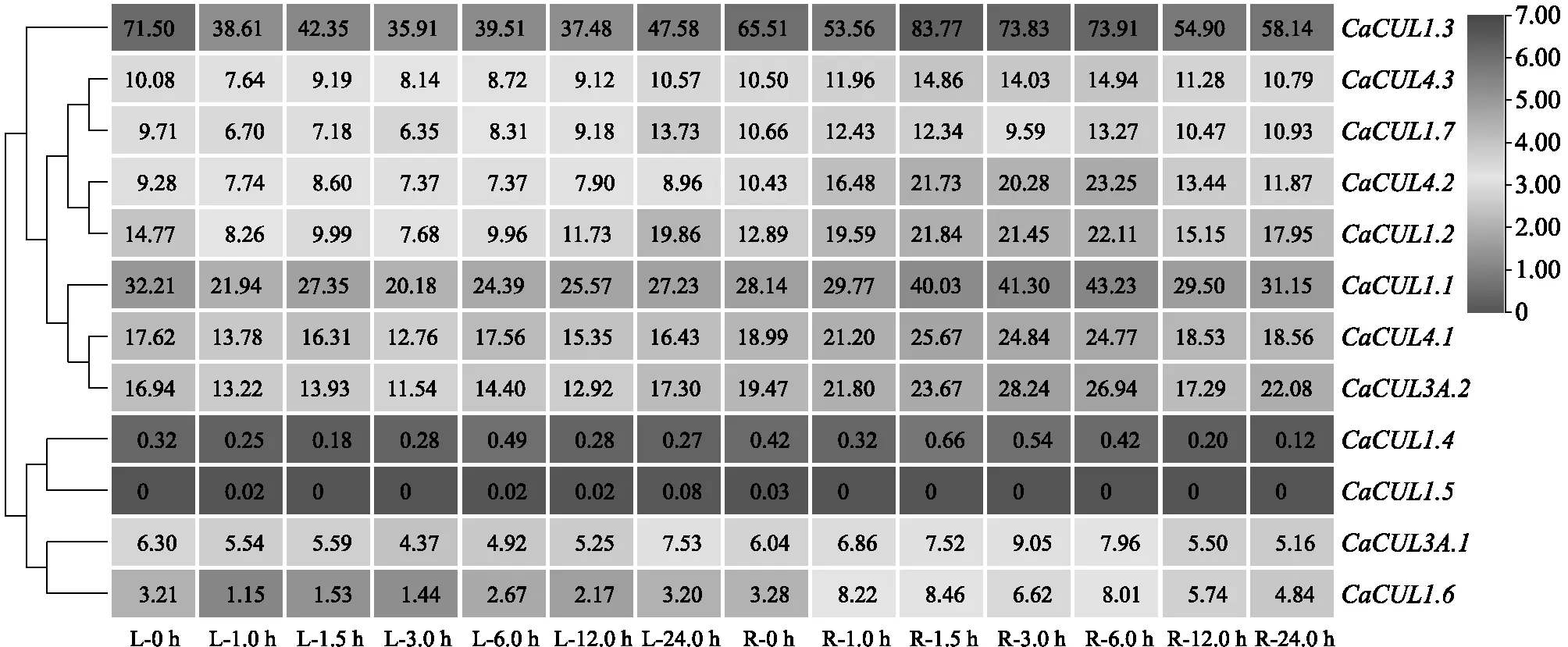
L:叶; R:根。图中数据表示相对表达量。
在NaCl处理下,辣椒CUL基因家族在不同时间点的根和叶片中表达量存在差异(图9)。大部分基因在根中上调表达,其中,CaCUL1.3在根中上调表达最显著,在处理1.0 h时达到最大值,约为对照的1.5倍,而在辣椒叶片中的表达水平在处理后下调。在NaCl处理下CaCUL3A.2、CaCUL4.1、CaCUL1.1和CaCUL1.2基因在辣椒根中的表达量整体上随着处理时间的延长逐渐上调。经NaCl处理后,CaCUL1.3、CaCUL3A.1、CaCUL1.1、CaCUL1.6、CaCUL4.2、CaCUL1.7和CaCUL1.2基因在叶片中的表达量整体上都显著下调,而在根中正好相反,说明这7个基因受盐胁迫处理后在叶片和根中行使了不同的功能。经NaCl处理后,CaCUL1.4和CaCUL1.5基因在2种组织中表达量无明显变化,表明这2个基因在叶片和根中对盐胁迫没有应答反应。
3 讨论
本研究在辣椒基因组中共鉴定了12个CUL基因,分别分布在1号、2号、3号、6号、11号、0号染色体上。据报道,在水稻中鉴定了13个CUL基因[11],在拟南芥中发现5个[16],在矮牵牛雄蕊中共鉴定出8个CUL基因[17],在扁桃中发现有15个PsdCUL成员[27]。亚细胞定位分析结果表明,所有CUL都被预测位于细胞质和细胞核中。前人研究结果表明,AtCUL1蛋白主要定位在细胞核中,但也有少量定位在细胞质中[11];小麦中发现有25个CUL蛋白位于细胞核中,2个位于细胞质中,12个具有双重定位(细胞核和细胞质)[18],故推测CUL蛋白家族主要在细胞质和细胞核中发挥作用。系统发育树分析结果显示,辣椒CUL基因和番茄CUL基因之间同源性很高,进化关系很近,这可能是由于辣椒和番茄都属于双子叶茄科植物,本研究结果与马铃薯CUL1和番茄的亲缘关系最为密切,这是因为它们都属于茄科植物[28]。本研究预测到辣椒CUL基因家族共有10个保守基序,在各CUL基因中都有分布,属于高保守基序;研究发现不同亚族之间保守基序的相似性与亚族间的系谱进化密切相关,辣椒CUL基因家族除了个别基因之间的基序分布和数量存在差异外,各亚族保守基序大部分相同,表明辣椒CUL基因家族在进化过程中具有高度保守性。保守结构域分析结果表明,CaCUL蛋白含有Cullin、Cullin-Nedd8、NB-ARC 3种结构域,且高度保守,这与扁桃的CUL家族,马铃薯CUL1的相关研究结果相似[27-28]。Hori等[29]研究发现,Nedd8结构域与CUL的连接激活了它们的E3连接酶介导的泛素化活性。根据辣椒中3个CUL基因缺失Nedd8结构域推测这些蛋白质不介导E3连接酶活性。
顺式作用元件参与调控植物体内各种生物过程中基因的表达,在植物生长发育及其对非生物或生物应激反应、激素响应等方面发挥重要作用[30-34]。水稻等作物中CUL家族成员上游2 000 bp启动子序列中存在着大量的激素等胁迫响应元件,且CUL的差异表达与分布在其启动子区域的多个应激和信号响应元件的存在相关[11];在扁桃PsdCUL启动子序列上也发现激素类和抗逆类等胁迫响应元件[27],这与本研究结果相一致。CaCUL启动子区含有多种顺式作用元件,研究结果表明,CaCUL可能受激素和胁迫调控,且在植物生长、发育及抗逆等方面发挥重要作用。另外发现,辣椒CUL和拟南芥CUL之间存在共线性关系,这将有助于推测CaCUL基因功能。在辣椒CUL基因中发现1对片段复制基因。基因家族成员的扩增主要依赖于基因复制[35],在扁桃PsdCUL基因中发现,具有2对片段复制基因,PsdCUL家族成员在进化上发生复制扩增现象[27]。这与本研究结果相似,表明CaCUL家族成员在进化上可能也发生了复制扩增现象。
对辣椒CUL基因家族成员的组织表达模式进行分析,结果发现CUL基因表达模式具有差异。这表明它们在辣椒的生长发育过程中可能起着不同的作用。对CaCUL基因组织特异性表达分析发现,CaCUL1.3在成熟的根中表达量最高,其次是授粉后55 d的胎座、授粉后60 d的种子和果皮以及授粉后35 d的果皮,有研究发现水稻OsCUL1基因在种子中高表达[36],以上结果表明CUL可能与辣椒根和种子的生长发育密切相关,这还需要进一步研究来证实。此外,CaCUL1.5在F7(花蕾大小为1.20 cm)中的表达量最高,而在其他组织中几乎不表达。这一结果进一步表明,CaCUL1.5可能在花的发育过程中扮演重要的调控作用。CaCUL基因家族成员具有一定的组织特异性,说明其在辣椒不同器官组织中发挥特定的作用。
在不同植物中相同基因具有多种调控机理,且在应对低温和盐分等非生物胁迫时的表达也表现出差异性。辣椒大部分CUL基因响应低温应答。据报道,OsCUL1-3受到冷胁迫诱导表达水平特异性上调[36],这与本结果相似。CaCUL1.3基因在经过低温处理1.5 h后在辣椒根中的表达量显著上调,达到峰值。CaCUL1.4和CaCUL1.5基因在低温处理后表达量没有显著变化,这说明这2个基因不参与低温调控机制。NaCl处理后,辣椒大部分CUL基因在根中表达量上调,在叶片中部分CUL基因表达量下调,表达受到抑制。尤其是CaCUL1.3在NaCl处理1.0 h时在根中表达量达到最大值,但随着处理时间的延长,表达量整体呈下降趋势;CaCUL1.3在低温和盐胁迫下在辣椒根中的表达量都具有显著上调趋势,表明CaCUL1.3可能是提高辣椒耐低温和耐盐能力的一个潜在基因。CaCUL家族基因受到低温、盐处理的诱导表达水平发生变化,说明CUL可能参与调节植物适应不良环境的过程,在应对不同胁迫时其表达模式的复杂程度也不同。据报道OsCUL1基因受到各种非生物胁迫(盐、热和干旱)上调表达[36]。本研究发现,CUL在胁迫处理下的差异表达与它们的启动子区域中存在各种顺式元件一致,进一步表明它们除了非生物胁迫反应外,还参与生长和发育,这与水稻CUL家族的相关研究结果相似[11]。
4 结论
本研究鉴定了12个辣椒CUL基因家族成员,并分析了它们的系统发育关系、基因结构、保守基序、结构域以及顺式作用元件。结果表明,CaCUL基因家族在进化过程中高度保守。顺式元件的分析结果表明,CaCUL基因有多种低温、激素和应激反应元件。共线性分析结果表明,辣椒和拟南芥的CaCUL基因家族之间有5对共线性基因对,CaCUL基因之间有1对片段重复基因对。表达量数据分析结果表明,CaCUL1.3在辣椒根中表达量最高,CaCUL1.5在F7(花蕾大小为1.20 cm)中的表达量最高。辣椒大部分CUL基因对低温及盐胁迫有应答反应,低温处理下CaCUL1.1、CaCUL1.3、CaCUL1.6、CaCUL4.2在叶片中表达受到抑制,表达量下调;CaCUL1.3基因在经过低温和盐胁迫处理后在辣椒根中上调表达。上述结果证明,CaCUL基因在辣椒生长、发育及应对非生物胁迫中发挥着重要的作用。

