植物中绿原酸生物合成研究进展
宿子文, 蔡志翔, 孙 朦, 沈志军, 马瑞娟, 俞明亮, 严 娟
(1.江苏省农业科学院果树研究所/江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014;2.南京农业大学园艺学院,江苏 南京 210095)
绿原酸(Chlorogenic acid,CGA)是植物体内一种重要的苯丙素类次生代谢产物,主要存在于忍冬科、茄科和菊科植物中。在金银花、杜仲、咖啡等药用植物中,绿原酸的含量非常高[1-2];马铃薯、番茄、胡萝卜等蔬菜中也含有绿原酸[3-6];此外,绿原酸也是众多水果果肉中主要的酚类物质,例如桃[7]、蓝莓[8]、梨[9]、草莓[10]和苹果[11]。作为营养保健品和食品添加剂,绿原酸兼具多种功能。在植物体内,绿原酸通常是以各种同分异构体和衍生物的形式存在,分为单咖啡酰奎尼酸(monoCQA)、二咖啡酰奎尼酸(diCQA)和三咖啡酰奎尼酸(triCQA)等[12]。目前,已有3条绿原酸合成途经被证实,而羟基肉桂酰辅酶A:奎尼酸-羟基肉桂酰转移酶(HQT)催化途径被认为是最主要的合成途径。近年来,随着分子生物学技术的飞速发展,对植物绿原酸生物合成与代谢调控分子机制的研究也取得了一定进展,一些结构基因和转录因子对植物绿原酸生物合成的调控作用也逐渐明晰[3,13]。除了受内部遗传因素的影响外,绿原酸的生物合成还受激素、光照、温度、水分和无机盐等外界因素的影响。本文从绿原酸的生物活性、种类、生物合成以及影响因素这几个方面进行阐述,并对研究方向提出展望,旨在为植物中绿原酸的生物合成研究和开发利用提供理论依据。
1 绿原酸的生物活性
研究结果表明,绿原酸是兼具多种功能的有益成分。一方面,作为一种营养保健品,绿原酸具有抗菌消炎、抗肿瘤、降血糖、降血脂等生物活性,可用于预防和治疗代谢综合征及疾病[14]。另一方面,作为食品添加剂,绿原酸不仅具有清除自由基、抗氧化和保鲜等多种生理活性,可以预防水果蔬菜中酶促褐变[15],而且具有广谱抗菌活性,可抑制和灭杀多种细菌、真菌、酵母菌、霉菌和变形虫,对桃、苹果、猕猴桃和番茄等易发病害的抗病效果显著[16-18]。此外,绿原酸在植物抗逆生理上也发挥着重要作用,可以提高植物消除活性氧和自由基的能力,防御各种低温、干旱、紫外线以及病虫害等生物和非生物胁迫[13]。
2 绿原酸类物质的种类
广义上,绿原酸类物质是指奎尼酸与反式肉桂酸(咖啡酸、香豆酸和阿魏酸)缩合而成的酯类化合物,包括咖啡酰奎尼酸(Caffeoylquinic acid)、对香豆酰奎尼酸(p-Coumaroylquinic acid)和阿魏酰奎尼酸(Feruloylquinic acid)[12]。狭义上,绿原酸是由咖啡酸(Caffeic acid)与奎尼酸(Quinic acid)生成的酚酸类物质,即咖啡酰奎尼酸(Caffeoylquinic acid)。在植物体内,绿原酸通常是以各种同分异构体和衍生物的形式存在,按照咖啡酰的结合数目和位置进行分类,可分为单咖啡酰奎尼酸(monoCQA)、二咖啡酰奎尼酸(diCQA)和三咖啡酰奎尼酸(triCQA)等(表1)。此外,一些酯化的绿原酸也属于绿原酸,如绿原酸甲酯(methyl-3-caffeoylquinic acid)和绿原酸乙酯(ethyl-3-caffeoylquinic acid)[19]。
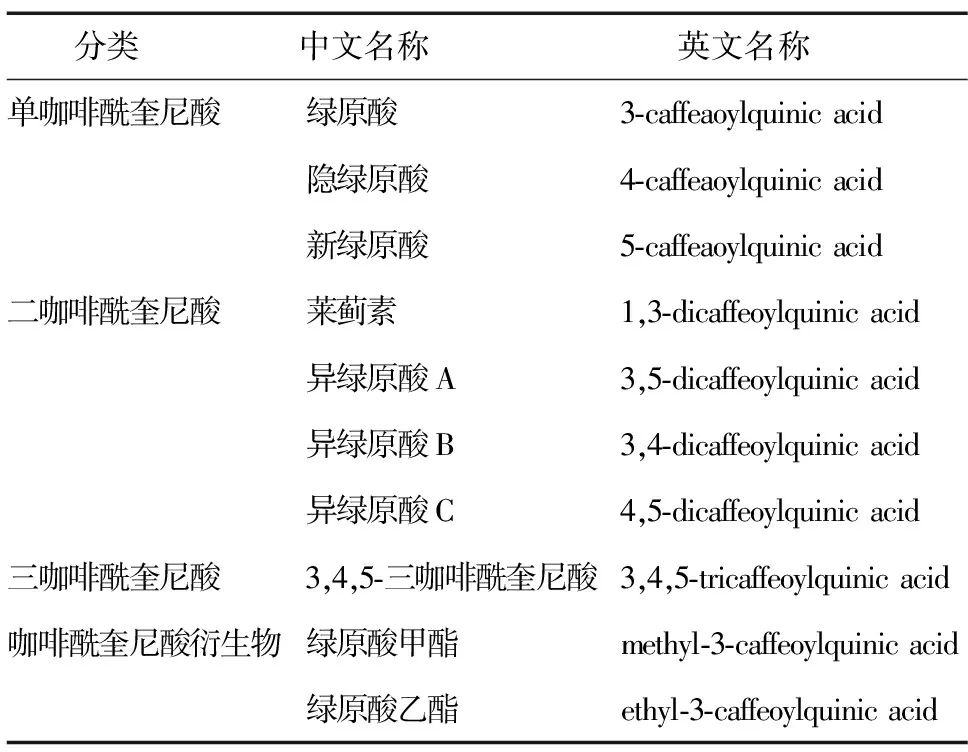
表1 植物中常见的绿原酸类化合物
3 绿原酸的生物合成
3.1 绿原酸生物合成途径
绿原酸的生物合成属于苯丙烷代谢通路,不同的物种可能进化出不同的合成途径,甚至在同一个物种内每种途径的重要性也相对不同,目前,已经有3条绿原酸合成途经被证实(图1)。其中一是羟基肉桂酰辅酶A:奎尼酸-羟基肉桂酰转移酶(HQT,EC 2.3.1.99)催化咖啡酰辅酶A和奎尼酸的酯交换途径,该途径是绿原酸生物合成的主要途径,通过瞬时和稳定转基因技术已在多个富含绿原酸的植物中得到了验证,如烟草、番茄、朝鲜蓟和咖啡[2]。二是羟基肉桂酰辅酶A:莽草酸/奎尼酸-羟基肉桂酰转移酶(HCT,EC 2.3.1.133)和对香豆酸-3-羟化酶,(C3H,EC 1.14.13.36)催化途径[20]。在拟南芥细胞中,HCT和C3H都具有很高的活性,但并未检测到绿原酸,并且HCT对作为酰基受体的奎尼酸没有高亲和力,说明这条途径可能不是绿原酸的主要合成途径[20-21]。三是羟基化肉桂酰D-葡萄糖:奎尼酸羟基化肉桂酰转移酶催化途径。在一些HQT活性较低的细胞器中,咖啡酰苷作为活性中间体,由羟基化肉桂酰D-葡萄糖:奎尼酸羟基化肉桂酰转移酶(HCGQT)催化咖啡酰-D-葡萄糖和D-奎尼酸生成绿原酸,因此推断HCGQT是植物中绿原酸合成途径的最后一个关键酶,目前该途径只在少数植物中发现,如红薯根[22]。

PAL:苯丙氨酸氨解酶;C4H:肉桂酸-4-羟基化酶;4CL:4-香豆酸-辅酶A连接酶;HCT:羟基肉桂酰辅酶A:莽草酸/奎尼酸-羟基肉桂酰转移酶;C3H:对-香豆酸-3-羟化酶;HQT:奎尼酸-羟基肉桂酰转移酶;UGCT:UDP-葡萄糖肉桂酸葡萄糖基转移酶;HCGQT:羟基化肉桂酰D-葡萄糖:奎尼酸羟基化肉桂酰转移酶。①羟基肉桂酰辅酶A:奎尼酸-羟基肉桂酰转移酶催化途径;②羟基肉桂酰辅酶A:莽草酸/奎尼酸-羟基肉桂酰转移酶和对香豆酸-3-羟化酶催化途径;③羟基化肉桂酰D-葡萄糖:奎尼酸羟基化肉桂酰转移酶催化途径。
3.2 绿原酸生物合成相关结构基因
绿原酸的生物合成受其结构基因的影响,这些结构基因可以直接编码绿原酸生物合成途径中的各种生物活性酶(表2),包括苯丙氨酸氨解酶(PAL)、肉桂酸-4-羟基化酶(C4H)、4-香豆酸-辅酶A连接酶(4CL)、对-香豆酸-3-羟化酶(C3H)、羟基肉桂酰辅酶A:莽草酸/奎尼酸-羟基肉桂酰转移酶(HCT)、羟基肉桂酰辅酶A:奎尼酸-羟基肉桂酰转移酶(HQT)、UDP-葡萄糖肉桂酸葡萄糖基转移酶(UGCT)和羟基化肉桂酰D-葡萄糖:奎尼酸羟基化肉桂酰转移酶(HCGQT)[23-25]。这些酶不仅参与绿原酸的生物合成,而且直接或间接地参与催化其他代谢途径的次生代谢物的生物合成,如木质素、花青素、黄酮和生物碱。迄今为止,大多数对于绿原酸合成相关基因的功能研究都基于3种技术:(1)基因表达分析,检查基因表达谱与绿原酸含量的相关性;(2)转基因功能验证,包括过表达(Over-expression,OE)、干扰(Interference)、基因敲除(Knockout,KO)等瞬时或稳定表达;(3)体外酶促反应,通过构建原核或真核表达体系和体外模拟实验,验证基因表达产物的相关功能。
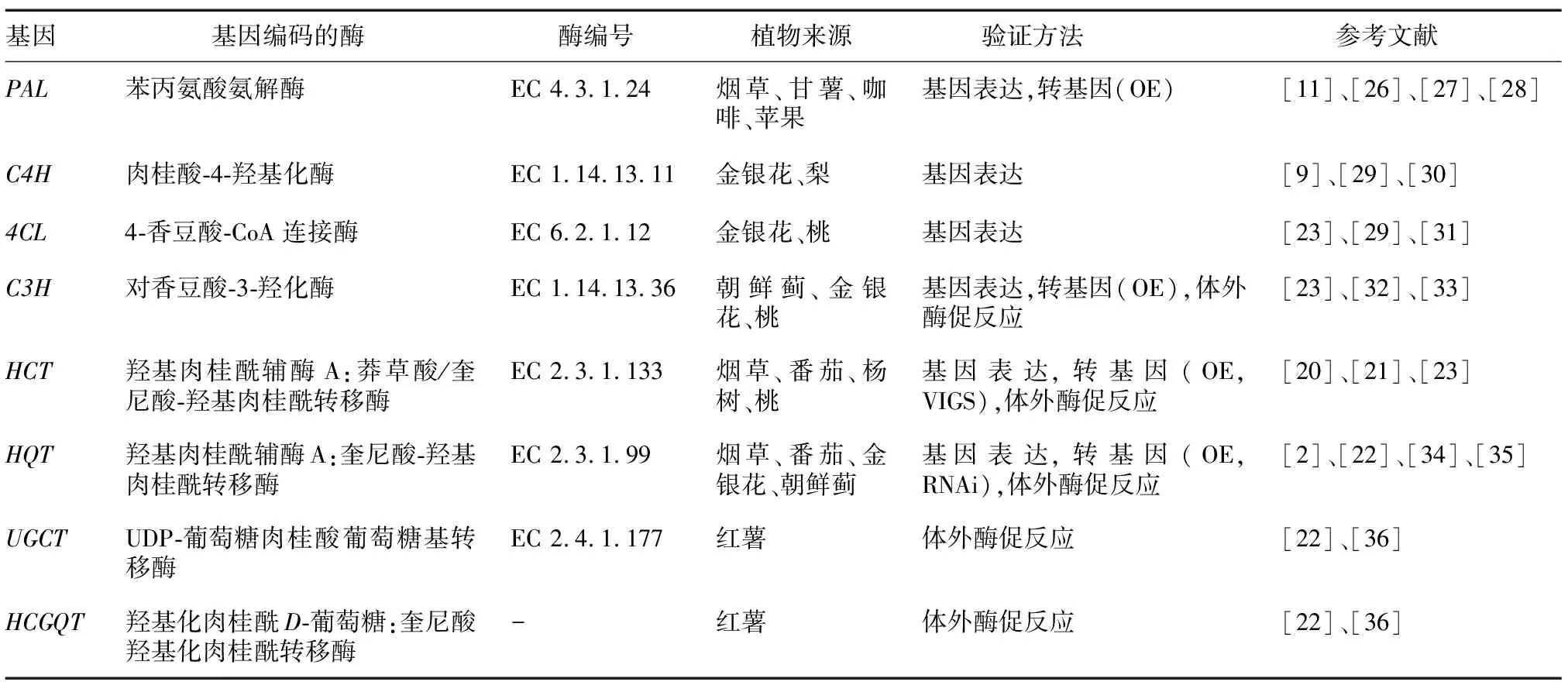
表2 植物中已鉴定的绿原酸生物合成相关结构基因
苯丙氨酸解氨酶(PAL)是苯丙烷代谢途径的第一个酶,也是连接初生代谢和次生代谢途径的重要枢纽。在烟草中,过表达PAL基因显著提高了转基因植株叶片的绿原酸含量[26]。在咖啡中,3个PAL基因被表征并分为2个不同的组,其中CcPAL1和CcPAL3与绿原酸的积累有关,而CcPAL2更多地促进类黄酮的积累[27]。在甘薯中,过表达IbPAL1促进了叶片中绿原酸积累和相关基因的表达,刺激了茎次生木质部细胞扩张,抑制了贮藏根的形成[28]。在苹果中,MdPAL3的转录水平与绿原酸含量显著相关,可能在果实绿原酸积累中发挥重要作用[11]。
肉桂酸4-羟化酶(C4H)属于细胞色素氧化酶(P450)家族中的CYP73A亚家族,能催化肉桂酸生成香豆酸,进而进入苯丙酸类、黄酮类、木质素等化合物的合成途径[37]。C4H参与木质素生物合成途径,缺乏C4H的植物不仅总木质素和木质素单体含量显著降低[38],而且木质素的组成也发生了变化,C4H表达的下调导致紫丁香基木质素(S-木质素)和愈创木基木质素(G-木质素)的比例降低[39]。在梨果实中,木质素的合成受C4H酶活性的影响,C4H基因表达水平与其酶活性呈正相关,植物组织中C4H基因的高表达伴随着较高的木质素含量[9]。在金银花中,LjC4H2已被证明是调节绿原酸含量的关键基因之一[29-30]。
4-香豆酸-CoA连接酶(4CL)位于苯丙氨酸代谢途径终端位置,是连接木质素、绿原酸及黄酮类物质合成代谢下游分支途径的关键酶,可以催化多种羟基肉桂酸衍生物[40]。研究结果表明,拟南芥中4CL基因家族的4个成员可以分为2个亚组,其中组I的成员(At4CL1、At4CL2、At4CL4)主要参与木质素的生物合成;而组Ⅱ的成员(At4CL3)主要参与类黄酮的生物合成[41-42]。在金银花中,Lj4CL2基因与绿原酸等化合物的合成有关[29]。在桃果实中,Pp4CL基因也可能参与了绿原酸的生物合成[23,31]。
对-香豆酸-3-羟化酶(C3H)属于细胞色素氧化酶(P450)家族中的CYP98亚家族,2001年由Schoch等首次从拟南芥中分离得到,参与木质素和绿原酸的生物合成。在木质素合成途径中,C3H主要控制植物中木质素单体的转化[43]。在绿原酸合成途径中,C3H可以分别催化香豆酰奎尼酸和对香豆酰基莽草酸生成咖啡酰奎尼酸(绿原酸)和咖啡酰莽草酸[1,15]。然而,在拟南芥中C3H催化生成中间代谢物,而不合成绿原酸[20-21]。目前,C3H基因已被证明是金银花、桃等植物中绿原酸合成途径中的关键基因,其基因表达量与绿原酸含量呈明显的正相关[23,32-33]。
羟基肉桂酰辅酶A:莽草酸/奎尼酸-羟基肉桂酰转移酶(HCT)和羟基肉桂酰辅酶A:奎尼酸-羟基肉桂酰转移酶(HQT)都含有HXXXD和DFGWG这2个保守序列,属于BAHD酰基转移酶家族。然而,它们的酶学和分子表达特性不同,在不同植物中的作用和功能也有差异,HCT可以同时以莽草酸和奎尼酸作为底物,而HQT只以奎尼酸作为底物[44-45]。其中,HCT可以参与木质素和绿原酸的生物合成。在木质素合成途径中,HCT可以控制木质素不同单体间的相互转化,拟南芥和紫花苜蓿中HCT基因表达的下调导致木质素水平大幅降低[46]。在绿原酸合成途径中,HCT不仅可以正向催化羟基化香豆酰辅酶A与莽草酸或奎尼酸反应,生成对香豆酰莽草酸或对香豆酰奎尼酸,还可以逆向催化咖啡酰莽草酸形成咖啡酰辅酶A[20-21]。同样的,桃子PpHCT基因表达水平呈现与绿原酸含量相同的变化趋势,HCT可能是绿原酸生物合成的关键基因[23]。到目前为止,番茄[2]、梅[47]、朝鲜蓟[3]、毛白杨[48]、黄瓜[49]、金银花[31]和梨[9]等多个物种中HCT基因被克隆和鉴定。作为绿原酸生物合成下游的关键限速酶,HQT的生物学功能已在多种植物中得到验证,例如在番茄和烟草中,HQT的过表达导致绿原酸水平升高,而HQT的RNAi降低了绿原酸含量[2,22]。此外,HQT基因也参与了朝鲜蓟、金银花、马铃薯等植物的绿原酸合成[34-35]。
3.3 绿原酸生物合成相关转录因子
除结构基因外,一些转录因子(Transcription factor,TF)也被报道调控绿原酸的生物合成,这些转录因子往往可以特异性结合一个或多个结构基因的启动子元件,通过激活或抑制这些结构基因的表达从而调控绿原酸的生物合成,包括MYB家族、WRKY家族、ERF家族和bHLH家族等(表3)。目前,染色质免疫共沉淀(Chromatin immunoprecipitation,ChIP)、凝胶迁移试验(Eectrophoretic mobility shift assay,EMSA)、酵母单杂交试验(Yeast one hybrid,Y1H)、双荧光素酶报告试验(Dual-luciferase reporter assay,Dual-LUC)等试验方法被广泛用于鉴定转录因子对靶基因的转录激活或抑制作用[50]。

表3 植物中已鉴定的绿原酸生物合成相关转录因子
MYB是目前研究最广泛的转录因子家族之一,其生物学功能已在多种模式和非模式植物中得以验证。在胡萝卜中,DcMYB3和DcMYB5可以与顺式元件box-L结合,并激活DcPAL1和DcPAL3的转录,导致高水平的绿原酸积累[51]。拟南芥AtMYB11、AtMYB12和AtMYB111的过表达增加了转基因烟草和番茄中绿原酸和黄酮醇的生物合成[13,52-53];而拟南芥AtPAP1的过表达增加了桔梗毛状根中绿原酸的产生[54]。在烟草中,过表达NtMYB4a、NtMYB59都可以提高其绿原酸含量[55-56]。柑橘CsMYBF1在番茄中的过表达导致羟基肉桂酸化合物的大量积累,而CsMYBF1的 RNAi下调了柑橘愈伤组织中羟基肉桂酸和黄酮醇的含量,双荧光素酶分析结果表明,CsMYBF1 可以激活番茄和柑橘中苯丙素途径中基因的几个启动子,且对CHS基因启动子有不同的激活效应[57]。在金银花中,LmMYB15可以结合并激活4CL、MYB3和MYB4的启动子,从而促进绿原酸的生物合成和苯丙素代谢[58]。此外,一些负调控因子也被鉴定出,例如编码金鱼草转录因子基因AmMYB308和AmMYB330转入烟草中可抑制烟草绿原酸等多酚类物质的合成[59];在丹参中,SmMYB39作为阻遏因子对酚酸的生物合成产生抑制作用[60]。
同样地,绿原酸的生物合成也受WRKY家族的调控。作为编码杨树PtHCT2的激活因子基因PtWRKYs38、PtWRKYs45、PtWRKYs60、PtWRKYs89和PtWRKYs93在杨树原生质体中瞬时过表达显著增加了PtHCT2的表达水平[61]。在蒲公英中,TaWRKY14可以与proTaPAL1的W-box结合,过表达TaWRKY14增加了绿原酸的积累,同时增强了其对白粉病的抗性[62]。Wang[63]等鉴定出了烟草多酚类物质合成的两个关键WRKY转录因子,其中NtWRKY41a可以直接结合NtCCoAOMT、NtF6′H1、NtHST和NtGT3基因的启动子区域,过表达NtWRKY41a促进了绿原酸和木质素的生物合成,抑制东莨菪碱和黄酮类化合物的积累;NtWRKY33a可以直接结合NtMYB4和NtHCT的启动子区域,从而诱导这两个基因的转录,过表达NtWRKY33a促进了绿原酸的生物合成,抑制了芦丁、东莨菪碱和总多酚的积累[64]。
ERF 转录因子是AP2/ERF家族中最大的亚族,在丹参中,SmERF115直接与SmRAS1的启动子结合并激活其表达,过表达SmERF115增加了酚酸的含量,而沉默SmERF115降低了酚酸的含量[65]。在甘薯中,IbERF4可以与绿原酸合成途径中4CL基因的启动子结合并激活其表达,过表达IbERF4促进了绿原酸类物质合成[66]。
bHLH类转录因子也调控了绿原酸的生物合成。在蒲公英中,TabHLH1可以调控TaHQT2、Ta4CL、TaCHI和TaF3′H这些结构基因的表达,并且直接与TaHQT2和Ta4CL启动子区域的bHLH-binding作用元件结合,TabHLH1过表达株系的绿原酸和木犀草素含量显著升高,而TabHLH1-RNAi株系的绿原酸和木犀草素含量显著降低[6]。在丹参中,一个负调控转录因子基因SmbHLH60被克隆和鉴定,一方面SmbHLH60通过抑制SmTAT1和SmDFR等靶基因负调控丹参中酚酸和花青素的生物合成,另一方面SmbHLH60可以和SmMYC2形成异二聚体,以拮抗的方式调节酚酸和花青素的生物合成[67]。
此外,在金银花中,LjbZIP8可以特异性结合LjPAL2的G-box元件,而DNA甲基化通过介导LjbZIP8抑制PAL的表达来负调控绿原酸的合成[68]。在咖啡中,MADS-box家族的3个成员也参与了绿原酸的生物合成,其中CcFUL和CcAGL8是正调控因子,而CcAG2是负调控因子[69]。
4 外界因素对绿原酸生物合成的影响
绿原酸的生物合成受多种因素影响,除了基因型、组织部位、发育时期等内部因素外,还受到外界环境因素的诱导,如植物激素、光照、温度、水分、无机盐等(图2)。
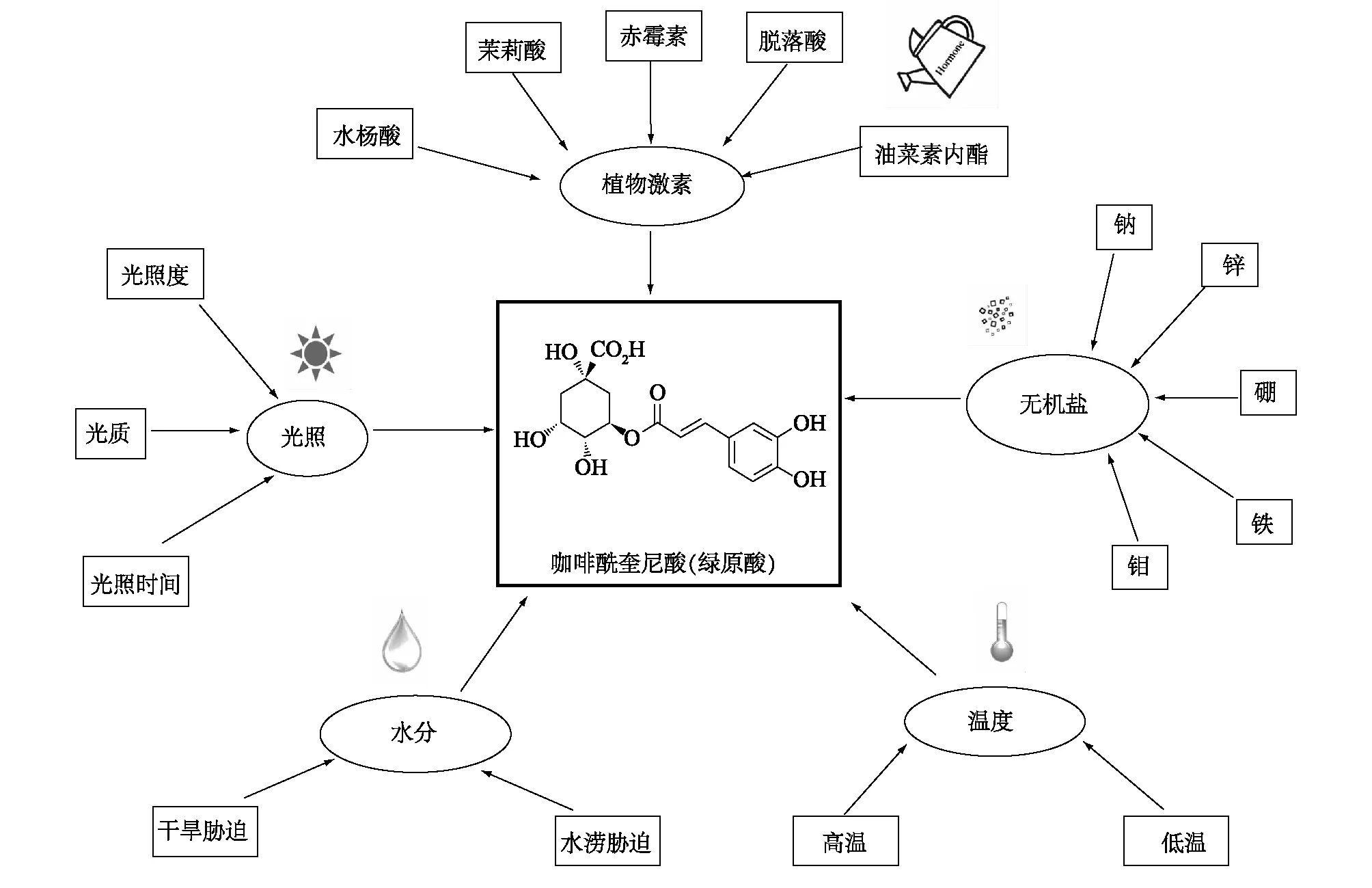
图2 多种外界因素对绿原酸生物合成的影响
4.1 植物激素对绿原酸生物合成的影响
植物激素是植物信号转导网络中至关重要的内源性信号分子,调控着植物生长发育过程中的许多重要生理活动。水杨酸(SA)和茉莉酸(JA)是与植物先天免疫有关的激素,被广泛用于诱导植物代谢物合成[70]。这2种激素可以通过上调绿原酸生物合成相关基因的表达来提高植物中绿原酸及其衍生物的含量,该结论已经在草莓[71]、苹果[72]、葡萄[73]、甜叶菊[74]、薄荷[75]和甘薯[76]等多种植物中得到了验证。
脱落酸(ABA)是响应植物胁迫的主要激素,植物中ABA的众多功能是通过ABF介导的转录过程实现的[77-78]。在丹参中,外源ABA可以促进毛状根中酚酸的积累[79],而SmSnRK2.6通过与SmAREB1相互作用,上调了SmPAL1、SmC4H、Sm4CL1、SmTAT、SmHPPR、SmRAS、SmCHS、SmCCR、SmCOMT和SMHPPD的表达水平,促进了丹参中酚酸的生物合成[80];同样的,在甘薯中ABA 通过诱导IbPAL1的表达增加了绿原酸的含量[81]。
赤霉素(GA3)在诱导和优化次生代谢产物上也发挥着重要的作用,但具有一定的剂量效应。在荞麦中,高浓度的GA3处理以浓度依赖性的方式逐渐降低芽中的绿原酸含量,而低浓度和中等浓度的GA3均可刺激绿原酸的积累[82]。在紫锥菊中,GA3可诱导毛状根中花青素、菊苣酸、咖啡石酸和咖啡酸等酚类物质的产生;在黄花蒿中,GA3可诱导毛状根中青蒿素等萜类物质的产生[83]。此外,其他激素如油菜素内酯(BR)处理增加了金银花花蕾中绿原酸含量[84],而1-甲基环丙烯(1-MCP)处理减缓了苹果中酚类物质的减少[85]。
4.2 光照对绿原酸生物合成的影响
不同光照度、光照时间和光质都会对植物中类黄酮、类胡萝卜素和酚类等次生代谢物质造成影响[86]。研究结果表明,光照度与绿原酸含量具有一定的相关性[87]。弱光条件下烟草中多酚、烟碱、类胡萝卜素含量显著减低,增加光照度后,这些次生代谢物质含量也会相应增加[88]。同样的,Hudina等[89]发现套袋处理后,梨果皮中酚类化合物(儿茶素、绿原酸、表儿茶素、对香豆酸、槲皮素3-O-半乳糖苷、槲皮素3-O-葡萄糖苷、槲皮素3-O-鼠李糖苷)的含量会降低。不同波长的光也会对植物中的次生代谢物质含量产生不同的影响。在青蒿中,红光和蓝光照射促进了青蒿素的积累[90]。在苦荞中,红光和蓝光照射显著增加了芦丁和绿原酸的含量[91]。在莴苣中,持续的蓝光照射和升高二氧化碳浓度也可以增加绿原酸含量[92]。在草莓中,蓝光通过诱导绿原酸合成途径中FvHCT基因的表达,增加了绿原酸的合成[93]。此外,紫外线(UV)照射也可以诱导酚类化合物的生物合成,其诱导作用已在杧果[94]、蓝莓[95]、草莓[96]和葡萄[97]等植物中报道。例如,在番茄中,采后UV-C照射可以诱导编码苯丙烷途径中关键酶的基因表达和酶活性,增加酚类物质和黄酮类物质的积累[98-99]。
4.3 温度对绿原酸合成的影响
温度也是影响植物绿原酸合成的重要因素。研究结果表明,低温可以诱导一些次生代谢物的积累,增加植物的抗氧化活性,提高植物的营养价值[100]。在咖啡中,绿原酸的生物合成受外界环境的调控,并产生温度依赖性[101]。Vithana等[102]发现5 ℃低温下杧果果肉中绿原酸、咖啡酸、杧果苷、没食子酸、香草酸、阿魏酸和类胡萝卜素含量显著高于13 ℃处理。此外,高温胁迫也对酚酸的积累产生一定的影响。牛俊萍等[103]发现35 ℃高温处理的李子果实的绿原酸和新绿原酸含量显著高于20 ℃处理。在金银花和菊芋中,高温胁迫可以增加绿原酸含量[104-105]。在玉米中,高温胁迫促进了其幼苗体内绿原酸合成,降低了咖啡酸与阿魏酸含量[106]。
4.4 水分对绿原酸合成的影响
水分胁迫是威胁全球植物生存和作物生产力的主要环境压力之一。适度的干旱胁迫和短时间干旱胁迫有利于菊花绿原酸和黄酮类物质的合成,提高菊花的药用品质,而过度干旱则抑制菊花次生代谢物的积累[107]。此外,当水分过多形成水涝胁迫时,烟草中各种酚类次生代谢产物含量也会增加[108-109]。
4.5 无机盐等对绿原酸合成的影响
大量研究结果表明,可以通过施加盐胁迫增加次生代谢物的积累来提高药用植物产品的质量[110-111]。Zhao等[112]发现,盐碱地植物叶片中绿原酸含量高于非盐碱地,水培盐胁迫增加了金银花绿原酸的含量。Yan等[113]发现,NaCl胁迫通过增加金银花中HQT和PAL基因的转录来刺激叶片绿原酸的合成,增加了金银花的药用品质。辛邵南[105]研究结果表明,在适当增加盐胁迫处理的时间和盐浓度后,菊芋叶片中绿原酸含量也会随之增加。
此外,植物的生长发育需要一定的营养元素,但具有一定的剂量效应。在杜仲中,叶面喷施1%的锌和1%的硼肥促进了绿原酸的合成[114];叶面喷施300 mg/L钼酸铵增加了菊花中绿原酸含量[115],而7.0 mg/L的硼肥虽然显著提高了菊花中次生代谢物的含量,却显著降低其产量[116];在金银花中,土壤根施铁、硼、钼元素可通过诱导相关基因的表达来增加绿原酸含量[117-118]。
5 展望
5.1 阐明绿原酸代谢的变化规律
绿原酸的各种衍生物和异构体种类众多,目前部分植物中绿原酸类物质的组成和含量还未明晰。近年来代谢组学得到快速发展,各种色谱联用技术为绿原酸类物质的鉴定提供了更高效的分析手段,特别是超高效液相色谱-质谱联用(UPLC-MS)因其分离效果好、精密度高、准确性好、分析速度快、仪器成本低等优点,仍然是大批量样本绿原酸定性定量分析的首选方法。中国拥有丰富的绿原酸植物资源,利用代谢组学阐明绿原酸合成通路上各代谢产物的积累规律,揭示苯丙烷代谢各代谢途径的动态平衡模式,仍然具有重要意义。
5.2 揭示植物绿原酸生物合成的调控机制
植物中绿原酸含量是典型的数量性状,受多基因控制,且其合成途径上大多数酶也都是由多基因家族编码的,单一候选基因很难完全解释植物中绿原酸的合成机制。此外,相关基因的生物学功能研究滞后,对于一些有遗传转化体系的植物,可以通过基因工程和代谢工程进一步扩大绿原酸的来源途径,提高绿原酸含量。对于一些没有遗传转化体系的植物,大多数研究只能依赖于基因表达分析、异源模式植物转化和体外分子试验,无法对结论进行明确地验证,通过转基因手段获得高绿原酸含量的植物材料还有很长的路要走。
此外,染色质免疫共沉淀(ChIP)、凝胶迁移试验(EMSA)、酵母单杂交试验(Y1H)、双荧光素酶报告试验(Dual-LUC)等试验方法也被广泛用于鉴定转录因子对靶基因的转录激活或抑制。转录因子MYB和WRKY对绿原酸的调控机制研究已经取得一定进展,但其他转录因子特异性结合的启动子核心结构域和功能性作用元件尚未得到表征。此外,关于绿原酸代谢的转录后水平和蛋白翻译修饰水平上的调控机理更是知之甚少,利用基因组、转录组、蛋白组、代谢组等多组学技术挖掘绿原酸代谢的分子机制是未来研究的重要方向。
5.3 探索外界因素的作用机理
除了内部遗传因素,外界环境也是影响植物绿原酸积累的重要因素。尽管目前已经发现植物激素、光照、温度、水分和无机盐等对绿原酸生物合成的影响,但这些信号因子的作用途径仍有待进一步探索。掌握各类环境条件对绿原酸合成的影响机制,有利于我们在生产上采取适当的栽培管理措施来提升植物中绿原酸生物合成,开发富含绿原酸的植物产品。

