副猪嗜血杆菌血清7型crp基因缺失株的部分生物学特性
徐引弟, 蔡旭旺, 徐晓娟, 王治方, 张家庆, 朱文豪, 雷亚楠, 张立宪, 李海利, 焦文强, 王克领
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002;2.华中农业大学动物医学院农业微生物国家重点实验室,湖北 武汉 430070)
引起猪格拉瑟病(Glasser s disease)的副猪嗜血杆菌(HPS)是临床上危害猪群健康最严重的细菌性病原之一。格拉瑟病以猪严重上呼吸道感染、多发性纤维素性浆膜炎、关节炎、脑膜炎为特征,给全球及中国的养猪业造成巨大的经济损失[1-4]。副猪嗜血杆菌血清型有15种,其中血清1型、血清5型、血清10型、血清12型、血清13型、血清14型被认为是高毒力的血清型,血清2型、血清4型、血清15型为中等毒性,血清3型、血清6型、血清7型、血清8型、血清9型、血清11型被认为是无毒的[5-7]。但血清7型是近年来临床典型发病病例中分离比例越来越高的血清型,也是危害越来越严重的血清型[8-10]。
crp基因编码cAMP受体蛋白(cAMP receptor protein,CRP),全长675 bp核苷酸,编码225个氨基酸,是大肠杆菌中7个系统调控因子之一[11-14]。CRP调控490多个基因的表达,在细菌感染过程中,系统调控因子在细菌适应环境变化方面起着至关重要的作用。CRP可以提高大肠杆菌在各种压力条件下的适应性能,CRP蛋白调节多种基因的表达,与多种毒力因子的表达有关。由于crp基因与毒力密切相关,常被选为研制减毒疫苗的靶点[14-16]。
crp基因在副猪嗜血杆菌中的功能报道较少,Jiang等[17-18]的研究结果显示,crp基因参与血清5型HPS的生长、生物膜形成、应激耐受、抗血清活性提高和铁利用。进一步试验发现,crp基因缺失后HPS毒力显著降低。由于血清7型在临床上分离比例越来越高,而目前还没有针对血清7型的疫苗。因此本研究构建副猪嗜血杆菌血清7型crp缺失株,对缺失株的生长、抗性及毒力进行初步研究,为进一步研究crp基因在HPS中的功能以及筛选更加安全有效的HPS疫苗候选株提供科学依据。
1 材料与方法
1.1 菌株和质粒
副猪嗜血杆菌血清7型临床分离株HPS7由本实验室分离鉴定并保存[8-10]。自杀性质粒pK18mobsacB、副猪嗜血杆菌-大肠杆菌穿梭载体pSHK3-Kan由华中农业大学徐晓娟、蔡旭旺副教授馈赠。
1.2 引物的设计与合成
参考GenBank报道的副猪嗜血杆菌血清7型vHPS7株全基因组(CP049089)序列,设计含有酶切位点及USS序列 (DNA摄取信号序列)的引物crpuF/crpuR、crpdF/crpdR,用于扩增crp上下游同源臂,crpF/crpR用于扩增crp基因,去掉酶切位点和USS序列的crpuuF/crpddR用于鉴定crp亲本株与缺失株,参考质粒pSHK3-Kan序列设计KanF/KanR用于扩增卡那霉素基因(Kan)。构建及鉴定副猪嗜血杆菌crp基因缺失株的引物见表1,引物由北京擎科生物科技有限公司合成。

表1 用于构建和鉴定crp缺失株的引物
1.3 试验动物
雌性豚鼠购自华兴实验动物养殖场,6~8周龄,体质量200~250 g。
1.4 crp基因序列同源性分析
使用MEGA 6软件,分析副猪嗜血杆菌crp基因序列与同一种属中其他菌株crp基因序列之间的同源性。在TSA[胰蛋白胨大豆琼脂培养基,含5%的胎牛血清,0.01%的NAD(辅酶Ⅰ)]上复苏本实验室分离鉴定保存的副猪嗜血杆菌临床株和标准株,提取基因组,用引物crpF/crpR扩增crp基因,测序。
1.5 crp缺失株的构建与鉴定
将副猪嗜血杆菌血清7型菌株HPS7复苏,挑取单菌落于5 ml TSB(胰蛋白胨大豆肉汤培养基,含5%的胎牛血清,0.01%的NAD)中,37 ℃培养12 h,离心去上清液重悬菌体,提取基因组,分别用引物crpuF/crpuR和crpdF/crpdR扩增crp基因上、下游片段,用引物KanF/KanR从pSHK3质粒中扩增909 bp卡那霉素基因。利用PCR扩增原理,用引物crpuF/crpdR将这3个片段通过PCR重叠延伸连接在一起,形成重叠片段UKD。使用BamHⅠ和EcoRⅠ酶切UKD片段,连接到自杀性质粒pK18mobsacB,阳性质粒命名为pKUKD。参考文献[17]报道的自然转化法,大量提取重组质粒pKUKD,测定A260值。挑取HPS7单菌落于5 ml TSB中,37 ℃培养至OD600值为0.8,取20 μl菌液加入20 μl 8 mmol/L cAMP (环腺苷酸),混匀,反应10 min,加入2 μg重组质粒pKUKD,混匀,反应10 min后加入到TSA固体培养基上,涂布均匀,37 ℃孵育5 h。用TSB洗涤菌体,转移到含Kan的TSA上,37 ℃培养24~48 h。挑取转化子,提取基因组,用引物crpuuF/crpddR、crpF/crpR、KanF/KanR扩增UKD序列、crp基因和Kan,电泳检测目的片段的大小及有无来鉴定是否成功构建crp缺失株,并测序验证。
1.6 crp缺失株的生长曲线
HPS7及其crp缺失株△crp在TSB中37 ℃培养过夜,用TSB将HPS7、△crp的OD600值调整为0.8。按1∶1 000的接种比例将HPS7、△crp接种至新的锥形瓶中,在气浴恒温振荡器中37 ℃、180 r/min培养。每隔2 h取样100 μl,加入到900 μl稀释液中10倍稀释,取样至48 h,根据菌液OD600值和预试验取3个适宜稀释度,取100 μl在平板上涂匀,各3个重复,置于37 ℃培养36 h,统计菌落数,取平均值,绘制出crp缺失株△crp的生长曲线。
1.7 crp缺失株的自凝特性试验
HPS7及其crp缺失株△crp在2 ml TSB中培养过夜,测定OD600,用TSB调节OD600值为0.8,37 ℃静置培养,分别在0 h、3 h、6 h、9 h、12 h、24 h、36 h、48 h和60 h时,从培养液顶部取200 μl,测定OD600。
1.8 生物膜的形成能力试验
将HPS7及其crp缺失株△crp培养过夜,OD600值调整为0.8。96孔微孔板中每孔中加入90 μl培养液,加入10 μl 菌液,37 ℃孵育60 h,吸去菌液,用200 μl无菌PBS(磷酸缓冲液)洗3次,100 μl甲醇固定15 min,风干后,加入100 μl 1%结晶紫染色10 min,清洗、干燥,待完全干燥后,加入100 μl的33%乙酸溶液溶解,用酶标仪测量OD630值。3个重复,取平均值。用未接种菌液的作为空白对照。
1.9 抗生素抗性试验
采用Kirby-Bauer纸片扩散法(K-B法)进行抗生素抗性试验,将过夜培养的HPS7及其crp缺失株△crp,用灭菌PBS调整为适宜浓度,将菌液均匀涂抹于TSA上,选取24种临床上常用的药敏片(包括头孢噻呋、头孢他啶、氨苄西林、替米考星、阿莫西林、青霉素G、阿米卡星、氟苯尼考、庆大霉素、头孢噻肟、痢特灵、链霉素、强力霉素、四环素、土霉素、氧氟沙星、诺氟沙星、环丙沙星、恩诺沙星、左氟沙星、复方新诺明、阿奇霉素、红霉素、罗红霉素),将药敏片均匀贴于涂有菌液的平板上,37 ℃培养36 h,测量药敏片抑菌圈直径。
1.10 豚鼠感染试验
选取体质量为250 g左右的清洁级豚鼠45只,随机分成9组(HPS7、△crp菌株各4组,空白对照1组),每组5只。将HPS7和△crp接种到TSA固体培养基上,过夜培养,用无菌生理盐水洗涤,反复吹打,OD600值调整为2.0,10倍稀释成4个滴度梯度,每个滴度腹腔注射5只豚鼠,每只豚鼠注射1 ml,对照组注射生理盐水,同时原液10倍稀释,进行活菌计数。观察豚鼠发病和死亡情况,连续观察14 d,死亡豚鼠取脏器组织抹片观察,接种到TSA培养基。肝脏、肺脏用多聚甲醛固定后送武汉赛维尔生物科技有限公司进行病理切片。
2 结果与分析
2.1 crp基因序列同源性比对
PCR扩增副猪嗜血杆菌各血清型临床分离株和15个标准株的crp基因,结果crp基因在副猪嗜血杆菌的临床分离株和标准株中均能扩增出(图1),测序比对,在不同副猪嗜血杆菌血清型和标准株之间crp基因高度同源,同源性均在95%以上。表明crp基因在副猪嗜血杆菌中是保守的基因。

M:DL2000 marker;1~15:HPS血清1~15型标准株;16~22:HPS临床分离株血清2型、4型、5型、6型、7型、9型、13型;23:阴性对照;24:空白对照。
2.2 crp缺失株的构建与验证
如图2 所示,使用引物crpuuF/crpddR鉴定UKD,缺失株片段长2 337 bp,亲本株片段长2 103 bp。使用引物crpF/crpR鉴定crp基因,缺失株不能扩增到675 bp的crp基因片段,亲本株能扩增到。使用引物KanF/KanR鉴定Kan基因,缺失株扩增到909 bp的Kan基因,亲本株不能扩增到。阳性扩增片段测序比对结果显示100%同源。表明HPS7的crp基因缺失株构建成功。

M:DL2000 marker;A:UKD(crp上游片段+kan基因+crp下游片段);B:crp基因;C.Kan基因。A图中,1:空白对照;2、4:HPS7;3:PKUKD;5~14:缺失株; B图中,1:空白对照;2、4:HPS7;3:PKUKD;5~14:缺失株;C图中,1:PKUKD;2~12:缺失株;13:HPS7;14:空白对照。
2.3 crp缺失株的生长特性
在37 ℃下对HPS7和△crp菌株的生长特性进行测定,结果2种菌株的生长特性有显著差异。与亲本株HPS7相比,△crp的菌落明显细小,生长速度明显缓慢(图3、图4)。表明crp基因对副猪嗜血杆菌血清7型的生长有明显的影响。

图3 副猪嗜血杆菌血清7型菌株(HPS7)和crp缺失株(△crp)的菌落形态

图4 副猪嗜血杆菌血清7型菌株(HPS7)和crp缺失株(△crp)的生长曲线
2.4 crp缺失株的自身凝集能力
与HPS7相比,△crp表现出自身凝集能力降低,HPS7凝集较快,△crp凝集较慢,60 h后,HPS7的OD600值明显低于△crp(图5),表明,crp基因的缺失对HPS7的自身凝集有影响。
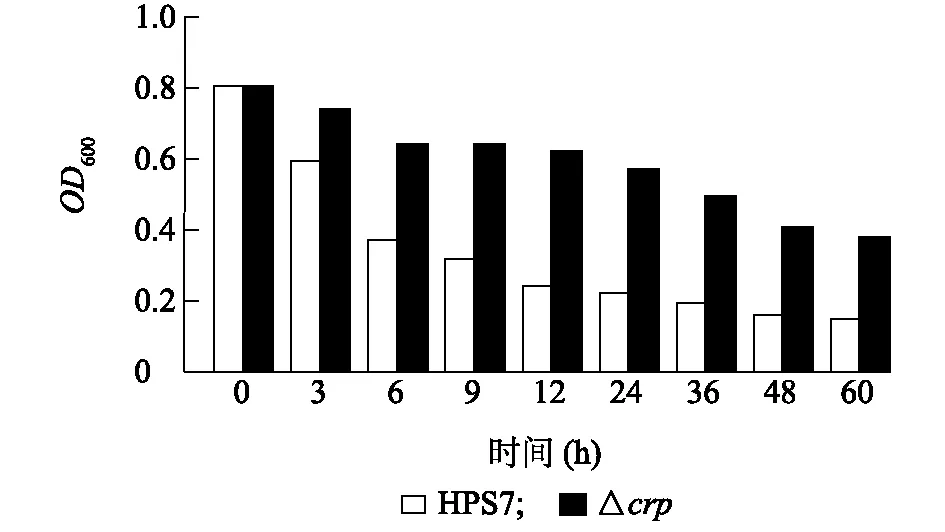
图5 副猪嗜血杆菌血清7型菌株(HPS7)和crp缺失株(△crp)的自凝集能力
2.5 crp缺失株的生物膜形成能力
比较HPS7和△crp在聚苯乙烯微滴板中形成生物膜的能力,进行定量分析。肉眼可见△crp生物膜形成明显比HPS7弱(图6),溶解后,测定的OD630值比HPS7低(图7)。结果表明crp基因在HPS7中的缺失降低了细菌形成生物膜的能力,crp基因与生物膜形成有关。

A:聚苯乙烯微滴板中形成的生物膜;B:OD630值。

图7 豚鼠接种副猪嗜血杆菌血清7型菌株(HPS7)后发病死亡情况
2.6 crp缺失株对抗生素的抗性
HPS7及其crp缺失株△crp对不同药物的敏感性差异见表2,crp基因缺失后,对不同药物的敏感性差异较为明显,对大部分药物如头孢噻呋、头孢他啶、氨苄西林、替米考星、阿莫西林、青霉素G、庆大霉素、头孢噻肟、痢特灵、链霉素、强力霉素、四环素、土霉素、氧氟沙星、恩诺沙星、左氟沙星、阿奇霉素、罗红霉素抗性降低,敏感性增加(P<0.05);对少部分药物如阿米卡星、氟苯尼考、诺氟沙星、环丙沙星、复方新诺明、红霉素抗性增加,敏感性降低(P<0.05),表明crp基因对药物的敏感性影响较大。

表2 副猪嗜血杆菌血清7型菌株(HPS7)、crp缺失株(△crp)药敏试验结果
2.7 crp缺失株对豚鼠的感染
利用HPS7和△crp菌株对豚鼠致病力试验比较HPS7和△crp菌株的毒力差异,豚鼠感染试验发病死亡情况见表3。结果显示,HPS7的1 ml 1.0×1011剂量组未发病,1 ml 1.0×1012剂量组有2只发病,感染2 h后出现了明显的发病症状,如精神沉郁、被毛粗乱、震颤、卷缩、挤堆等症状,1 ml 1.0×1013剂量组5只均发病,感染9 h后出现了死亡,共死亡1只,1 ml 1.0×1014剂量组5只均发病,感染6 h后出现了死亡,共死亡3只。△crp的1 ml 1.0×1011、1.0×1012剂量组均未发病,1 ml 1.0×1013剂量组2只发病,未发生死亡,1 ml 1.0×1014剂量组5只均发病,死亡1只,△crp组发病症状明显轻于HPS7组,对照组未出现任何症状(图7)。剖检发病死亡豚鼠发现其肝脏、肺脏出血,部分腹壁出血,腹腔内有腹水、纤维素性渗出,程度不一(图8)。肝、肺、心、脾、肾组织抹片观察到短杆状细菌,脑部未见细菌。各个脏器接种crp缺失株后培养,肝、肺、心、脾、肾分离到与接种菌株一致的细菌,脑部没有分离出与接种菌株一致的细菌。发病豚鼠病理切片显示,肝脏出现不同程度的肝细胞水样变性,肝细胞肿胀,淋巴细胞、中性粒细胞浸润,肺脏不同程度的出血,肺泡壁增厚,淋巴细胞与中性粒细胞浸润(图9)。以上结果表明低剂量HPS7对豚鼠不致病,剂量越高致病力越强,根据Reed-Munch法计算出HPS7的LD50为3.162×1013CFU,△crp的LD50大于1.0×1014CFU,△crp的毒力显著低于HPS7。

图8 接种副猪嗜血杆菌血清7型菌株(HPS7)后发病死亡豚鼠解剖情况
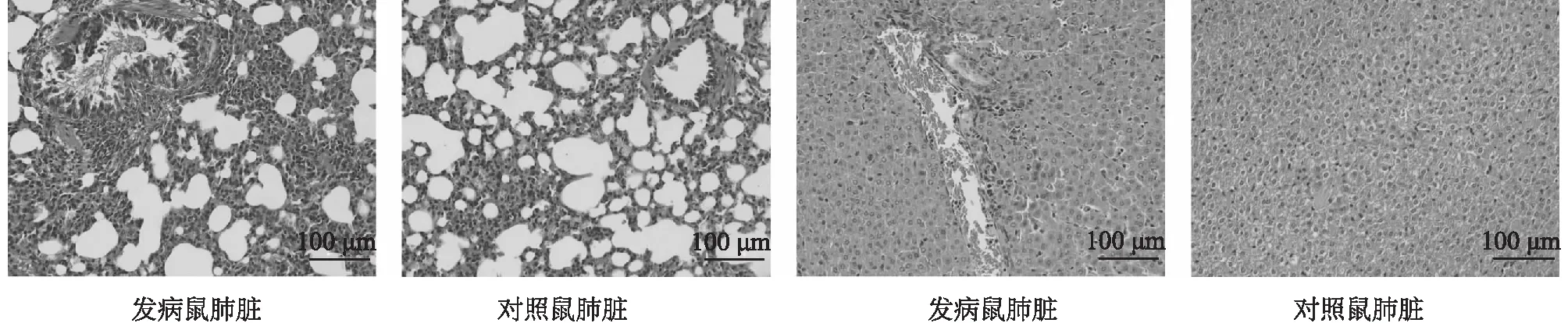
图9 接种副猪嗜血杆菌血清7型菌株(HPS7)发病死亡豚鼠病理切片

表3 副猪嗜血杆菌血清7型菌株(HPS7)、crp缺失株(△crp)豚鼠致病性试验结果
3 讨论
副猪嗜血杆菌引起的猪格拉瑟病是危害最为严重也是防控难度最大的疫病之一,由于副猪嗜血杆菌血清型众多,相互之间缺乏交叉保护力,且同一血清型不同毒株的毒力差异很大,其中血清7型被认为是无毒力毒株,但是近年来我们不断地从临床典型发病甚至死亡病例中分离到血清7型HPS,分离出的比例越来越高,也是危害越来越严重的血清型,因此有必要重视血清7型。在前期研究中HPS7低剂量感染豚鼠,毒力较低,而在加大剂量感染时,也能引起豚鼠发病死亡,血清7型也应该是有毒力的,因此迫切需要研制出更加安全有效的血清7型弱毒株。
crp基因是系统调控因子之一,对环境适应和毒力调节起着重要作用。副猪嗜血杆菌血清7型crp基因缺失后,生长速度明显慢于亲本菌,生物膜形成能力明显减弱,自凝速度减慢,表明crp基因在HPS的生长特性中起重要作用,这与Jiang等[17]关于crp缺失对血清5型副猪嗜血杆菌标准株的生长特性、生物膜、血清抗性均产生影响的报道一致。副猪嗜血杆菌crp基因缺失对不同抗生素的抗性影响不一致,crp基因缺失对大部分抗生素的抗性降低,敏感性增加。为进一步了解crp基因与HPS致病性的关系,试验用豚鼠测定了亲本株和缺失株的毒力,低剂量血清7型均是无毒力的,但在高剂量和超高剂量感染时血清7型亲本株表现出毒力,缺失株毒力明显减弱。高剂量组引起豚鼠急性死亡,发病死亡豚鼠表现出与仔猪副猪嗜血杆菌引起的猪格拉瑟病相似的临床症状和病理变化,表明crp基因参与了HPS7的毒力调节,毒力试验结果与Jiang等[18]2021年的报道相似,但也有差异,Jiang等用血清5型HPS标准株及其crp缺失株各接种10只Balb/C小鼠,亲本株血清5型标准株接种小鼠2 d内全部死亡,而crp缺失株接种小鼠观察期内全部存活,毒力完全消失,而本研究中HPS7的crp缺失株毒力有所降低,但还有一定的毒力。副猪嗜血杆菌的毒力因子极多,致病机理十分复杂,crp调节的机制也十分复杂,豚鼠和小鼠的敏感性也有差异,不同血清型,不同毒株crp基因缺失后,结果可能会有所不同,为了探究crp基因对不同血清型和不同毒株毒力的影响,需要对更多的血清型和毒株进行进一步的研究。
4 结论
本研究构建了副猪嗜血杆菌血清7型临床分离株HPS7的crp缺失株,crp基因缺失后,菌株生长速度减慢,生物膜形成能力减弱,自身凝集能力降低,对大部分抗生素的抗性降低,对豚鼠的毒力降低,说明crp基因对副猪嗜血杆菌血清7型的生长、抗药性和毒力有明显的影响。本结果为进一步研究crp基因在副猪嗜血杆菌血清7型中的功能及筛选更加安全有效的副猪嗜血杆菌血清7型弱毒株提供参考。

